1 . 根据下列实验过程,请回答:
(1)在常温下,将氯气通入氢氧化钠溶液中,所发生反应的离子方程式为:_______ ;
(2)将上述呈碱性的溶液与FeCl3溶液混合,可制得一种新型绿色消毒剂——高铁酸钠(Na2FeO4),反应如下:3ClO-+2Fe3++10OH-=2FeO +3Cl-+5H2O,则该反应中的氧化产物是
+3Cl-+5H2O,则该反应中的氧化产物是_______ (填离子符号),当反应中转移电子的数目是0.3NA时,所消耗的氧化剂的物质的量为_______ 。
(1)在常温下,将氯气通入氢氧化钠溶液中,所发生反应的离子方程式为:
(2)将上述呈碱性的溶液与FeCl3溶液混合,可制得一种新型绿色消毒剂——高铁酸钠(Na2FeO4),反应如下:3ClO-+2Fe3++10OH-=2FeO
 +3Cl-+5H2O,则该反应中的氧化产物是
+3Cl-+5H2O,则该反应中的氧化产物是
您最近一年使用:0次
名校
2 . 医疗机构常用质量分数为7.45% 的次氯酸钠消毒液(密度为1.00 g·cm−3)进行消毒,回答下列问题:
(1)该消毒液的物质的量浓度为_______ mol·L−1(保留到小数点后2位)。
(2)次氯酸钠消毒液使用时需要稀释。某化学实验小组用上述消毒液配制95mL 0.7mol·L−1的溶液。
①需用量筒量取该次氯酸钠消毒液_______ mL;量取时若仰视,所配溶液的浓度将_______ (填“偏高”、“偏低”或“无影响”)。
②定容时加蒸馏水,若不慎超过刻度线,应采取的处理方法是_______ 。
(3)资料显示,次氯酸钠消毒液不能与洁厕灵(含盐酸)混合使用,对此某小组开展如下研究。

能观察到两表面皿之间出现黄绿色气体,写出该反应的离子方程式_______ ;蘸有NaOH溶液的脱脂棉吸收黄绿色气体的离子方程式是_______ 。
(1)该消毒液的物质的量浓度为
(2)次氯酸钠消毒液使用时需要稀释。某化学实验小组用上述消毒液配制95mL 0.7mol·L−1的溶液。
①需用量筒量取该次氯酸钠消毒液
②定容时加蒸馏水,若不慎超过刻度线,应采取的处理方法是
(3)资料显示,次氯酸钠消毒液不能与洁厕灵(含盐酸)混合使用,对此某小组开展如下研究。

能观察到两表面皿之间出现黄绿色气体,写出该反应的离子方程式
您最近一年使用:0次
22-23高二上·全国·课时练习
3 . 电解饱和食盐水的装置如图所示,若收集的H2为2L,则同样条件下收集的Cl2_____ (填“>”“=”或“<”)2L,原因是_____ 。装置改进后,可用于制备NaOH溶液,若测定NaOH溶液的浓度,常用的方法为_____ 。


您最近一年使用:0次
4 . 回答下列问题
(1)如图所示,将氯气依次通过盛有干燥有色布条的广口瓶和盛有潮湿有色布条的广口瓶,可观察到的现象:
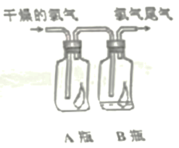
A瓶中有色布条_______ ;B瓶中有色布条_______ 。
(2)为防止氯气尾气污染空气,根据氯水显酸性的性质,可用_______ 溶液吸收多余的氯气,原理是_______ (用化学方程式表示)
(3)根据以上原理,工业上常用廉价的 吸收工业氯气尾气制得漂白粉,漂白粉的有效成分是
吸收工业氯气尾气制得漂白粉,漂白粉的有效成分是_______ (填化学式),长期露置于空气中的漂白粉,加稀盐酸后产生的气体是_______ (用字母代号填)。
A. B.
B. C.
C. D.
D.
(1)如图所示,将氯气依次通过盛有干燥有色布条的广口瓶和盛有潮湿有色布条的广口瓶,可观察到的现象:

A瓶中有色布条
(2)为防止氯气尾气污染空气,根据氯水显酸性的性质,可用
(3)根据以上原理,工业上常用廉价的
 吸收工业氯气尾气制得漂白粉,漂白粉的有效成分是
吸收工业氯气尾气制得漂白粉,漂白粉的有效成分是A.
 B.
B. C.
C. D.
D.
您最近一年使用:0次
名校
解题方法
5 . 某学习小组的同学用MnO2和浓盐酸反应来制备纯净的氯气并验证其有无漂白性,设计装置如图:

(1)A装置中反应的化学方程式:____________________________ ;D装置中现象:___________________ ;该套装置存在的缺陷:_________________________________ 。
(2)取少量E装置中溶液与洁厕灵(含盐酸)混合产生有毒气体,原因是_______________________ (用离子方程式表示)。
(3)若将Cl2通入热的烧碱溶液中,可以发生如下两个反应:
Cl2+2NaOH=NaCl+NaClO+H2O和3Cl2+6NaOH=5NaCl+NaClO3+3H2O。
从氧化还原角度分析Cl2表现了_______________ 。当混合液中Cl-和ClO 的个数比为15∶2时,混合液中ClO-和ClO
的个数比为15∶2时,混合液中ClO-和ClO 的个数比为
的个数比为__________________ 。
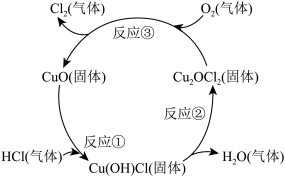
(4)近年来,随着化学工业的快速发展,氯气的需求迅速增加。下图是制备氯气的原理示意图,其反应物是___________ ,CuO的作用是_____________ ,写出总反应的化学方程式,并用单线桥法标出该反应的电子转移情况______________________________ 。

(1)A装置中反应的化学方程式:
(2)取少量E装置中溶液与洁厕灵(含盐酸)混合产生有毒气体,原因是
(3)若将Cl2通入热的烧碱溶液中,可以发生如下两个反应:
Cl2+2NaOH=NaCl+NaClO+H2O和3Cl2+6NaOH=5NaCl+NaClO3+3H2O。
从氧化还原角度分析Cl2表现了
 的个数比为15∶2时,混合液中ClO-和ClO
的个数比为15∶2时,混合液中ClO-和ClO 的个数比为
的个数比为(4)近年来,随着化学工业的快速发展,氯气的需求迅速增加。下图是制备氯气的原理示意图,其反应物是

您最近一年使用:0次
2022-12-14更新
|
396次组卷
|
3卷引用:湖南省衡阳县第五中学2022-2023学年高一上学期期末考试化学试题
名校
6 . 现有下列物质:①熔融NaCl ② 溶液 ③氯气 ④
溶液 ③氯气 ④ ⑤NaOH溶液 ⑥氢氧化铁胶体 ⑦
⑤NaOH溶液 ⑥氢氧化铁胶体 ⑦ ⑧铜 ⑨ 过氧化钠 ⑩
⑧铜 ⑨ 过氧化钠 ⑩
(1)上述物质中属于电解质的是_______ (填标号)。
(2)将②逐滴加入⑥中的现象是_______ 。
(3)④加入过量的氢氧化钡溶液中,发生反应的离子方程式为_______ 。
(4)③通入石灰乳中,发生反应的离子方程式为_______ 。
(5)⑦与⑨反应的方程式为:_______ ,标准状况下,生成22.4L氧气转移的电子数目为_______ 。
 溶液 ③氯气 ④
溶液 ③氯气 ④ ⑤NaOH溶液 ⑥氢氧化铁胶体 ⑦
⑤NaOH溶液 ⑥氢氧化铁胶体 ⑦ ⑧铜 ⑨ 过氧化钠 ⑩
⑧铜 ⑨ 过氧化钠 ⑩
(1)上述物质中属于电解质的是
(2)将②逐滴加入⑥中的现象是
(3)④加入过量的氢氧化钡溶液中,发生反应的离子方程式为
(4)③通入石灰乳中,发生反应的离子方程式为
(5)⑦与⑨反应的方程式为:
您最近一年使用:0次
解题方法
7 . 氯及其化合物在生产生活中有重要的作用。已知某品牌的84消毒液和洁厕灵的部分标签如图所示:
回答下列问题:
(1)工业上通常将氯气通入氢氧化钠溶液中制备84消毒液,请写出该反应的离子方程式___________ 。
(2)各类杀菌消毒剂使用时,必须严格按照使用说明。
①巴西奥运会期间,由于工作人员将“84”消毒液与双氧水两种消毒剂混用,导致游泳池藻类快速生长,池水变绿。一种可能的原因是 与
与 反应产生
反应产生 促进藻类快速生长。该反应说明氧化性:
促进藻类快速生长。该反应说明氧化性:
___________  (填“>”或“<”)。当有0.1
(填“>”或“<”)。当有0.1
 生成时,反应中转移电子为
生成时,反应中转移电子为___________  。
。
②王女士在清洁马桶时,在倒入上述洁厕灵后将上述84消毒液也倒入其中,随后突然晕倒,原因是该过程产生了有毒的氯气,该过程发生反应的离子方程式为___________ 。
| ××牌洁厕灵 规格:1L 有效成分:盐酸,表面活性剂,香精 | ××牌84消毒液 规格:500  有效成分:  (“有效氯”含量:5.5%~6.5%) |
回答下列问题:
(1)工业上通常将氯气通入氢氧化钠溶液中制备84消毒液,请写出该反应的离子方程式
(2)各类杀菌消毒剂使用时,必须严格按照使用说明。
①巴西奥运会期间,由于工作人员将“84”消毒液与双氧水两种消毒剂混用,导致游泳池藻类快速生长,池水变绿。一种可能的原因是
 与
与 反应产生
反应产生 促进藻类快速生长。该反应说明氧化性:
促进藻类快速生长。该反应说明氧化性:
 (填“>”或“<”)。当有0.1
(填“>”或“<”)。当有0.1
 生成时,反应中转移电子为
生成时,反应中转移电子为 。
。②王女士在清洁马桶时,在倒入上述洁厕灵后将上述84消毒液也倒入其中,随后突然晕倒,原因是该过程产生了有毒的氯气,该过程发生反应的离子方程式为
您最近一年使用:0次
解题方法
8 . 填空
(1)金属钠与水反应的化学方程式:_______
(2)写出次氯酸见光分解的化学方程式:_______
(3)写出氯气和氢氧化钠溶液反应的离子方程式 :_______
(1)金属钠与水反应的化学方程式:
(2)写出次氯酸见光分解的化学方程式:
(3)写出氯气和氢氧化钠溶液反应的
您最近一年使用:0次
名校
9 . 氯是海水中含量最丰富的元素,氯的单质及其化合物在生成、生活领域应用广泛。
(1)自来水厂常用液氯进行杀菌消毒。氯气溶于水发生的可逆反应为_____________ (用离子方程式表示)。
(2)用液氯消毒会产生微量有机氯代物,危害人体健康,可以使用二氧化氯(ClO2)代替液氯。工业上以二硫化亚铁(FeS2)、氯酸钠(NaClO3)和硫酸溶液混合制备二氧化氯气体。已知黄铁矿中的硫元素最终氧化成 ,写出制备二氧化氯的离子方程式
,写出制备二氧化氯的离子方程式_______ 。
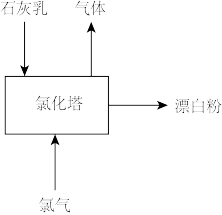
(3)生产漂白粉工厂的主要设备是氯化塔,塔从上到下分为四层,如图为生产流程示意图。生产漂白粉反应的化学方程式为_______ 。实际生产中,将石灰乳(含有3%~6%水分的熟石灰)从塔顶喷洒而下,氯气从塔的最底层通入。这样加料的目的是_______ 。
(1)自来水厂常用液氯进行杀菌消毒。氯气溶于水发生的可逆反应为
(2)用液氯消毒会产生微量有机氯代物,危害人体健康,可以使用二氧化氯(ClO2)代替液氯。工业上以二硫化亚铁(FeS2)、氯酸钠(NaClO3)和硫酸溶液混合制备二氧化氯气体。已知黄铁矿中的硫元素最终氧化成
 ,写出制备二氧化氯的离子方程式
,写出制备二氧化氯的离子方程式(3)生产漂白粉工厂的主要设备是氯化塔,塔从上到下分为四层,如图为生产流程示意图。生产漂白粉反应的化学方程式为

您最近一年使用:0次
解题方法
10 . 化学工业为疫情防控提供了强有力的物质支撑。次氯酸钠和二氧化氯(分子式为ClO2,其中Cl元素的化合价为+4价)在水处理等方面有广泛应用,是一种高效安全的灭菌消毒剂。
(1)NaClO溶液可由低温下将Cl2缓慢通入NaOH溶液中而制得。制备NaClO的化学方程式为_______ ;用于环境杀菌消毒的NaClO溶液须稀释并及时使用,若在空气中暴露时间过长且见光,将会导致消毒作用减弱,其原因是_______ 。
(2)ClO2的制备方法,有下列两种:
方法Ⅰ:2NaClO3 + 4HCl =2ClO2↑ + Cl2↑+ 2NaCl + 2H2O
方法Ⅱ:2NaClO3 + H2O2 +H2SO4 = 2ClO2↑ + O2↑+ Na2SO4 +2H2O
方法Ⅰ反应中,氧化产物为_______ (填化学式);方法Ⅱ反应中,产生1mol ClO2气体,电子转移_______ mol。
(3)将ClO2溶于水得到溶液,为测定其浓度,进行以下实验操作:
步骤1 取待测ClO2溶液20.00mL于锥形瓶中;
步骤2 用稀硫酸调节溶液至酸性,加入足量的KI晶体充分反应,使ClO2转化为Cl-;发生的反应为:4ClO2 + 20 KI +8H2SO4=4KCl +10I2 + 8 X + 8H2O
步骤3 逐滴加入0.1500mol·L-1的Na2S2O3溶液,发生的反应为:I2 + 2Na2S2O3= Na2S4O6 +2NaI,当将步骤2中反应生成的I2恰好完全反应时,消耗Na2S2O3溶液的体积为24.00mL。
①写出步骤2反应方程式中的X的化学式为_______ ;
②计算:ClO2溶液的物质的量浓度为_______ mol·L-1(写出计算过程)。
(1)NaClO溶液可由低温下将Cl2缓慢通入NaOH溶液中而制得。制备NaClO的化学方程式为
(2)ClO2的制备方法,有下列两种:
方法Ⅰ:2NaClO3 + 4HCl =2ClO2↑ + Cl2↑+ 2NaCl + 2H2O
方法Ⅱ:2NaClO3 + H2O2 +H2SO4 = 2ClO2↑ + O2↑+ Na2SO4 +2H2O
方法Ⅰ反应中,氧化产物为
(3)将ClO2溶于水得到溶液,为测定其浓度,进行以下实验操作:
步骤1 取待测ClO2溶液20.00mL于锥形瓶中;
步骤2 用稀硫酸调节溶液至酸性,加入足量的KI晶体充分反应,使ClO2转化为Cl-;发生的反应为:4ClO2 + 20 KI +8H2SO4=4KCl +10I2 + 8 X + 8H2O
步骤3 逐滴加入0.1500mol·L-1的Na2S2O3溶液,发生的反应为:I2 + 2Na2S2O3= Na2S4O6 +2NaI,当将步骤2中反应生成的I2恰好完全反应时,消耗Na2S2O3溶液的体积为24.00mL。
①写出步骤2反应方程式中的X的化学式为
②计算:ClO2溶液的物质的量浓度为
您最近一年使用:0次



