解题方法
1 . “84”消毒液是一种常见的含氯消毒剂。
(1)“84”消毒液的有效成分为_______ (用化学式表示)。
(2)常温下,将氯气通入NaOH溶液中可制得“84”消毒液。写出反应的离子方程式:_______ 。
(3)针对不同物品消毒,“84”消毒液需要稀释到不同浓度使用。取含次氯酸钠0.2mol·L-1的“84”消毒液1mL,加水稀释至100mL,稀释后的溶液中次氯酸钠的物质的量浓度为_______  。
。
(1)“84”消毒液的有效成分为
(2)常温下,将氯气通入NaOH溶液中可制得“84”消毒液。写出反应的离子方程式:
(3)针对不同物品消毒,“84”消毒液需要稀释到不同浓度使用。取含次氯酸钠0.2mol·L-1的“84”消毒液1mL,加水稀释至100mL,稀释后的溶液中次氯酸钠的物质的量浓度为
 。
。
您最近一年使用:0次
名校
解题方法
2 . 利用如图所示的“价-类”二维图,可以从物质类别、化合价角度认识含氯元素的物质的性质及其转化关系,图中甲~辛均为含氯元素的物质。回答下列问题:
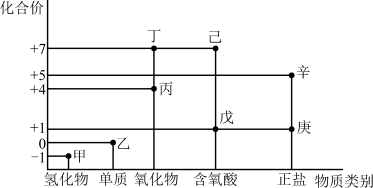
(1)戊的化学式为_______ 。
(2)甲、乙、丙中,属于非电解质的是_______ (填化学式)。根据氯元素的化合价判断乙_______ (填序号)。
a.只有氧化性 b.只有还原性 c.既有氧化性又有还原性
(3)庚是“84”消毒液的有效成分,能有效灭菌,某化学社团模拟生产厂家配制了 “84消毒液”,并在瓶体贴上标签,如图所示,回答下列问题:
“84消毒液”,并在瓶体贴上标签,如图所示,回答下列问题:
①写出氯气和 溶液生产此消毒液的离子方程式
溶液生产此消毒液的离子方程式_______ 。该“84消毒液”有效成分的物质的量浓度为_______ 。
②“84消毒液”与稀硫酸混合使用可增强消毒能力,该社团成员用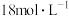 的浓硫酸配制
的浓硫酸配制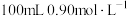 的稀硫酸用于增强“84消毒液”的消毒能力。若所配制的稀硫酸浓度偏高,则可能的原因是
的稀硫酸用于增强“84消毒液”的消毒能力。若所配制的稀硫酸浓度偏高,则可能的原因是_______ 。
A.配制前,容量瓶中有少量蒸馏水
B.量取浓硫酸时,仰视液体的凹液面
C.未冷却,立即转移至容量瓶定容
D.未洗涤烧杯和玻璃棒

(1)戊的化学式为
(2)甲、乙、丙中,属于非电解质的是
a.只有氧化性 b.只有还原性 c.既有氧化性又有还原性
(3)庚是“84”消毒液的有效成分,能有效灭菌,某化学社团模拟生产厂家配制了
 “84消毒液”,并在瓶体贴上标签,如图所示,回答下列问题:
“84消毒液”,并在瓶体贴上标签,如图所示,回答下列问题:| 84消毒液 |
(有效成分) (规格)  (质量分数) 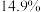 (密度)  |
 溶液生产此消毒液的离子方程式
溶液生产此消毒液的离子方程式②“84消毒液”与稀硫酸混合使用可增强消毒能力,该社团成员用
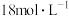 的浓硫酸配制
的浓硫酸配制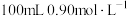 的稀硫酸用于增强“84消毒液”的消毒能力。若所配制的稀硫酸浓度偏高,则可能的原因是
的稀硫酸用于增强“84消毒液”的消毒能力。若所配制的稀硫酸浓度偏高,则可能的原因是A.配制前,容量瓶中有少量蒸馏水
B.量取浓硫酸时,仰视液体的凹液面
C.未冷却,立即转移至容量瓶定容
D.未洗涤烧杯和玻璃棒
您最近一年使用:0次
2022-02-28更新
|
361次组卷
|
2卷引用:重庆第二外国语学校2021-2022学年高一上学期期末考试化学试题
解题方法
3 . 物质类别和核心元素的价态是学习元素及其化合物性质的两个重要认识视角。下图为氯元素的单质及其化合物的“价~类”二维图。请回答下列问题:

(1)二维图中X的化学式(分子式)为_______ 。
(2)“84”消毒液(有效成分为NaClO)进行环境消毒时,会与空气中的CO2发生反应生成NaHCO3与次氯酸。写出该反应的离子方程式_______ 。
(3)舍勒是最早制取Cl2的化学家,请你写出舍勒制取Cl2的离子方程式_______ ,实验室对Cl2进行尾气处理的离子方程式为_______ 。
(4)二氧化氯(ClO2)是一种新型自来水消毒剂。工业上一种制备ClO2的反应原理为2NaClO3+H2O2+H2SO4=2ClO2↑+Na2SO4+O2↑+2H2O,该反应中H2O2作_______ (填“氧化剂”或“还原剂”)。

(1)二维图中X的化学式(分子式)为
(2)“84”消毒液(有效成分为NaClO)进行环境消毒时,会与空气中的CO2发生反应生成NaHCO3与次氯酸。写出该反应的离子方程式
(3)舍勒是最早制取Cl2的化学家,请你写出舍勒制取Cl2的离子方程式
(4)二氧化氯(ClO2)是一种新型自来水消毒剂。工业上一种制备ClO2的反应原理为2NaClO3+H2O2+H2SO4=2ClO2↑+Na2SO4+O2↑+2H2O,该反应中H2O2作
您最近一年使用:0次
4 . 按要求回答下列问题:
(1)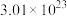 个
个 分子的质量为
分子的质量为_______ g。
(2)常温下可用铁槽车运输浓硫酸,原因是_______ 。
(3)氯气可用于制备“战略金属”钛,有关反应为: ,请用双线桥标出该反应中电子转移的方向和数目
,请用双线桥标出该反应中电子转移的方向和数目_______ 。
(4)氯气发生泄漏时,人员应_______ (填字母);同时喷 溶液进行吸收,发生反应的化学方程式为
溶液进行吸收,发生反应的化学方程式为_______ 。
a.顺风向高处转移 b.顺风向低处转移 c.逆风向高处转移 d.逆风向低处转移
(5)盛放 溶液的玻璃试剂瓶应选用
溶液的玻璃试剂瓶应选用_______ (填“玻璃”或“橡胶”)塞。
(1)
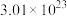 个
个 分子的质量为
分子的质量为(2)常温下可用铁槽车运输浓硫酸,原因是
(3)氯气可用于制备“战略金属”钛,有关反应为:
 ,请用双线桥标出该反应中电子转移的方向和数目
,请用双线桥标出该反应中电子转移的方向和数目(4)氯气发生泄漏时,人员应
 溶液进行吸收,发生反应的化学方程式为
溶液进行吸收,发生反应的化学方程式为a.顺风向高处转移 b.顺风向低处转移 c.逆风向高处转移 d.逆风向低处转移
(5)盛放
 溶液的玻璃试剂瓶应选用
溶液的玻璃试剂瓶应选用
您最近一年使用:0次
5 . 完成下列填空:
(1)+2价的亚铁离子是血红蛋白(用于运输氧气)的重要组成成分。工业上常用Cl2处理含Fe2+的FeCl3溶液,请写出该反应的离子方程式:_______ 。
(2)2020年突如其来的“新冠肺炎”使人们认识到含氯消毒剂的重要性。
①“84”消毒液(有效成分为次氯酸钠)在此次抗疫中发挥了重要作用,其工业制备的化学方程式_______ 。
②已知KMnO4与浓盐酸反应也可以用来制取氯气:2KMnO4+16HCl=2KCl+ 2MnCl2+ 5Cl2↑+ 8H2O。氧化剂是_______ (填化学式);若有15.8g KMnO4参与反应,反应中转移的电子为_______ mol。请用单线桥法表示电子转移的方向和数目:_______ 。
(3)某实验小组用“套管实验”来探究Na2CO3和NaHCO3的性质。
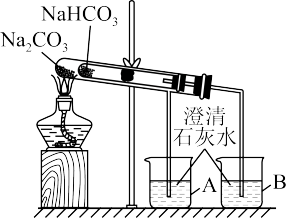
①整个实验过程中,能观察到烧杯B中的现象是_______ 。
②该实验可证明NaHCO3的热稳定性_______ (填“强于”“弱于”或“等于”)Na2CO3;_______ (填“能”或“不能”)将NaHCO3、Na2CO3的位置互换。
(1)+2价的亚铁离子是血红蛋白(用于运输氧气)的重要组成成分。工业上常用Cl2处理含Fe2+的FeCl3溶液,请写出该反应的离子方程式:
(2)2020年突如其来的“新冠肺炎”使人们认识到含氯消毒剂的重要性。
①“84”消毒液(有效成分为次氯酸钠)在此次抗疫中发挥了重要作用,其工业制备的化学方程式
②已知KMnO4与浓盐酸反应也可以用来制取氯气:2KMnO4+16HCl=2KCl+ 2MnCl2+ 5Cl2↑+ 8H2O。氧化剂是
(3)某实验小组用“套管实验”来探究Na2CO3和NaHCO3的性质。

①整个实验过程中,能观察到烧杯B中的现象是
②该实验可证明NaHCO3的热稳定性
您最近一年使用:0次
6 . 从物质类别和元素化合价两个维度研究物质的性质及转化是重要的化学学习方法。氯及其化合物有重要用途,下图为氯元素的“价类二维图”的部分信息。请回答下列问题:
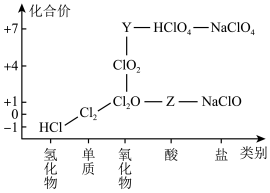
(1)根据图中信息写出Y、Z的化学式_______ 、_______ 。
(2)84消毒液能有效杀灭新冠病毒。某品牌84消毒液瓶体的部分标签如图所示。
回答下列问题:
①某使用说明中特别提醒84消毒液不可与洁厕灵(主要成分盐酸)混合使用,否则会产生 ,请用离子方程式表示其原因
,请用离子方程式表示其原因_______ 。
②如图所示,该品牌84消毒液的物质的量浓度为_______ ,84消毒液使用时需要稀释,某化学实验小组用上述84消毒液配制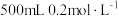 的稀溶液,需要用量筒量取该84消毒液
的稀溶液,需要用量筒量取该84消毒液_______  。
。
③配制过程中,下列操作会造成新配制的稀溶液浓度偏低的是_______ 。
A.量取浓84消毒液的量筒用蒸馏水洗涤2~3次,并把洗涤液转入容量瓶
B.容量瓶使用时未干燥
C.定容后经振荡、摇匀、静置,发现液面低于刻度线,再加蒸馏水补至刻度线
D.定容时俯视刻度线
(3)①二氧化氯是一种高效消毒剂。实验室可用亚氯酸钠( )溶液与氯气反应制
)溶液与氯气反应制 ,同时生成氯化钠,此反应的化学方程式为
,同时生成氯化钠,此反应的化学方程式为_______ 。
② 可将废水中的
可将废水中的 转化为
转化为 而除去,本身被还原为
而除去,本身被还原为 ,该反应过程中氧化剂与还原剂的物质的量之比为
,该反应过程中氧化剂与还原剂的物质的量之比为_______ 。

(1)根据图中信息写出Y、Z的化学式
(2)84消毒液能有效杀灭新冠病毒。某品牌84消毒液瓶体的部分标签如图所示。
| 84消毒液 有效成分  规格 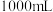 质量分数 25% 密度 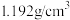 |
①某使用说明中特别提醒84消毒液不可与洁厕灵(主要成分盐酸)混合使用,否则会产生
 ,请用离子方程式表示其原因
,请用离子方程式表示其原因②如图所示,该品牌84消毒液的物质的量浓度为
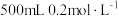 的稀溶液,需要用量筒量取该84消毒液
的稀溶液,需要用量筒量取该84消毒液 。
。③配制过程中,下列操作会造成新配制的稀溶液浓度偏低的是
A.量取浓84消毒液的量筒用蒸馏水洗涤2~3次,并把洗涤液转入容量瓶
B.容量瓶使用时未干燥
C.定容后经振荡、摇匀、静置,发现液面低于刻度线,再加蒸馏水补至刻度线
D.定容时俯视刻度线
(3)①二氧化氯是一种高效消毒剂。实验室可用亚氯酸钠(
 )溶液与氯气反应制
)溶液与氯气反应制 ,同时生成氯化钠,此反应的化学方程式为
,同时生成氯化钠,此反应的化学方程式为②
 可将废水中的
可将废水中的 转化为
转化为 而除去,本身被还原为
而除去,本身被还原为 ,该反应过程中氧化剂与还原剂的物质的量之比为
,该反应过程中氧化剂与还原剂的物质的量之比为
您最近一年使用:0次
7 . NaCl是一种化工原料,可以制备多种物质,如图所示:
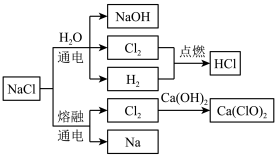
请根据以上转化关系填写下列空白。
(1)实验室用浓盐酸和MnO2制取氯气,其反应的化学方程式为___________ 。该反应中盐酸表现的性质有___________ 。
(2)饱NaCl溶液通电后发生反应的离子方程式为___________ 。电解饱和NaCl溶液的装置如图所示,在装置中间添加阳离子交换膜(只允许阳离子通过,不允许气体和阴离子通过),其作用是___________ 。
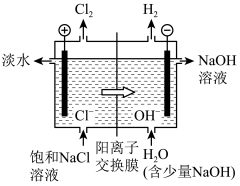
(3)将氯气溶于水配成饱和溶液,用胶头滴管将饱和氯水慢慢滴入含有酚酞的氢氧化钠稀溶液中,当滴到一定量时,红色突然褪去。产生上述现象的原因可能有两种:①氢氧化钠完全反应,反应后溶液碱性减弱,酚酞变无色;②过量饱和氯水中的次氯酸利用漂白性使溶液红色褪去。设计实验证明红色褪去的原因是①或②,简述实验方案和结论:___________ 。

请根据以上转化关系填写下列空白。
(1)实验室用浓盐酸和MnO2制取氯气,其反应的化学方程式为
(2)饱NaCl溶液通电后发生反应的离子方程式为

(3)将氯气溶于水配成饱和溶液,用胶头滴管将饱和氯水慢慢滴入含有酚酞的氢氧化钠稀溶液中,当滴到一定量时,红色突然褪去。产生上述现象的原因可能有两种:①氢氧化钠完全反应,反应后溶液碱性减弱,酚酞变无色;②过量饱和氯水中的次氯酸利用漂白性使溶液红色褪去。设计实验证明红色褪去的原因是①或②,简述实验方案和结论:
您最近一年使用:0次
解题方法
8 . 氮、氧、硫、氯是四种重要的非金属元素,研究它们的性质及用途对生产,生活、科研具有重要意义。
(1)一氯胺(NH2Cl)是一种长效缓释水消毒剂,工业上可利用反应NHI3(g)+Cl2(g)=NH2Cl(g)+HCl(g)制备。
①一氯胺(NH2Cl)在中性或酸性环境中会发生水解反应,生成一种具有强烈杀菌作用的物质,该物质的电子式为___________ 。
②氨气也是工业上制备硝酸的主要原料,制备硝酸的过程中涉及NO2与水的反应。该反应中氧化剂与还原剂的物质的量之比为___________ 。
(2)SO2、NO2两种气体都能对大气造成污染,需要对其进行吸收处理。用氨水吸收SO2能得到含 (NH4)2SO3和NH4HSO3的吸收液,写出生成(NH4)2SO3的离子方程式:___________ 。若向吸收液中通入过量NO2,NH4HSO3能与NO2发生反应生成N2和(NH4)2SO4,写出该反应的离子方程式:___________ 。
(3)Cl2与NaOH溶液反应可制取“84”消毒液。用过量的冷NaOH溶液吸收氯气,制得NaClO溶液(不含NaClO3,),此时ClO-的浓度为c0 mol/L;加热时NaClO能转化为NaClO3,测得t时刻溶液中ClO-的浓度为c1 mol/L (不考虑加热前后溶液体积的变化)。
①写出溶液中NaClO分解生成NaClO3的化学方程式:___________ 。
②t时刻溶液中c(Cl-)=___________ mol/L(用含c0、c1的代数式表示)。
(1)一氯胺(NH2Cl)是一种长效缓释水消毒剂,工业上可利用反应NHI3(g)+Cl2(g)=NH2Cl(g)+HCl(g)制备。
①一氯胺(NH2Cl)在中性或酸性环境中会发生水解反应,生成一种具有强烈杀菌作用的物质,该物质的电子式为
②氨气也是工业上制备硝酸的主要原料,制备硝酸的过程中涉及NO2与水的反应。该反应中氧化剂与还原剂的物质的量之比为
(2)SO2、NO2两种气体都能对大气造成污染,需要对其进行吸收处理。用氨水吸收SO2能得到含 (NH4)2SO3和NH4HSO3的吸收液,写出生成(NH4)2SO3的离子方程式:
(3)Cl2与NaOH溶液反应可制取“84”消毒液。用过量的冷NaOH溶液吸收氯气,制得NaClO溶液(不含NaClO3,),此时ClO-的浓度为c0 mol/L;加热时NaClO能转化为NaClO3,测得t时刻溶液中ClO-的浓度为c1 mol/L (不考虑加热前后溶液体积的变化)。
①写出溶液中NaClO分解生成NaClO3的化学方程式:
②t时刻溶液中c(Cl-)=
您最近一年使用:0次
9 . 实验室用二氧化锰和浓盐酸反应制取氯气并探究其性质,实验装置如图所示
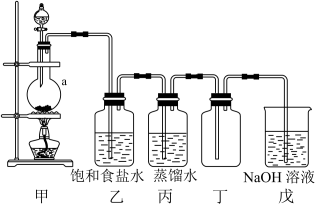
(1)仪器a的名称为___________ 。
(2)装置甲中发生反应的化学方程式为____ 。
(3)装置乙中饱和食盐水的作用是___________ 。
(4)装置丁中收集氯气的方法是___________ ,在装满氯气的集气瓶中放入红色鲜花,观察到鲜花褪色,原因是___________ 。
(5)装置戊中发生反应的离子方程式为___________ 。
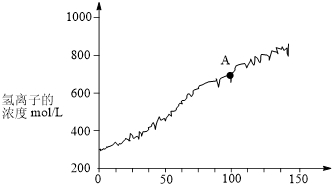
(6)充分反应后,将氯离子传感器插入广口瓶丙的溶液中,与数据采集器,计算机连接,用强光照射瓶中溶液,采集数据所得图象如图所示。
①A点溶液发生分解反应的离子方程式为___________ 。
②A点溶液中氯元素的存在形式有 和
和___________ 。


(1)仪器a的名称为
(2)装置甲中发生反应的化学方程式为
(3)装置乙中饱和食盐水的作用是
(4)装置丁中收集氯气的方法是
(5)装置戊中发生反应的离子方程式为
(6)充分反应后,将氯离子传感器插入广口瓶丙的溶液中,与数据采集器,计算机连接,用强光照射瓶中溶液,采集数据所得图象如图所示。
①A点溶液发生分解反应的离子方程式为
②A点溶液中氯元素的存在形式有
 和
和
您最近一年使用:0次
解题方法
10 . 将一定量 通入1kg质量分数为
通入1kg质量分数为 的
的 溶液中,制成含有
溶液中,制成含有 、
、 和
和 的混合溶液。用此溶液吸收标准状况下
的混合溶液。用此溶液吸收标准状况下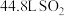 ,恰好形成中性溶液(假设气体均完全反应),请计算:
,恰好形成中性溶液(假设气体均完全反应),请计算:
(1)原 溶液中
溶液中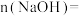
_______  。
。
(2)所通 在标准状况下的体积为
在标准状况下的体积为_______ L。
 通入1kg质量分数为
通入1kg质量分数为 的
的 溶液中,制成含有
溶液中,制成含有 、
、 和
和 的混合溶液。用此溶液吸收标准状况下
的混合溶液。用此溶液吸收标准状况下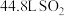 ,恰好形成中性溶液(假设气体均完全反应),请计算:
,恰好形成中性溶液(假设气体均完全反应),请计算:(1)原
 溶液中
溶液中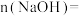
 。
。(2)所通
 在标准状况下的体积为
在标准状况下的体积为
您最近一年使用:0次



