名校
解题方法
1 . 实验室用如下方法测定 与
与 的混合物中
的混合物中 的质量分数。
的质量分数。
(1)称取该混合物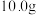 ,溶于水配成
,溶于水配成 溶液,下列操作会使所配溶液浓度偏小的有
溶液,下列操作会使所配溶液浓度偏小的有____ (填标号)。
A.未将洗涤液转移至容量瓶中
B.定容时俯视刻度线
C.定容振荡摇匀后液面低于刻度线,未做处理
(2)量取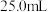 上述溶液于烧杯中,滴加足量
上述溶液于烧杯中,滴加足量 溶液,将
溶液,将 、
、 完全转化为沉淀,其中
完全转化为沉淀,其中 参与反应的离子方程式为
参与反应的离子方程式为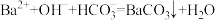 ,
, 属于
属于_______ (填“酸碱”或“盐”)。
(3)简述证明溶液中 、
、 已完全转化为沉淀的操作及现象:
已完全转化为沉淀的操作及现象:________ 。
 与
与 的混合物中
的混合物中 的质量分数。
的质量分数。(1)称取该混合物
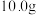 ,溶于水配成
,溶于水配成 溶液,下列操作会使所配溶液浓度偏小的有
溶液,下列操作会使所配溶液浓度偏小的有A.未将洗涤液转移至容量瓶中
B.定容时俯视刻度线
C.定容振荡摇匀后液面低于刻度线,未做处理
(2)量取
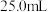 上述溶液于烧杯中,滴加足量
上述溶液于烧杯中,滴加足量 溶液,将
溶液,将 、
、 完全转化为沉淀,其中
完全转化为沉淀,其中 参与反应的离子方程式为
参与反应的离子方程式为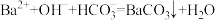 ,
, 属于
属于(3)简述证明溶液中
 、
、 已完全转化为沉淀的操作及现象:
已完全转化为沉淀的操作及现象:
您最近一年使用:0次
名校
2 . 有A、B两种常见化合物,其焰色试验均呈黄色,C是一种单质气体,相互转化关系如下图所示(部分生成物已略去)。回答下列问题:

(1)A的化学式为_______ ,用化学方程式表示A的用途_______ ,上述反应消耗2mol A时,制得气体的质量为_______ ,转移电子总数约为_______ 个。
(2)简述鉴别E与纯碱的一种方法_______ 。
(3)200℃在密闭装置中加热A、B固体混合物,两者恰好反应,只得到一种固体化合物G和其他气体产物。
①A与B的物质的量之比为_______ ,气体产物有_______ 。
②若只加入0.5mol某一纯净物就可将只含1mol B的溶液转变成只含1mol G的溶液,则该纯净物化学式为_______ 或_______ 。

(1)A的化学式为
(2)简述鉴别E与纯碱的一种方法
(3)200℃在密闭装置中加热A、B固体混合物,两者恰好反应,只得到一种固体化合物G和其他气体产物。
①A与B的物质的量之比为
②若只加入0.5mol某一纯净物就可将只含1mol B的溶液转变成只含1mol G的溶液,则该纯净物化学式为
您最近一年使用:0次
3 . 我国化学家侯德榜发明了联合制碱法,对世界制碱工业做出了巨大贡献。联合制碱法的主要工艺流程如下图所示(部分物质已略去)。

(1)向饱和食盐水中通入 和
和 的先后顺序是
的先后顺序是___________ ,反应①的离子方程式是___________ 。
(2)写出反应②的化学方程式___________ 。
(3)向溶液A中加入 粉末,存在
粉末,存在 过程。为使
过程。为使 沉淀充分析出并分离,根据
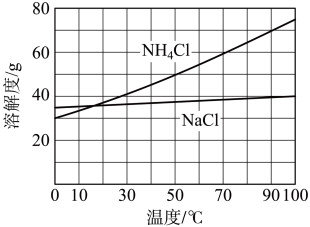
沉淀充分析出并分离,根据 和
和 溶解度曲线(下图),需采用的操作为
溶解度曲线(下图),需采用的操作为___________ 、___________ 、过滤、洗涤、干燥。
(4)此法制得纯碱中往往混有少量 ,同学们对工业纯碱样品展开探究。
,同学们对工业纯碱样品展开探究。
①为检验杂质的存在,请设计简单的实验检验方案是:___________ 。
②探究:测定纯碱样品中 的质量分数
的质量分数
【方案1】称取m g样品溶解,加入过量 溶液,搅拌至反应完全。过滤、洗涤、干燥,称量沉淀的质量为n g,则样品中
溶液,搅拌至反应完全。过滤、洗涤、干燥,称量沉淀的质量为n g,则样品中 的质量分数为
的质量分数为___________ 。
【方案2】如图所示,取样品于锥形瓶中,加入足量稀盐酸。反应结束后,根据干燥管增重计算 的质量分数。该实验设计是否合理?
的质量分数。该实验设计是否合理?___________ 。(填“是”“否”或“无法确定”)


(1)向饱和食盐水中通入
 和
和 的先后顺序是
的先后顺序是(2)写出反应②的化学方程式
(3)向溶液A中加入
 粉末,存在
粉末,存在 过程。为使
过程。为使 沉淀充分析出并分离,根据
沉淀充分析出并分离,根据 和
和 溶解度曲线(下图),需采用的操作为
溶解度曲线(下图),需采用的操作为
(4)此法制得纯碱中往往混有少量
 ,同学们对工业纯碱样品展开探究。
,同学们对工业纯碱样品展开探究。①为检验杂质的存在,请设计简单的实验检验方案是:
②探究:测定纯碱样品中
 的质量分数
的质量分数【方案1】称取m g样品溶解,加入过量
 溶液,搅拌至反应完全。过滤、洗涤、干燥,称量沉淀的质量为n g,则样品中
溶液,搅拌至反应完全。过滤、洗涤、干燥,称量沉淀的质量为n g,则样品中 的质量分数为
的质量分数为【方案2】如图所示,取样品于锥形瓶中,加入足量稀盐酸。反应结束后,根据干燥管增重计算
 的质量分数。该实验设计是否合理?
的质量分数。该实验设计是否合理?
您最近一年使用:0次
4 . 建构数学模型来研究化学问题,既直观又简洁。下列建构的数轴模型正确的是
A.钠在氧气中燃烧,钠的氧化产物: |
B.向烧碱溶液通入 |
C.分散系的分类: |
D.FeBr2溶液中通入Cl2,铁元素存在形式(已知还原性:Fe2+>Br-):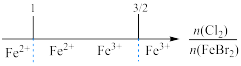 |
您最近一年使用:0次
2023-11-08更新
|
173次组卷
|
2卷引用:宁夏石嘴山市平罗中学2023-2024学年高三上学期第三次月考化学试题
解题方法
5 . 以NaCl为原料,可制取Na、Na2O2、NaOH和Na2CO3等。Na2CO3可用侯氏制碱法制取,主要涉及如下反应:
(1)N2(g)+3H2(g) 2NH3(g) ΔH=-92.4kJ•mol-1
2NH3(g) ΔH=-92.4kJ•mol-1
(2)NaCl+NH3+CO2+H2O=NaHCO3↓+NH4Cl
(3)2NaHCO3 Na2CO3+CO2↑+H2O
Na2CO3+CO2↑+H2O
下列有关比较正确的是
(1)N2(g)+3H2(g)
 2NH3(g) ΔH=-92.4kJ•mol-1
2NH3(g) ΔH=-92.4kJ•mol-1(2)NaCl+NH3+CO2+H2O=NaHCO3↓+NH4Cl
(3)2NaHCO3
 Na2CO3+CO2↑+H2O
Na2CO3+CO2↑+H2O下列有关比较正确的是
| A.键能(E):6E(N−H)>E(N≡N)+3E(H−H) | B.热稳定性:NaHCO3>Na2CO3 |
| C.同浓度溶液的pH:NaHCO3>Na2CO3 | D.沸点:NH3>H2O |
您最近一年使用:0次
名校
解题方法
6 . 现有NaHCO3和Na2CO3的混合物,为了测定二者的质量,某同学采用如图所示的装置进行实验(CaCl2、碱石灰均足量 )。
已知:CaCl2是一种优良的吸水剂,不与CO2反应;碱石灰是NaOH固体和CaO固体的混合物,碱石灰既可以吸水又可以与CO2反应。
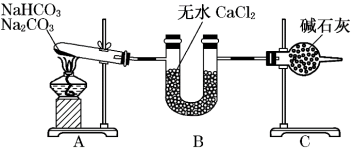
(1)B装置的作用是____ 。
(2)C装置的作用是____ 。
(3)若在装置A的试管中装入NaHCO3和Na2CO3的混合物3.80g,用酒精灯加热到反应完全,此时U型管B增重0.18g,干燥管C增重mg,则原固体混合物中Na2CO3的质量为____ g。
(4)A装置中发生反应的化学方程式为:____ 。
(5)请通过计算,判断m的取值范围____ 。
已知:CaCl2是一种优良的吸水剂,不与CO2反应;碱石灰是NaOH固体和CaO固体的混合物,碱石灰既可以吸水又可以与CO2反应。

(1)B装置的作用是
(2)C装置的作用是
(3)若在装置A的试管中装入NaHCO3和Na2CO3的混合物3.80g,用酒精灯加热到反应完全,此时U型管B增重0.18g,干燥管C增重mg,则原固体混合物中Na2CO3的质量为
(4)A装置中发生反应的化学方程式为:
(5)请通过计算,判断m的取值范围
您最近一年使用:0次
名校
解题方法
7 . W、X、Y、Z都是中学化学中常见物质,其中W、X、Y中均含有同一种元素,在一定条件下的相互转化关系如图所示(部分反应中的水已略去)。
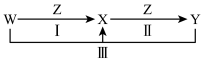
根据题意回答下列问题:
(1)若W、X、Y的焰色试验均为黄色,且W为强碱,Z为绿色植物光合作用不可或缺的原料。
①焰色试验为黄色,说明物质组成中含有___________ (填元素符号)。
②W、X、Y、Z中是电解质的为_______ (填化学式);除去X固体中混有的Y固体的方法为_______ (填除杂方法的名称);若向X的饱和溶液中通入足量的Z,则可观察到的现象为_______ 。
③反应Ⅲ的离子方程式为___________ 。
(2)若W为气体单质,Z为一种黑色金属单质。
①反应II的离子方程式为___________ 。
②一定条件下,Z能与水发生反应,该反应的化学方程式为___________ 。

根据题意回答下列问题:
(1)若W、X、Y的焰色试验均为黄色,且W为强碱,Z为绿色植物光合作用不可或缺的原料。
①焰色试验为黄色,说明物质组成中含有
②W、X、Y、Z中是电解质的为
③反应Ⅲ的离子方程式为
(2)若W为气体单质,Z为一种黑色金属单质。
①反应II的离子方程式为
②一定条件下,Z能与水发生反应,该反应的化学方程式为
您最近一年使用:0次
2022-01-26更新
|
226次组卷
|
2卷引用:河南省信阳高级中学2021-2022学年高一下学期第一次月考化学试题
8 . 某同学在两个相同的特制容器中分别加入20mL0.4mol·L-1Na2CO3溶液和40mL0.2mol·L-1NaHCO3溶液,再分别用0.4mol·L-1盐酸滴定,利用pH计和压力传感器检测,得到如图曲线:
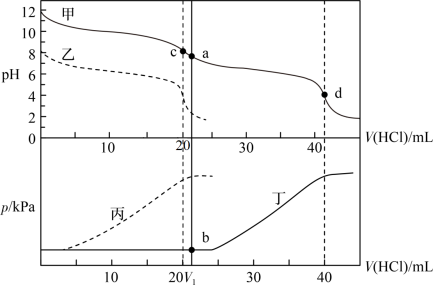
下列说法正确的的是

下列说法正确的的是
| A.图中甲、丁线表示向NaHCO3溶液中滴加盐酸,乙、丙线表示向Na2CO3溶液中滴加盐酸 |
B.当滴加盐酸的体积为V1mL时(a点、b点),所发生的反应用离子方程式表示为:HCO +H+=CO2↑+H2O +H+=CO2↑+H2O |
| C.根据pH—V(HCl)图,滴定分析时,c点可用酚酞、d点可用甲基橙作指示剂指示滴定终点 |
D.Na2CO3和NaHCO3溶液中均满足:c(H2CO3)-c(CO )=c(OH-)-c(H+) )=c(OH-)-c(H+) |
您最近一年使用:0次
2022-01-12更新
|
9170次组卷
|
24卷引用:天津市第一中学2021-2022学年高三下学期4月月考化学试题
天津市第一中学2021-2022学年高三下学期4月月考化学试题上海市七宝中学2022-2023学年高三上学期9月月考化学试题2022 年1月浙江省普通高校招生选考科目考试化学试题(已下线)卷09 水溶液中的离子平衡-【小题小卷】冲刺2022年高考化学小题限时集训(新高考专用)(已下线)回归教材重难点07 图像数据和结果的分析-【查漏补缺】2022年高考化学三轮冲刺过关(新高考专用)(已下线)2022年浙江1月高考真题变式题(21-25)(已下线)考点28 盐类的水解-备战2023年高考化学一轮复习考点帮(全国通用)(已下线)第32练 盐类的水解-2023年高考化学一轮复习小题多维练(全国通用)(已下线)第25讲 盐类水解(练)-2023年高考化学一轮复习讲练测(全国通用)湖南省怀化市沅陵县第一中学2022届高三下学期第四次模拟考试化学试题(已下线)第22讲 水的电离与溶液的pH(讲)-2023年高考化学一轮复习讲练测(新教材新高考)(已下线)微专题41 水溶液中的三大守恒和浓度大小比较-备战2023年高考化学一轮复习考点微专题(已下线)专题06 水溶液中的离子平衡(讲)-2023年高考化学二轮复习讲练测(新高考专用)湖南省株洲南方中学2022-2023学年高二上学期期中考试化学试题(已下线)题型133 酸碱中和滴定实验及误差分析(已下线)专题16 水溶液中的离子平衡(已下线)专题16 水溶液中的离子平衡(已下线)第15练 水溶液中的离子平衡图像分析 -2023年【暑假分层作业】高二化学(2024届一轮复习通用)(已下线)专题09 水溶液中的离子平衡-2023年高考化学真题题源解密(新高考专用)章末检测卷(三) 水溶液中的离子反应与平衡(已下线)考点28 盐类的水解(核心考点精讲精练)-备战2024年高考化学一轮复习考点帮(全国通用)第三章 水溶液中的离子反应与平衡 第二节 水的电离和溶液的pH 第2课时 酸碱中和滴定(已下线)考点2 水的电离与溶液的pH (核心考点精讲精练)-备战2024年高考化学一轮复习考点帮(新高考专用)(已下线)考点3 盐类水解(核心考点精讲精练)-备战2024年高考化学一轮复习考点帮(新高考专用)
9 . 向100 mL NaOH溶液中通入一定量的CO2气体,充分反应后,再向所得溶液中逐滴加入0.2 mol·L-1的盐酸,产生CO2的体积与所加盐酸体积之间关系如图所示:

(1)原NaOH溶液的浓度为_______
(2)通入CO2在标准状况下的体积为_______ mL
(3)所得溶液的溶质成分及物质的量之比为_______
(4)在配制盐酸溶液时,将标况下VLHCl气体溶于100mL水中,所得溶液密度为d g·cm-3,则此溶液的物质的量浓度为_______ mol·L-1

(1)原NaOH溶液的浓度为
(2)通入CO2在标准状况下的体积为
(3)所得溶液的溶质成分及物质的量之比为
(4)在配制盐酸溶液时,将标况下VLHCl气体溶于100mL水中,所得溶液密度为d g·cm-3,则此溶液的物质的量浓度为
您最近一年使用:0次
2021-10-26更新
|
255次组卷
|
2卷引用:天津市静海区第一中学2021-2022学年高三上学期(9月)学生学业能力调研化学试题
名校
解题方法
10 . 某萃铜余液主要含有 、
、 、
、 、
、 ,
, 等离子,从萃铜余液中回收金属和制备
等离子,从萃铜余液中回收金属和制备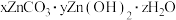 的工艺流程如图甲所示。
的工艺流程如图甲所示。

回答下列问题:
(1)过硫酸钠( )中
)中 的化合价为
的化合价为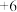 ,
,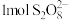 中过氧键的数目为
中过氧键的数目为___________ 。向 的萃铜余液中加入
的萃铜余液中加入 。进行“氧化除锰”,其反应的离子方程式为
。进行“氧化除锰”,其反应的离子方程式为___________ 。“氧化除锰”过程中,
___________ (填“能”或“不能”)用绿色氧化剂 来代替。
来代替。
(2)向“氧化除锰”后的余液中加入试剂 调节
调节 使铁元素完全沉淀,试剂
使铁元素完全沉淀,试剂 的化学式为
的化学式为___________ 。
(3)“沉锌”时,应保持溶液 在6.8~7.0之间,
在6.8~7.0之间, 不能过低的原因是
不能过低的原因是___________ 。
(4)“过滤”时,经常采用抽滤的方式加快过滤的速度。实验室用如图乙所示的装置,经过一系列操作完成抽滤和洗涤。请选择合适的编号,按正确的操作顺序补充完整(洗涤操作只需考虑一次):开抽气泵→a→b→d→___________ →___________ →___________ →___________ →c→关抽气泵。
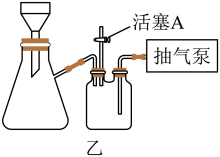
a.转移固液混合物 b.关活塞A c.开活塞A d.确认抽干 e.加洗涤剂洗涤
(5)高温煅烧碱式碳酸锌[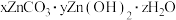 ]得到
]得到 ,取碱式碳酸锌
,取碱式碳酸锌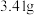 ,在高温下煅烧至恒重,得到固体
,在高温下煅烧至恒重,得到固体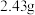 和标准状况下
和标准状况下 ,则该碱式碳酸锌的化学式为
,则该碱式碳酸锌的化学式为___________ 。
 、
、 、
、 、
、 ,
, 等离子,从萃铜余液中回收金属和制备
等离子,从萃铜余液中回收金属和制备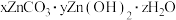 的工艺流程如图甲所示。
的工艺流程如图甲所示。
回答下列问题:
(1)过硫酸钠(
 )中
)中 的化合价为
的化合价为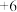 ,
,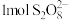 中过氧键的数目为
中过氧键的数目为 的萃铜余液中加入
的萃铜余液中加入 。进行“氧化除锰”,其反应的离子方程式为
。进行“氧化除锰”,其反应的离子方程式为
 来代替。
来代替。(2)向“氧化除锰”后的余液中加入试剂
 调节
调节 使铁元素完全沉淀,试剂
使铁元素完全沉淀,试剂 的化学式为
的化学式为(3)“沉锌”时,应保持溶液
 在6.8~7.0之间,
在6.8~7.0之间, 不能过低的原因是
不能过低的原因是(4)“过滤”时,经常采用抽滤的方式加快过滤的速度。实验室用如图乙所示的装置,经过一系列操作完成抽滤和洗涤。请选择合适的编号,按正确的操作顺序补充完整(洗涤操作只需考虑一次):开抽气泵→a→b→d→

a.转移固液混合物 b.关活塞A c.开活塞A d.确认抽干 e.加洗涤剂洗涤
(5)高温煅烧碱式碳酸锌[
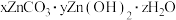 ]得到
]得到 ,取碱式碳酸锌
,取碱式碳酸锌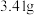 ,在高温下煅烧至恒重,得到固体
,在高温下煅烧至恒重,得到固体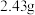 和标准状况下
和标准状况下 ,则该碱式碳酸锌的化学式为
,则该碱式碳酸锌的化学式为
您最近一年使用:0次
2021-09-09更新
|
1567次组卷
|
9卷引用:广东省珠海市第二中学2022届高三十月月考化学试题
广东省珠海市第二中学2022届高三十月月考化学试题山东省潍坊市第一中学2022届高三10月月考化学试题全国2022届高三上学期第一次学业质量联合检测化学试题陕西省西安市长安区第一中学2022届高三第一次模拟考试化学试题(已下线)备战2022年高考化学精准检测卷【全国卷】07(已下线)第19周 晚练题-备战2022年高考化学周测与晚练(新高考专用)(已下线)押新高考卷14题 工艺流程综合题-备战2022年高考化学临考题号押题(新高考通版)湖南省吉首市泸溪一中2022届高三第三次联合检测化学试题(已下线)2019年高考浙江卷化学试题变式题(实验题)



