名校
解题方法
1 . 某小组为探究 (三草酸合铁酸钾晶体)的热分解产物,按如图所示装置进行实验(部分夹持装置省略)。
(三草酸合铁酸钾晶体)的热分解产物,按如图所示装置进行实验(部分夹持装置省略)。

(1)在实验进行的过程中,应该持续通入氮气的目的是___________ 。
(2)若实验中观察装置F中澄清石灰水变浑浊,装置E中固体变为红色,则说明 的热分解产物中一定含有
的热分解产物中一定含有___________ 。
(3)该样品完全热分解后,欲检测固体生成物中的组成,某同学待装置冷却后取少量固体加入稀硫酸溶解,再加入 溶液变红,说明
溶液变红,说明___________ 。
(4)已知: 是一种光敏化合物,见光分解。该实验小组在探究
是一种光敏化合物,见光分解。该实验小组在探究 热分解后,用该装置再次探究它光解的产物,现取
热分解后,用该装置再次探究它光解的产物,现取 固体20.00g,使充分反应后,称得B、C装置共增重1.76g,D装置增重2.16g,E、F装置均无明显现象。
固体20.00g,使充分反应后,称得B、C装置共增重1.76g,D装置增重2.16g,E、F装置均无明显现象。
完成下列小题:
①若反应后 元素的化合价降为
元素的化合价降为 价,K元素的化合价未改变,且两者仍为草酸
价,K元素的化合价未改变,且两者仍为草酸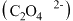 盐,写出三草酸合铁酸钾完全光解的化学方程式
盐,写出三草酸合铁酸钾完全光解的化学方程式___________ 。
②据此计算出该 固体的纯度为
固体的纯度为___________ (保留一位有效数字) 。
③样品完全分解后,实验小组停止通氮气,一段时间后,某同学取少许装置A中的残留物于试管中,加入稀硫酸溶解,滴入1~2滴 溶液,发现溶液变红,这与上述
溶液,发现溶液变红,这与上述 分解产物为
分解产物为 价
价 的结论不符可能的原因是
的结论不符可能的原因是___________ 。
 (三草酸合铁酸钾晶体)的热分解产物,按如图所示装置进行实验(部分夹持装置省略)。
(三草酸合铁酸钾晶体)的热分解产物,按如图所示装置进行实验(部分夹持装置省略)。
(1)在实验进行的过程中,应该持续通入氮气的目的是
(2)若实验中观察装置F中澄清石灰水变浑浊,装置E中固体变为红色,则说明
 的热分解产物中一定含有
的热分解产物中一定含有(3)该样品完全热分解后,欲检测固体生成物中的组成,某同学待装置冷却后取少量固体加入稀硫酸溶解,再加入
 溶液变红,说明
溶液变红,说明(4)已知:
 是一种光敏化合物,见光分解。该实验小组在探究
是一种光敏化合物,见光分解。该实验小组在探究 热分解后,用该装置再次探究它光解的产物,现取
热分解后,用该装置再次探究它光解的产物,现取 固体20.00g,使充分反应后,称得B、C装置共增重1.76g,D装置增重2.16g,E、F装置均无明显现象。
固体20.00g,使充分反应后,称得B、C装置共增重1.76g,D装置增重2.16g,E、F装置均无明显现象。完成下列小题:
①若反应后
 元素的化合价降为
元素的化合价降为 价,K元素的化合价未改变,且两者仍为草酸
价,K元素的化合价未改变,且两者仍为草酸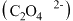 盐,写出三草酸合铁酸钾完全光解的化学方程式
盐,写出三草酸合铁酸钾完全光解的化学方程式②据此计算出该
 固体的纯度为
固体的纯度为③样品完全分解后,实验小组停止通氮气,一段时间后,某同学取少许装置A中的残留物于试管中,加入稀硫酸溶解,滴入1~2滴
 溶液,发现溶液变红,这与上述
溶液,发现溶液变红,这与上述 分解产物为
分解产物为 价
价 的结论不符可能的原因是
的结论不符可能的原因是
您最近一年使用:0次
名校
解题方法
2 . 硫代硫酸钠( )俗称大苏打,广泛用于定影、媒染等领域,临床上用于氰化物解毒。实验室中以
)俗称大苏打,广泛用于定影、媒染等领域,临床上用于氰化物解毒。实验室中以 和
和 为主要原料制备
为主要原料制备 。回答下列问题:
。回答下列问题:
(1) 能解毒氰化物的原理为
能解毒氰化物的原理为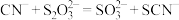 ,为检验该反应产生了
,为检验该反应产生了 ,最佳方法是取少量反应液,先向其中加入足量的盐酸,再加入
,最佳方法是取少量反应液,先向其中加入足量的盐酸,再加入___________ (填化学式),观察到的现象是___________ 。
(2)工业级硫化钠中混有杂质(重金属硫化物、煤粉等),需进行纯化。纯化实验装置如图,保持水浴沸腾,回流一段时间后,过滤,将滤液冷却至室温后析出高纯硫化钠。
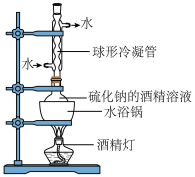
将工业硫化钠溶于酒精并加热时,采取水浴加热并且回流的原因是___________ 。
(3)利用下图装置制备 。
。
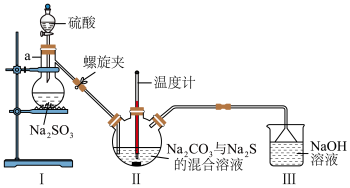
①仪器a的名称为___________ 。
②实验开始时,打开螺旋夹并适当调节螺旋夹,一方面可以防止倒吸,另一方面可以___________ 。
③装置Ⅱ处发生反应的总化学方程式为___________ ,停止通入 前要控制Ⅱ装置中溶液pH约为7而不能小于7的理由是
前要控制Ⅱ装置中溶液pH约为7而不能小于7的理由是___________ 。
④装置Ⅲ的作用是___________ 。
(4)实验结束后,经过一系列操作得到粗产品,测定粗产品中 (
(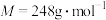 )的质量分数。精确称取0.5g硫代硫酸钠样品,用少量水溶解后滴入1~2滴淀粉溶液,再注入缓冲溶液。用
)的质量分数。精确称取0.5g硫代硫酸钠样品,用少量水溶解后滴入1~2滴淀粉溶液,再注入缓冲溶液。用 的
的 标准溶液滴定,待指示剂颜色变化稳定后停止滴定,测得消耗
标准溶液滴定,待指示剂颜色变化稳定后停止滴定,测得消耗 标准溶液的体积为
标准溶液的体积为 。(已知
。(已知 )
)
①滴定达到终点时的现象是___________ 。
②产品中 的质量分数为
的质量分数为___________ %。
 )俗称大苏打,广泛用于定影、媒染等领域,临床上用于氰化物解毒。实验室中以
)俗称大苏打,广泛用于定影、媒染等领域,临床上用于氰化物解毒。实验室中以 和
和 为主要原料制备
为主要原料制备 。回答下列问题:
。回答下列问题:(1)
 能解毒氰化物的原理为
能解毒氰化物的原理为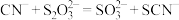 ,为检验该反应产生了
,为检验该反应产生了 ,最佳方法是取少量反应液,先向其中加入足量的盐酸,再加入
,最佳方法是取少量反应液,先向其中加入足量的盐酸,再加入(2)工业级硫化钠中混有杂质(重金属硫化物、煤粉等),需进行纯化。纯化实验装置如图,保持水浴沸腾,回流一段时间后,过滤,将滤液冷却至室温后析出高纯硫化钠。

将工业硫化钠溶于酒精并加热时,采取水浴加热并且回流的原因是
(3)利用下图装置制备
 。
。
①仪器a的名称为
②实验开始时,打开螺旋夹并适当调节螺旋夹,一方面可以防止倒吸,另一方面可以
③装置Ⅱ处发生反应的总化学方程式为
 前要控制Ⅱ装置中溶液pH约为7而不能小于7的理由是
前要控制Ⅱ装置中溶液pH约为7而不能小于7的理由是④装置Ⅲ的作用是
(4)实验结束后,经过一系列操作得到粗产品,测定粗产品中
 (
(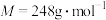 )的质量分数。精确称取0.5g硫代硫酸钠样品,用少量水溶解后滴入1~2滴淀粉溶液,再注入缓冲溶液。用
)的质量分数。精确称取0.5g硫代硫酸钠样品,用少量水溶解后滴入1~2滴淀粉溶液,再注入缓冲溶液。用 的
的 标准溶液滴定,待指示剂颜色变化稳定后停止滴定,测得消耗
标准溶液滴定,待指示剂颜色变化稳定后停止滴定,测得消耗 标准溶液的体积为
标准溶液的体积为 。(已知
。(已知 )
)①滴定达到终点时的现象是
②产品中
 的质量分数为
的质量分数为
您最近一年使用:0次
名校
解题方法
3 .  溶于一定量水中得a溶液,呈浅棕黄色;a溶液加入少量浓
溶于一定量水中得a溶液,呈浅棕黄色;a溶液加入少量浓 得溶液 b,溶液b较溶液 a黄色加深。已知:
得溶液 b,溶液b较溶液 a黄色加深。已知: (黄色);浓度较小时
(黄色);浓度较小时  (用
(用 表示)几乎无色。取溶液进行如下实验,对现象分析错误的是
表示)几乎无色。取溶液进行如下实验,对现象分析错误的是
 溶于一定量水中得a溶液,呈浅棕黄色;a溶液加入少量浓
溶于一定量水中得a溶液,呈浅棕黄色;a溶液加入少量浓 得溶液 b,溶液b较溶液 a黄色加深。已知:
得溶液 b,溶液b较溶液 a黄色加深。已知: (黄色);浓度较小时
(黄色);浓度较小时  (用
(用 表示)几乎无色。取溶液进行如下实验,对现象分析错误的是
表示)几乎无色。取溶液进行如下实验,对现象分析错误的是A.测溶液 a的  约为1.3,证明 约为1.3,证明  发生了水解 发生了水解 |
B.向 b中加入  后,会产生白色沉淀 后,会产生白色沉淀 |
C.向 b中滴入  溶液变血红色,说明 溶液变血红色,说明  的配位键稳定性大于 的配位键稳定性大于  |
D.将溶液 a稀释,颜色变浅,主要是因为  浓度降低导致 浓度降低导致 |
您最近一年使用:0次
2024-01-31更新
|
204次组卷
|
4卷引用:黑龙江省哈尔滨市第九中学校2023-2024学年高二上学期期末考试化学试卷
4 . 用富含铁元素的食品,可以补充人体所需的铁元素。某班级研究性学习小组对菠菜中的铁元素展开了检测,实验如下:

(1)下列图示装置或操作合理的是________ 。
(2)写出试剂B的化学式___________ 。
(3)试剂C若为双氧水,请写出该反应的离子方程式:___________ ;该实验证明菠菜中含有的铁元素为_____ 价。
(4)其中一名同学在研究过程中向滤液A中先加入氯水,再加入试剂B,也看到溶液变红,由此也得出和其他同学一样的结论。他的做法是否正确?______ ,原因是什么?___________ 。
(5)另取少量滤液 ,向其中加入少量NaOH溶液,观察到的现象是
,向其中加入少量NaOH溶液,观察到的现象是________ ;原因是___________ 、________ (用离子方程式解释)。

(1)下列图示装置或操作合理的是
 |  |  |  |
| A.灼烧 | B.溶解 | C.过滤 | D.检测菠菜液中的铁元素 |
(2)写出试剂B的化学式
(3)试剂C若为双氧水,请写出该反应的离子方程式:
(4)其中一名同学在研究过程中向滤液A中先加入氯水,再加入试剂B,也看到溶液变红,由此也得出和其他同学一样的结论。他的做法是否正确?
(5)另取少量滤液
 ,向其中加入少量NaOH溶液,观察到的现象是
,向其中加入少量NaOH溶液,观察到的现象是
您最近一年使用:0次
5 . 铟是一种稀有贵金属,广泛应用于航空航天、太阳能电池等高科技领域。从高铟灰渣(主要含PbO、SiO2、FeAsO4·2H2O、In2O3)中提取铟的工艺流程如下:

已知:FeS4O6为强电解质;P2O4为磷酸二异辛酯;Ksp[In(OH)3]=1.4×10-33。回答下列问题:
(1)FeAsO4·2H2O中铁元素化合价为+3价,As的化合价为___________ 。Fe3+的价层电子排布式___________ 。
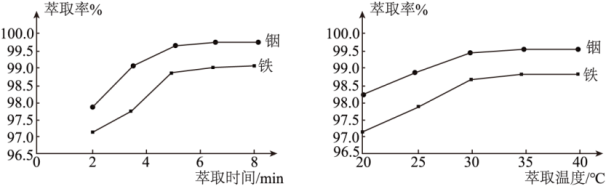
(2)“硫酸化焙烧”后金属元素均以硫酸盐的形式存在。在其他条件一定时,“水浸”铟、铁的萃取率结果如图所示,则萃取所采用的最佳条件为:萃取时间___________ ,萃取温度___________ 。
(3)“水浸”时,浸渣除了As2O3外,还含有___________ 。
(4)“还原铁”时反应的离子方程式为___________ 。
(5)“萃取除铁”时,用30%的P2O4作萃取剂时,发现当溶液pH >1.5后,铟萃取率随pH值的升高而下降,原因是___________ 。
(6)“萃取”过程中用酸(用H2A2表示)作萃取剂,使In3+进入有机相,发生反应:In3++3H2A2 In(HA2)3+3H+,平衡常数为K。已知c(H+)与萃取率(E%)的关系符合公式:
In(HA2)3+3H+,平衡常数为K。已知c(H+)与萃取率(E%)的关系符合公式: 。当pH = 2.30 时,萃取率为50%,若将萃取率提升到95%,应调节溶液的pH=
。当pH = 2.30 时,萃取率为50%,若将萃取率提升到95%,应调节溶液的pH=___________ (已知lg19 =1.28,忽略萃取剂浓度的变化,结果保留三位有效数字)。
(7)立方晶系CuInSe2的晶胞结构如图所示,晶胞参数如图。CuInSe2的相对分子质量为M,则该晶体密度ρ=___________ g·cm-3(用含M、NA的式子表示),与In原子最近且距离相等的Se原子个数为___________ 。
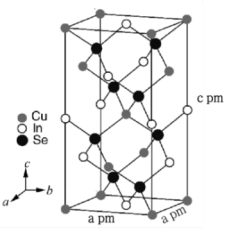

已知:FeS4O6为强电解质;P2O4为磷酸二异辛酯;Ksp[In(OH)3]=1.4×10-33。回答下列问题:
(1)FeAsO4·2H2O中铁元素化合价为+3价,As的化合价为
(2)“硫酸化焙烧”后金属元素均以硫酸盐的形式存在。在其他条件一定时,“水浸”铟、铁的萃取率结果如图所示,则萃取所采用的最佳条件为:萃取时间

(3)“水浸”时,浸渣除了As2O3外,还含有
(4)“还原铁”时反应的离子方程式为
(5)“萃取除铁”时,用30%的P2O4作萃取剂时,发现当溶液pH >1.5后,铟萃取率随pH值的升高而下降,原因是
(6)“萃取”过程中用酸(用H2A2表示)作萃取剂,使In3+进入有机相,发生反应:In3++3H2A2
 In(HA2)3+3H+,平衡常数为K。已知c(H+)与萃取率(E%)的关系符合公式:
In(HA2)3+3H+,平衡常数为K。已知c(H+)与萃取率(E%)的关系符合公式: 。当pH = 2.30 时,萃取率为50%,若将萃取率提升到95%,应调节溶液的pH=
。当pH = 2.30 时,萃取率为50%,若将萃取率提升到95%,应调节溶液的pH=(7)立方晶系CuInSe2的晶胞结构如图所示,晶胞参数如图。CuInSe2的相对分子质量为M,则该晶体密度ρ=

您最近一年使用:0次
2024-01-28更新
|
374次组卷
|
2卷引用:广东省梅县东山中学2023-2024学年高三上学期第四次段考(12月)化学试题
6 . 高铁酸钾(K2FeO4)具有极强的氧化性和优良的絮凝功能,是一种绿色环保多功能型水处理剂。下图是生产高铁酸钾的一种工艺流程:
回答下列问题:
(1)写出①中发生反应的离子方程式:___________ 。
(2)②中加入NaOH固体的目的是___________(填字母序号)。
(3)完成④中反应的离子方程式:___________ ,氧化剂与氧化产物的物质的量之比为___________ ;若反应每生成lmol 转移电子的数目为:
转移电子的数目为:___________ 。
(4)从溶液II中得到K2FeO4晶体的操作是___________ 、洗涤、千燥。
(5)⑥中洗涤时,洗涤剂最好选用___________(填字母序号)。

| 溶解性 | 溶于水,微溶于浓KOH溶液,难溶于有机物 |
| 稳定性 | 温度为0~5℃或强碱性溶液中能稳定存在;酸性或中性溶液中放出O2 |
(1)写出①中发生反应的离子方程式:
(2)②中加入NaOH固体的目的是___________(填字母序号)。
| A.为后续反应提供碱性环境 |
| B.加入NaOH固体做氧化剂有利于除去NaCl |
| C.NaOH固体溶解时会放出较多的热量,有利于后续生成K2FeO4 |
| D.与溶液I中过量的Cl2继续反应,生成更多的NaClO |
(3)完成④中反应的离子方程式:
 转移电子的数目为:
转移电子的数目为:(4)从溶液II中得到K2FeO4晶体的操作是
(5)⑥中洗涤时,洗涤剂最好选用___________(填字母序号)。
| A.KOH溶液 | B.乙醇 | C.H2O | D.FeCl2溶液 |
您最近一年使用:0次
解题方法
7 . 某化学兴趣小组探究 和
和 的化学性质。
的化学性质。
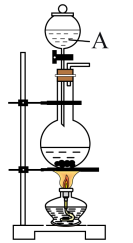
Ⅰ.实验准备:饱和氯水的制备
(1)图中仪器A的名称为___________ 。___________ 。
(3)实验室最适合用于处理多余氯气的是___________ (填字母)。
A. 溶液 B.
溶液 B. 溶液 C.
溶液 C. 溶液
溶液
Ⅱ.实验探究
①取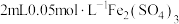 溶液于试管中,滴加3滴
溶液于试管中,滴加3滴 溶液,溶液变红色;
溶液,溶液变红色;
②取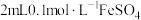 溶液于试管中,先滴加3滴
溶液于试管中,先滴加3滴 溶液,振荡,溶液无现象,再滴加3滴饱和氯水,溶液变黄色。
溶液,振荡,溶液无现象,再滴加3滴饱和氯水,溶液变黄色。
【发现问题】小组成员针对实验②中溶液未变红色,而呈现黄色的现象展开了探究。
【查阅文献】
i. 能将
能将 氧化成
氧化成 ,硫氰
,硫氰 常温下为黄色液体,易挥发,可与水发生反应:
常温下为黄色液体,易挥发,可与水发生反应: ;
;
ii.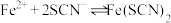 ,
,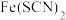 为无色配合物。
为无色配合物。
【提出猜想】猜想一 被氯水氧化成
被氯水氧化成 ,使溶液呈黄色;
,使溶液呈黄色;
猜想二 加入氯水后部分 被氧化为
被氧化为 ,
,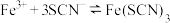 (红色),但由于存在反应:
(红色),但由于存在反应: ,实验②生成的
,实验②生成的 浓度比实验①的小,
浓度比实验①的小, 溶液在浓度较低时呈黄色。
溶液在浓度较低时呈黄色。
【验证猜想】
(4)为验证猜想,小组成员设计了以下实验,请补充表格中的操作及现象
【提出质疑】
(5)甲同学提出,实验④并不能证明猜想一正确,理由是___________ 。
【再次探究】
(6)小组成员进行进一步探究,请完成表格中的实验操作及现象
【得出结论】
(7)由实验结论可以判断:本实验条件下还原性强弱:
___________  (填“强于”“弱于”或“等于”)。
(填“强于”“弱于”或“等于”)。
 和
和 的化学性质。
的化学性质。Ⅰ.实验准备:饱和氯水的制备
(1)图中仪器A的名称为
(3)实验室最适合用于处理多余氯气的是
A.
 溶液 B.
溶液 B. 溶液 C.
溶液 C. 溶液
溶液Ⅱ.实验探究
①取
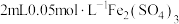 溶液于试管中,滴加3滴
溶液于试管中,滴加3滴 溶液,溶液变红色;
溶液,溶液变红色;②取
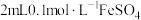 溶液于试管中,先滴加3滴
溶液于试管中,先滴加3滴 溶液,振荡,溶液无现象,再滴加3滴饱和氯水,溶液变黄色。
溶液,振荡,溶液无现象,再滴加3滴饱和氯水,溶液变黄色。【发现问题】小组成员针对实验②中溶液未变红色,而呈现黄色的现象展开了探究。
【查阅文献】
i.
 能将
能将 氧化成
氧化成 ,硫氰
,硫氰 常温下为黄色液体,易挥发,可与水发生反应:
常温下为黄色液体,易挥发,可与水发生反应: ;
;ii.
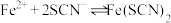 ,
,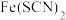 为无色配合物。
为无色配合物。【提出猜想】猜想一
 被氯水氧化成
被氯水氧化成 ,使溶液呈黄色;
,使溶液呈黄色;猜想二 加入氯水后部分
 被氧化为
被氧化为 ,
,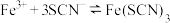 (红色),但由于存在反应:
(红色),但由于存在反应: ,实验②生成的
,实验②生成的 浓度比实验①的小,
浓度比实验①的小, 溶液在浓度较低时呈黄色。
溶液在浓度较低时呈黄色。【验证猜想】
(4)为验证猜想,小组成员设计了以下实验,请补充表格中的操作及现象
| 实验序号 | 实验操作 | 现象 | 实验结论 |
| ③ | 取少量实验①的溶液于试管中, | 猜想二正确 | |
| ④ | 取少量实验②的溶液于试管中,滴加3滴饱和 溶液 溶液 | 溶液变浑浊 | 猜想一也正确 |
【提出质疑】
(5)甲同学提出,实验④并不能证明猜想一正确,理由是
【再次探究】
(6)小组成员进行进一步探究,请完成表格中的实验操作及现象
| 实验序号 | 实验操作 | 现象 |
| ⑤ | 滴加3滴蒸馏水 | 无明显现象 | |
| ⑥ | 无明显现象 | ||
| ⑦ | 滴加3滴饱和氯水 | 溶液变橙红色 | |
| ⑧ | 滴加3滴 溶液 溶液 | ||
| 得出结论 | i.由实验⑥的现象可以判断:猜想一不正确, ii.结合实验⑤⑦⑧的现象可以判断:猜想二正确。 | ||
【得出结论】
(7)由实验结论可以判断:本实验条件下还原性强弱:

 (填“强于”“弱于”或“等于”)。
(填“强于”“弱于”或“等于”)。
您最近一年使用:0次
名校
8 . 实验室常采用点滴板来完成部分实验,这样既可以节约药品的用量,又便于观察实验现象。图中所示的实验点滴板上描述的实验现象或推论正确的是


A.往 固体中滴加 固体中滴加 溶液,有气体产生且生成大量的白色沉淀 溶液,有气体产生且生成大量的白色沉淀 |
| B.新制氯水滴加到pH试纸或淀粉KI溶液孔穴中,都体现新制氯水的漂白性 |
C.生锈铁屑加过量稀硫酸后,通过滴加 溶液的褪色来验证原溶液中存在 溶液的褪色来验证原溶液中存在 |
D.生锈铁屑加过量稀硫酸后,若滴加KSCN溶液变成血红色可验证原溶液存在 |
您最近一年使用:0次
9 . 三草酸合铁酸钾晶体K3[Fe(C2O4)3]·3H2O(M=491g/mol)是一种感光剂和高效的污水处理剂。
I.某研究小组同学查阅资料发现K3[Fe(C2O4)3]·3H2O加热后会分解产生CO和CO2,于是设计了如下实验进行验证。请回答:
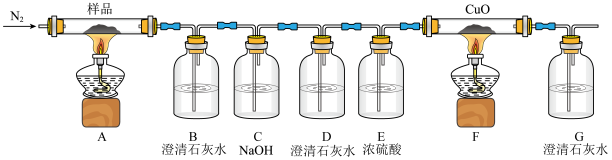
(1)C中NaOH溶液的作用为___________ ;D中澄清石灰水作用为___________ 。
(2)证明有CO产生的现象为___________ 。
(3)该装置还存在的缺陷是___________ 。
II.制备K3[Fe(C2O4)3]·3H2O的途径如下,请回答下列问题:
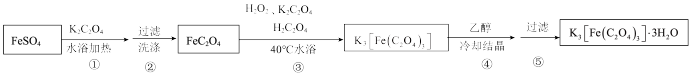
研究小组通过查阅资料得知:
a.K3[Fe(C2O4)3]·3H2O对光敏感,易溶于水,难溶于乙醇;
b.很多草酸盐(例如CaC2O4、BaC2O4)难溶于水,但能溶解于稀硝酸。
(4)步骤③中,控制水浴温度不能超过40℃的原因为___________ 。
(5)研究小组的同学对K3[Fe(C2O4)3]组成有两种看法,分别为:
甲同学:K3[Fe(C2O4)3]由K+、Fe3+、 构成;
构成;
乙同学:K3[Fe(C2O4)3]由K+、[Fe(C2O4)3]3-构成。
请设计实验,验证哪位同学的说法是正确的:___________ 。
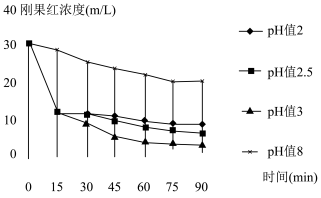
(6)K3[Fe(C2O4)3]联合H2O2体系可用于降解染料,一定浓度的该混合溶液,在不同pH条件下降解刚果红的效率如图所示,在实际应用过程中,应选择pH=___________ 。
(7)关于制备流程,下列说法正确的是___________。
(8)制得的K3[Fe(C2O4)3]·3H2O含少量FeC2O4·2H2O,为测定其纯度,进行如下实验:
步骤I:称取5.000g三草酸合铁酸钾晶体,配制成1.000L溶液,固体完全溶解。
步骤II:取20.00mL溶液,与0.1000molL-酸性KMnO4溶液反应,消耗2.46mL。
步骤III:另取20.00mL溶液,加入过量铜粉,过滤,洗涤,将滤液和洗涤液合并。
步骤IV:将合并液与0.1000mol/L酸性KMnO4溶液反应,消耗2.86mL。
已知 与
与 的反应为(未配平):
的反应为(未配平): +
+ +H+→CO2↑+Mn2++H2O
+H+→CO2↑+Mn2++H2O
①写出Fe2+与酸性KMnO4溶液反应的离子方程式:___________ 。
②研究小组制得的K3[Fe(C2O4)3]·3H2O纯度为___________ 。
I.某研究小组同学查阅资料发现K3[Fe(C2O4)3]·3H2O加热后会分解产生CO和CO2,于是设计了如下实验进行验证。请回答:

(1)C中NaOH溶液的作用为
(2)证明有CO产生的现象为
(3)该装置还存在的缺陷是
II.制备K3[Fe(C2O4)3]·3H2O的途径如下,请回答下列问题:

研究小组通过查阅资料得知:
a.K3[Fe(C2O4)3]·3H2O对光敏感,易溶于水,难溶于乙醇;
b.很多草酸盐(例如CaC2O4、BaC2O4)难溶于水,但能溶解于稀硝酸。
(4)步骤③中,控制水浴温度不能超过40℃的原因为
(5)研究小组的同学对K3[Fe(C2O4)3]组成有两种看法,分别为:
甲同学:K3[Fe(C2O4)3]由K+、Fe3+、
 构成;
构成;乙同学:K3[Fe(C2O4)3]由K+、[Fe(C2O4)3]3-构成。
请设计实验,验证哪位同学的说法是正确的:
(6)K3[Fe(C2O4)3]联合H2O2体系可用于降解染料,一定浓度的该混合溶液,在不同pH条件下降解刚果红的效率如图所示,在实际应用过程中,应选择pH=

(7)关于制备流程,下列说法正确的是___________。
| A.步骤①为复分解反应,步骤③为氧化还原反应 |
| B.步骤②判断沉淀是否洗涤干净,可以取少量最后一次洗涤液,加入氯化钡溶液,观察是否有白色沉淀产生 |
| C.步骤④,加入乙醇目的在于降低K3[Fe(C2O4)3]的溶解度,使其结晶析出 |
| D.步骤④⑤可以在日光下进行 |
(8)制得的K3[Fe(C2O4)3]·3H2O含少量FeC2O4·2H2O,为测定其纯度,进行如下实验:
步骤I:称取5.000g三草酸合铁酸钾晶体,配制成1.000L溶液,固体完全溶解。
步骤II:取20.00mL溶液,与0.1000molL-酸性KMnO4溶液反应,消耗2.46mL。
步骤III:另取20.00mL溶液,加入过量铜粉,过滤,洗涤,将滤液和洗涤液合并。
步骤IV:将合并液与0.1000mol/L酸性KMnO4溶液反应,消耗2.86mL。
已知
 与
与 的反应为(未配平):
的反应为(未配平): +
+ +H+→CO2↑+Mn2++H2O
+H+→CO2↑+Mn2++H2O①写出Fe2+与酸性KMnO4溶液反应的离子方程式:
②研究小组制得的K3[Fe(C2O4)3]·3H2O纯度为
您最近一年使用:0次
名校
10 . I.某化学兴趣小组用如图装置制备 并探究其性质。
并探究其性质。
i. 酸性条件下与
酸性条件下与 迅速反应生成S和
迅速反应生成S和
ii. 有较强的还原性
有较强的还原性
(1)装置A中a的作用是_____________________________ ;
(2)上述装置中存在一处缺陷,会干扰 和
和 性质的探究,改进的方法是
性质的探究,改进的方法是_________________ 。
(3)改进实验装置后,B中 被氧化为
被氧化为 ,写出该反应的离子方程式
,写出该反应的离子方程式_________________________ 。
(4)装置C中溶液颜色先变为血红色,一段时间后褪色。
①用离子方程式表示C中溶液变红色的原因____________________________ 、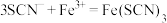 。
。
②某同学对褪色原因提出假设:
假设1: 被
被 氧化为更高价态;
氧化为更高价态;
假设2: 被
被 氧化为更高价态。
氧化为更高价态。
为进一步探究,该同学取装置C褪色后的溶液少许于试管中,加入____________________________ ,若出现____________________________ 现象,则说明假设2成立。
II.有两组化学兴趣小组同学对、 、
、 、
、 的性质及其之间的反应进行探究。回答下列问题:
的性质及其之间的反应进行探究。回答下列问题:
(5)甲组同学探究溶液 对
对 稳定性的影响,得到如图所示结果,则增强
稳定性的影响,得到如图所示结果,则增强 稳定性的措施为
稳定性的措施为______________________________ 。 与
与 的反应,进行如图所示实验:
的反应,进行如图所示实验: 与
与 反应的离子方程式为
反应的离子方程式为______________________________ 。
为了探究白色沉淀产生的原因,同学们查阅资料得知:
i. 是难溶于水的白色固体;
是难溶于水的白色固体;
ii. 的化学性质与
的化学性质与 相似;
相似;
iii.
填写实验方案:
②步骤2的空格中填写的数据为___________________ 。
③ 与
与 反应的离子方程式为
反应的离子方程式为____________________________________ 。
 并探究其性质。
并探究其性质。
i.
 酸性条件下与
酸性条件下与 迅速反应生成S和
迅速反应生成S和
ii.
 有较强的还原性
有较强的还原性(1)装置A中a的作用是
(2)上述装置中存在一处缺陷,会干扰
 和
和 性质的探究,改进的方法是
性质的探究,改进的方法是(3)改进实验装置后,B中
 被氧化为
被氧化为 ,写出该反应的离子方程式
,写出该反应的离子方程式(4)装置C中溶液颜色先变为血红色,一段时间后褪色。
①用离子方程式表示C中溶液变红色的原因
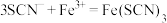 。
。②某同学对褪色原因提出假设:
假设1:
 被
被 氧化为更高价态;
氧化为更高价态;假设2:
 被
被 氧化为更高价态。
氧化为更高价态。为进一步探究,该同学取装置C褪色后的溶液少许于试管中,加入
II.有两组化学兴趣小组同学对、
 、
、 、
、 的性质及其之间的反应进行探究。回答下列问题:
的性质及其之间的反应进行探究。回答下列问题:(5)甲组同学探究溶液
 对
对 稳定性的影响,得到如图所示结果,则增强
稳定性的影响,得到如图所示结果,则增强 稳定性的措施为
稳定性的措施为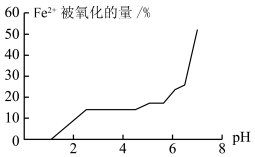
 与
与 的反应,进行如图所示实验:
的反应,进行如图所示实验:
 与
与 反应的离子方程式为
反应的离子方程式为为了探究白色沉淀产生的原因,同学们查阅资料得知:
i.
 是难溶于水的白色固体;
是难溶于水的白色固体;ii.
 的化学性质与
的化学性质与 相似;
相似;iii.

填写实验方案:
实验方案 | 实验现象 |
步骤1:取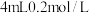 的 的 溶液,向其中滴加3滴 溶液,向其中滴加3滴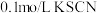 溶液 溶液 | 无明显现象 |
步骤2:取 的 的 溶液,向其中滴加3滴 溶液,向其中滴加3滴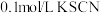 溶液 溶液 | 产生白色沉淀 |
③
 与
与 反应的离子方程式为
反应的离子方程式为
您最近一年使用:0次
2024-01-13更新
|
149次组卷
|
3卷引用:福建省厦门第一中学2023-2024学年高一上学期12月月考化学试题




