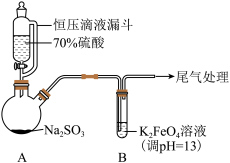
(2)FeS2在空气中煅烧的化学方程式为
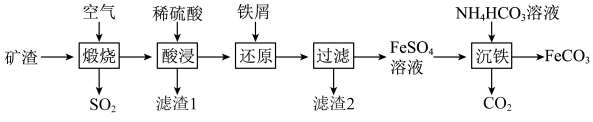
(3)在“还原”步骤,在向酸浸后溶液加入过量铁屑,除了能将
 转化为
转化为 外,还能
外,还能 FeSO4溶液和5.2g固体沉淀物。
FeSO4溶液和5.2g固体沉淀物。①5.2g固体沉淀物的成份为
②原Fe2(SO4)3溶液的物质的量浓度是
(4)检验
 是否完全被还原的实验操作是
是否完全被还原的实验操作是(5)制备FeCO3,写出“沉铁”步骤发生反应的离子方程式:
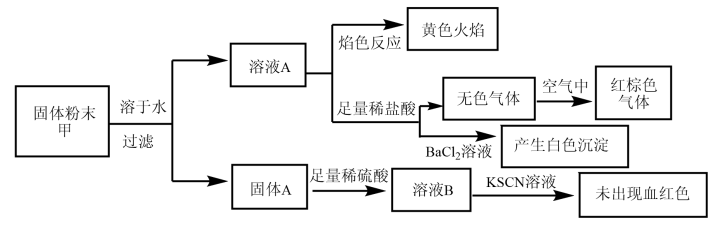
| A.固体粉末中含有钠元素,但不含钾元素 |
| B.固体粉末中无法确定是否含有K2SO3 |
| C.固体粉末中至少含有KNO3、NaNO2中的一种 |
| D.固体粉末中可能含有K2CO3、不含Fe2O3 |
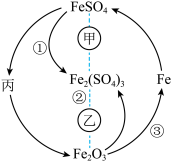
(1)根据分析可知丙为
A.稀硝酸 B.
 溶液 C.
溶液 C. D.
D. 溶液
溶液(2)实验室保存
 溶液时,为了防止其被氧化,可以往溶液中加入适量
溶液时,为了防止其被氧化,可以往溶液中加入适量 溶液中的
溶液中的 是否被氧化。
是否被氧化。(3)丙的悬浊液在空气中变色的原因为
 ,含少量
,含少量 、
、 、
、 等杂质)为原料制备
等杂质)为原料制备 (铋酸钠,浅黄色不溶于冷水的固体,是常用试剂),流程如下:
(铋酸钠,浅黄色不溶于冷水的固体,是常用试剂),流程如下: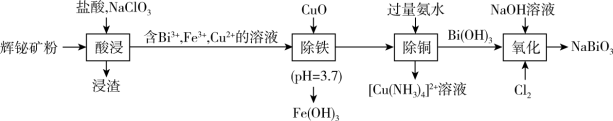
 难溶于水;
难溶于水;②酸浸后,矿粉中的硫元素完全变为硫单质;
回答下列问题:
(1)
 中Cu的化合价为
中Cu的化合价为 反应的离子方程式
反应的离子方程式(2)检验“酸浸”液中是否含
 ,可选择
,可选择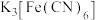 溶液。能证明不存在
溶液。能证明不存在 的实验现象是
的实验现象是(3)氧化后,从反应体系中分离出
 粗产品的操作名称是
粗产品的操作名称是(4)上述流程中,基态原子未成对电子数最多的金属元素名称是
(5)向
 和
和 混合溶液中通入氯气制备
混合溶液中通入氯气制备 的离子方程式
的离子方程式(6)已知常温下,
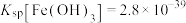 ,调节FeCl3溶液至
,调节FeCl3溶液至 ,所得溶液中c(Fe3+)=
,所得溶液中c(Fe3+)= )为原料制备华铁粉的流程如下:
)为原料制备华铁粉的流程如下: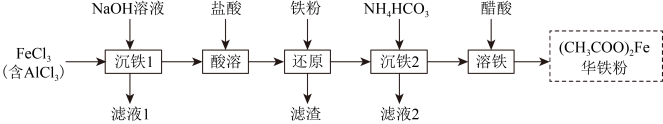
A.“沉铁1”中可用氨水替代 溶液 溶液 |
B.“还原”时加入铁粉的目的是将 转化成 转化成 |
C.滤液2的主要成分是 |
D.“溶铁”的离子方程式为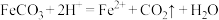 |
资料:i.K2FeO4为紫色固体,微溶于KOH溶液;具有强氧化性,在酸性或中性溶液中快速产生O2,在碱性溶液中较稳定。
ii.Fe3+可以与C2O
 形成[Fe(C2O4)3]3-;
形成[Fe(C2O4)3]3-;| 装置 | 操作及现象 |
| 实验一:向B中通入SO2,产生暗红褐色沉淀X和溶液Y(略显红色);继续通入SO2一段时间后,溶液呈红色,继而变为橙色,最终沉淀消失,溶液几乎无色。 |
(1)A中产生SO2的化学方程式为
(2)暗红褐色沉淀X可能含Fe3+、OH-、SO
 、SO
、SO ,检验如下:
,检验如下:实验二:向X中加入足量盐酸,沉淀溶解。取少量溶液,滴加KSCN溶液后变红。证明溶液中存在
 ,原因是
,原因是实验三:向X中加入H2C2O4溶液,沉淀溶解。继续滴加BaCl2溶液,产生白色沉淀,过滤后,向沉淀中加入盐酸,白色沉淀溶解。确认X中不含SO
 。
。实验三中用H2C2O4溶液溶解沉淀的目的是:
实验四:向X中加入足量盐酸,沉淀溶解。加入几滴碘水(含淀粉),蓝色立即褪去。静置,一段时间后蓝色复现,振荡,不褪色。
结合离子方程式解释沉淀溶解后的现象:
(3)查阅资料:a.Fe3+、SO
 、H2O(或OH﹣)会形成配合物HOFeOSO2。
、H2O(或OH﹣)会形成配合物HOFeOSO2。
 和O2在金属离子的催化作用下产生具有强氧化性的过一硫酸(HSO
和O2在金属离子的催化作用下产生具有强氧化性的过一硫酸(HSO
①向溶液Y中滴加2滴KSCN溶液,未见红色;再加几滴6mol·L-1盐酸,溶液变红。溶液Y中存在Fe(Ⅲ),但直接滴加KSCN溶液未见红色的原因是
②取出部分实验一中的橙色溶液,久置不褪色。结合资料a中过程ii分析实验一中溶液最终“几乎无色”的原因:
总结:SO2与K2FeO4发生了氧化还原反应和复分解反应,并且遵循化学反应速率和限度规律。
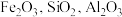 )制备软磁性材料
)制备软磁性材料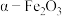 。主要转化流程如图:
。主要转化流程如图:
(1)制绿矾。烧渣到绿矾的工艺中涉及“酸浸”“还原”“除杂”“结晶”等实验流程。
①酸浸。
②还原。向“酸浸”后的溶液中加入过量铁粉,使
 完全转化为
完全转化为 。该过程除生成
。该过程除生成 外,还会生成
外,还会生成 是否还原完全的实验操作是
是否还原完全的实验操作是③除杂。向“还原”后滤液中加入
 溶液,调节
溶液,调节 为
为 除去完全。[已知:
除去完全。[已知: 时
时 为沉淀完全,
为沉淀完全, 时
时 开始沉淀。]
开始沉淀。]④结晶。结合题图所示的绿矾溶解度曲线,补充完整获得
 晶体的实验操作。向
晶体的实验操作。向 溶液中再加入稀硫酸酸化,
溶液中再加入稀硫酸酸化, 晶体。
晶体。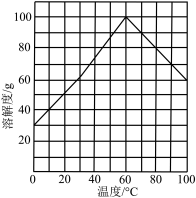
(2)制
 。将
。将 溶液与氨水
溶液与氨水 混合溶液中的一种加入三颈瓶中(装置见图),通过分液漏斗缓慢滴加另一种溶液,充分反应,过滤。
混合溶液中的一种加入三颈瓶中(装置见图),通过分液漏斗缓慢滴加另一种溶液,充分反应,过滤。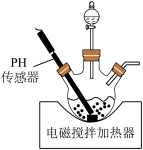
①分液漏斗中的溶液是
 的离子方程式为
的离子方程式为②生成的
 沉淀需“洗涤完全”,检验方法是
沉淀需“洗涤完全”,检验方法是(3)制
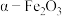 。将纯净的
。将纯净的 放入管式炉内煅烧
放入管式炉内煅烧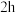 ,获得产品
,获得产品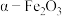 。图为其他条件相同时不同煅烧温度对产品中
。图为其他条件相同时不同煅烧温度对产品中 质量分数的影响,当煅烧温度高于
质量分数的影响,当煅烧温度高于 时,产品中
时,产品中 质量分数降低,铁元素质量分数升高,其可能原因是
质量分数降低,铁元素质量分数升高,其可能原因是
(1)甲组同学取2mL0.1mol•L-1FeSO4溶液,加1滴KSCN溶液,无明显现象,再加几滴3%H2O2溶液(用H2SO4酸化至pH=1),溶液颜色变红。甲组同学通过上述实验分析Fe2+具有
(2)针对Fe3++3SCN-
 Fe(SCN)3,下列说法正确的是
Fe(SCN)3,下列说法正确的是| A.增大KSCN溶液的浓度,平衡常数增大 |
| B.向上述平衡体系中加入适量KCl圆体,平衡不移动 |
| C.加水稀释,平衡向左移动,且溶液的红色变浅 |
D.加入少量铁粉,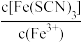 减小 减小 |
(4)同时乙组同学查阅资料发现Fe2+与SCN-可发生反应,生成无色的电中性配合物。为证实该性质,乙组同学用FeCO3进行了如图所示的a和b两组实验:
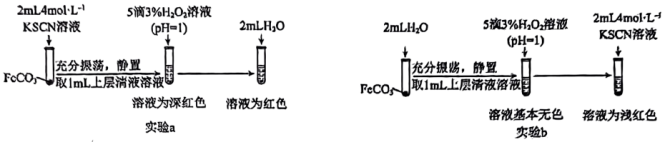
写出实验a中FeCO3与KSCN反应的离子方程式
(5)反应S2O
 (aq)+2I-(aq)=2SO
(aq)+2I-(aq)=2SO (aq)+I2(aq)在加入Fe3+催化后,反应进程中的能量变化如图所示。已知:反应机理中有Fe2+出现。
(aq)+I2(aq)在加入Fe3+催化后,反应进程中的能量变化如图所示。已知:反应机理中有Fe2+出现。
①写出反应历程中“速率决定步骤”的热化学方程式:
②反应过程中由于Fe2+浓度较低而不容易被检测到,请回答Fe2+浓度较低的原因:
(6)溶液中Fe2+与邻二集非X
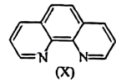 会生成橘黄色的配合物Y。
会生成橘黄色的配合物Y。①邻二氮菲提供的配位原子是
②使用该方法时,需要控制pH在2~9之间,其原因为:
③取2.00mLc(Fe2+)=6.0×10-4mol/L的溶液,加入不同体积、浓度均为c(X)=6.0×10-4mol/L的邻二氮菲溶液,充分反应后加水定容至25mL,得到系列溶液,测其吸光度,结果如表:
| V(X)/mL | 2.00 | 3.00 | 4.00 | 5.00 | 6.00 | 8.00 |
| 吸光度/A | 0.24 | 0.36 | 0.48 | 0.60 | 0.72 | 0.72 |
 成正比。Fe2+和邻二氮菲X的吸光度近似为0。
成正比。Fe2+和邻二氮菲X的吸光度近似为0。Fe2++nX=Y(橘黄色)
结合上面实验数据,通过计算回答Y中Fe2+的配位数(与中心原子或离子以配位键形式结合的配位原子数目):
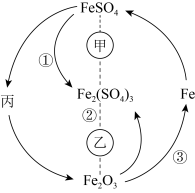
 表示一定条件下A能一步转化为B,A……B表示一定条件下A能与B反应。
表示一定条件下A能一步转化为B,A……B表示一定条件下A能与B反应。(1)根据分析可知丙为
A.稀硝酸 B.
 溶液
溶液C.
 D.
D. 溶液
溶液(2)实验室保存
 溶液时,为了防止其被氧化,可以往溶液中加入适量
溶液时,为了防止其被氧化,可以往溶液中加入适量 溶液中的
溶液中的 是否被氧化。
是否被氧化。(3)丙的悬浊液在空气中变色的原因为
(4)绿矾
 常用于制备铁触媒催化剂。隔绝空气条件下,
常用于制备铁触媒催化剂。隔绝空气条件下, 绿矾受热过程中固体的质量随温度变化的曲线如图所示,加热至
绿矾受热过程中固体的质量随温度变化的曲线如图所示,加热至 时,绿矾发生反应的化学方程式为
时,绿矾发生反应的化学方程式为 点对应的固体是一种金属氧化物,该物质的化学式为
点对应的固体是一种金属氧化物,该物质的化学式为
10 . 实验小组用如图装置探究Cl2、Fe3+、I2的氧化性强弱(夹持装置和加热装置已省略,气密性已检验)。
已知:I2遇淀粉溶液变蓝

实验过程:
I.打开弹簧夹K1和K2,通入一段时间N2,再将导管插入B中,继续通入N2一段时间,然后夹紧K1;
Ⅱ.打开活塞a,滴加一定量浓盐酸后关闭活塞a,给A加热;
Ⅲ.当B中的溶液变为黄色时,停止加热,夹紧K2;
IV.打开活塞b,将少量B中溶液滴入C中,关闭活塞b。
(1)操作I中通入一段时间N2的目的是
(2)浸有NaOH溶液的棉花的作用是
(3)B中溶液变黄说明氧化性Cl2>Fe3+,反应的离子方程式是
(4)为探究Fe3+和I2的氧化性强弱,甲、乙、丙三位同学分别完成了上述实验,并检测B中黄色溶液和C中混合溶液中的部分微粒,结果如表所示(忽略空气中O2的影响)。
B中部分微粒 | C中部分微粒 | |
甲 | 既有Fe3+又有Fe2+ | 有I2 |
乙 | 有Fe3+无Fe2+ | 有I2 |
丙 | 有Fe3+无Fe2+ | 有Fe2+ |
①检验B中黄色溶液中含有Fe3+的试剂是
②进一步检验IL的实验操作及现象是
③能证明该实验条件下氧化性Fe3+>I2的有
不能证明的请说明理由
④已知碘原子的原子结构示意图为 ,从原子结构角度解释碘原子的得电子能力弱于氯原子的原因
,从原子结构角度解释碘原子的得电子能力弱于氯原子的原因