1 . 已知① ②C2H5OH(g)=C2H5OH(l)
②C2H5OH(g)=C2H5OH(l) 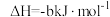 ,③
,③ (a、b、c均>0)。若使
(a、b、c均>0)。若使 酒精液体完全燃烧,最后恢复到室温,则放出的热量为(单位:
酒精液体完全燃烧,最后恢复到室温,则放出的热量为(单位: )
)
 ②C2H5OH(g)=C2H5OH(l)
②C2H5OH(g)=C2H5OH(l) 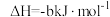 ,③
,③ (a、b、c均>0)。若使
(a、b、c均>0)。若使 酒精液体完全燃烧,最后恢复到室温,则放出的热量为(单位:
酒精液体完全燃烧,最后恢复到室温,则放出的热量为(单位: )
)A.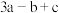 | B.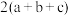 | C.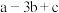 | D.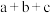 |
您最近一年使用:0次
解题方法
2 . 工业燃烧煤、石油等化石燃料释放出大量氮氧化物(NOx)、CO2、CO、SO2等气体,严重污染空气。对废气进行脱硝、脱碳和脱硫处理可实现绿色环保、废物利用。
(1)I.脱硝:已知:H2的燃烧热为285.8 kJ/mol
N2(g)+2O2(g)=2NO2(g) H= +133 kJ/mol
H= +133 kJ/mol
H2O(g)=H2O(l) H=- 44 kJ/mol
H=- 44 kJ/mol
催化剂存在下,H2还原NO2生成水蒸气和其他无毒物质的热化学方程式为___________ 。
(2)II.脱碳:
向2L恒容密闭容器中加入2 mol CO2、6 mol H2,在适当的催化剂作用下,发生反应 CO2(g) + 3H2(g) =CH3OH(l) + H2O(l)。下列叙述能说明此反应达到平衡状态的是___________ 。
A.混合气体的平均式量保持不变
B.CO2和H2的体积分数保持不变
C.CO2和H2的转化率相等
D.混合气体的密度保持不变
E.1 mol CO2生成的同时有3 mol H—H键断裂
(3)III.脱硫:
如图电解装置可将雾霾中的NO、SO2分别转化为NH 和SO
和SO 。物质A的化学式为
。物质A的化学式为___________ ,阴极的电极反应式是___________ 。
(1)I.脱硝:已知:H2的燃烧热为285.8 kJ/mol
N2(g)+2O2(g)=2NO2(g)
 H= +133 kJ/mol
H= +133 kJ/molH2O(g)=H2O(l)
 H=- 44 kJ/mol
H=- 44 kJ/mol催化剂存在下,H2还原NO2生成水蒸气和其他无毒物质的热化学方程式为
(2)II.脱碳:
向2L恒容密闭容器中加入2 mol CO2、6 mol H2,在适当的催化剂作用下,发生反应 CO2(g) + 3H2(g) =CH3OH(l) + H2O(l)。下列叙述能说明此反应达到平衡状态的是
A.混合气体的平均式量保持不变
B.CO2和H2的体积分数保持不变
C.CO2和H2的转化率相等
D.混合气体的密度保持不变
E.1 mol CO2生成的同时有3 mol H—H键断裂
(3)III.脱硫:
如图电解装置可将雾霾中的NO、SO2分别转化为NH
 和SO
和SO 。物质A的化学式为
。物质A的化学式为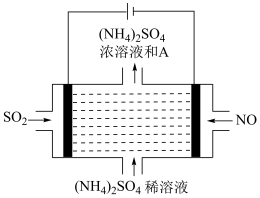
您最近一年使用:0次
3 . 以 制备甲醇是实现“双碳”目标的重要途径。
制备甲醇是实现“双碳”目标的重要途径。
(1) 加氢制甲醇的能量变化如图所示,该反应的热化学方程式为
加氢制甲醇的能量变化如图所示,该反应的热化学方程式为___________ 。 和
和 ,180℃下反应生成甲醇和水:
,180℃下反应生成甲醇和水: 。测得各物质物质的量随时间的部分变化图像如图所示:
。测得各物质物质的量随时间的部分变化图像如图所示: 的平均反应速率为
的平均反应速率为___________  。
。
②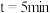 时,正反应速率
时,正反应速率___________ 逆反应速率(填“>”“<”或“=”)。
③下列能够说明总反应已达到化学平衡状态的是___________ (填标号)。
A.容器中气体密度不再改变 B.容器内总压强不再改变
C. 的比值保持不变 D.
的比值保持不变 D. 的体积分数不再改变
的体积分数不再改变
④其他条件不变,将该恒容容器,改为体积可变的容器,达到平衡时,测得 的转化率为15%,则平衡时甲醇的浓度为
的转化率为15%,则平衡时甲醇的浓度为___________ 。
(3)将甲醇设计成燃料电池,具有启动快、效率高等优点,装置如图所示(A、B为多孔碳棒)。实验测得 向B电极定向移动,则
向B电极定向移动,则___________ (填“A”或“B”)处电极入口通甲醇,正极的电极反应式为___________ 。 ℃时,等物质的量的
℃时,等物质的量的 和
和 充入体积为1L的恒容密闭容器中发生反应:
充入体积为1L的恒容密闭容器中发生反应: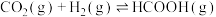
 。实验测得反应速率为:
。实验测得反应速率为: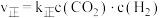 ,
,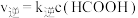 ,
, 、
、 为速率常数。
为速率常数。
① ℃时,
℃时,
___________  (填具体数值)。
(填具体数值)。
②温度从 ℃到
℃到 ℃时,
℃时, ,则
,则 ℃时的平衡压强
℃时的平衡压强___________ (填“>”“<”“=”) ℃时的平衡压强。
℃时的平衡压强。
 制备甲醇是实现“双碳”目标的重要途径。
制备甲醇是实现“双碳”目标的重要途径。(1)
 加氢制甲醇的能量变化如图所示,该反应的热化学方程式为
加氢制甲醇的能量变化如图所示,该反应的热化学方程式为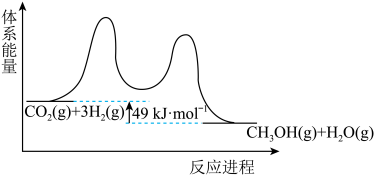
 和
和 ,180℃下反应生成甲醇和水:
,180℃下反应生成甲醇和水: 。测得各物质物质的量随时间的部分变化图像如图所示:
。测得各物质物质的量随时间的部分变化图像如图所示: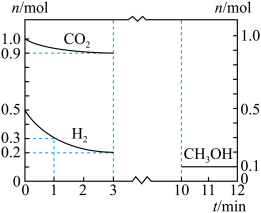
 的平均反应速率为
的平均反应速率为 。
。②
 时,正反应速率
时,正反应速率③下列能够说明总反应已达到化学平衡状态的是
A.容器中气体密度不再改变 B.容器内总压强不再改变
C.
 的比值保持不变 D.
的比值保持不变 D. 的体积分数不再改变
的体积分数不再改变④其他条件不变,将该恒容容器,改为体积可变的容器,达到平衡时,测得
 的转化率为15%,则平衡时甲醇的浓度为
的转化率为15%,则平衡时甲醇的浓度为(3)将甲醇设计成燃料电池,具有启动快、效率高等优点,装置如图所示(A、B为多孔碳棒)。实验测得
 向B电极定向移动,则
向B电极定向移动,则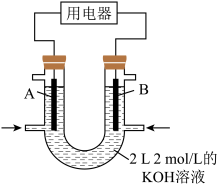
 ℃时,等物质的量的
℃时,等物质的量的 和
和 充入体积为1L的恒容密闭容器中发生反应:
充入体积为1L的恒容密闭容器中发生反应:
 。实验测得反应速率为:
。实验测得反应速率为: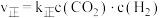 ,
,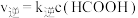 ,
, 、
、 为速率常数。
为速率常数。①
 ℃时,
℃时,
 (填具体数值)。
(填具体数值)。②温度从
 ℃到
℃到 ℃时,
℃时, ,则
,则 ℃时的平衡压强
℃时的平衡压强 ℃时的平衡压强。
℃时的平衡压强。
您最近一年使用:0次
4 .  表示阿伏加德罗常数的值,下列说法正确的是
表示阿伏加德罗常数的值,下列说法正确的是
 表示阿伏加德罗常数的值,下列说法正确的是
表示阿伏加德罗常数的值,下列说法正确的是A.1L0.1mol/L的 溶液中含有的氢离子数为 溶液中含有的氢离子数为 |
B.常温下,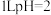 的 的 溶液中含 溶液中含 的数目为 的数目为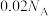 |
C.由  ,若反应放出46.1kJ的热量,则生成 ,若反应放出46.1kJ的热量,则生成 个 个 |
D.氢氧燃料电池装置中,当有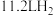 参加反应时,转移的电子数为 参加反应时,转移的电子数为 |
您最近一年使用:0次
5 . (1)已知:
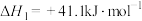


写出 催化氢化合成甲醇和水的热化学方程式:
催化氢化合成甲醇和水的热化学方程式:___________ ;
(2)恒温条件下,可逆反应: 在体积固定的密闭容器中进行,达到平衡状态的标志的是
在体积固定的密闭容器中进行,达到平衡状态的标志的是___________ ;
A.单位时间内生成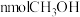 的同时生成
的同时生成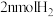
B.混合气体的密度不再改变的状态
C.混合气体的压强不再改变的状态
D.混合气体的平均摩尔质量不再改变的状态
E. 、
、 、
、 浓度之比为
浓度之比为 的状态。
的状态。
(3)工业上在恒容密闭容器中用下列反应合成甲醇:


①该反应的平衡常数表达式为___________ ;
②如表所列数据是反应在不同温度下的化学平衡常数( )
)
a.由表中数据判断该反应的
___________ 0(填“>”、“=”或“<”);
b.某温度下,将 和
和 充入
充入 的密闭容器中,充分反应
的密闭容器中,充分反应 后达到平衡时测得
后达到平衡时测得 ,则
,则 的转化率为
的转化率为___________ ,此时的温度为___________ ;
③要提高 的转化率,可以采取的措施是
的转化率,可以采取的措施是___________ ;
a.升温 b.加入催化剂 c.增加 的浓度 d.恒容充入
的浓度 d.恒容充入 e.分离出甲醇
e.分离出甲醇

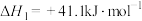


写出
 催化氢化合成甲醇和水的热化学方程式:
催化氢化合成甲醇和水的热化学方程式:(2)恒温条件下,可逆反应:
 在体积固定的密闭容器中进行,达到平衡状态的标志的是
在体积固定的密闭容器中进行,达到平衡状态的标志的是A.单位时间内生成
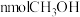 的同时生成
的同时生成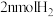
B.混合气体的密度不再改变的状态
C.混合气体的压强不再改变的状态
D.混合气体的平均摩尔质量不再改变的状态
E.
 、
、 、
、 浓度之比为
浓度之比为 的状态。
的状态。(3)工业上在恒容密闭容器中用下列反应合成甲醇:


①该反应的平衡常数表达式为
②如表所列数据是反应在不同温度下的化学平衡常数(
 )
)| 温度 | 250℃ | 300℃ | 350℃ |
 | 2.041 | 0.270 | 0.012 |

b.某温度下,将
 和
和 充入
充入 的密闭容器中,充分反应
的密闭容器中,充分反应 后达到平衡时测得
后达到平衡时测得 ,则
,则 的转化率为
的转化率为③要提高
 的转化率,可以采取的措施是
的转化率,可以采取的措施是a.升温 b.加入催化剂 c.增加
 的浓度 d.恒容充入
的浓度 d.恒容充入 e.分离出甲醇
e.分离出甲醇
您最近一年使用:0次
解题方法
6 . 依据下列热化学方程式得出的结论中,正确的是
A.已知 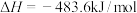 ,则氢气的燃烧热 ,则氢气的燃烧热 为 为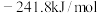 |
B.已知C(石墨,s)= C(金刚石,s)  ,则金刚石比石墨稳定 ,则金刚石比石墨稳定 |
C.已知 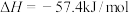 ,则含 ,则含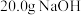 的稀溶液与稀盐酸完全中和,放出 的稀溶液与稀盐酸完全中和,放出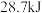 的热量 的热量 |
D.已知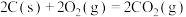  ; ;  ,则 ,则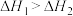 |
您最近一年使用:0次
7 . 第五届硒博会主题为“健康中国·硒引天下”。硒(Se)是第四周期第VI A族元素,是人体内不可或缺的微量元素,H2Se是制备新型光伏太阳能电池、半导体材料和金属硒化物的重要原料。
(1)已知:①2H2Se(g)+O2(g) 2Se(s)+2H2O(l) △H =a kJ·mol-1
2Se(s)+2H2O(l) △H =a kJ·mol-1
②2H2(g)+O2(g) 2H2O(l) △H=b kJ·mol-1
2H2O(l) △H=b kJ·mol-1
反应H2(g)+Se(s) H2Se(g)的反应热△H=
H2Se(g)的反应热△H=___________ kJ·mol-1(用含a、b的代数式表示)。
(2)T℃时,向一恒容密闭容器中加入3molH2和1 mol Se,发生反应H2(g)+Se(s) H2Se(g),
H2Se(g),
①下列情况可判断反应达到平衡状态的是___________ (填字母代号)。
a.气体的密度不变 b.v(H2)=v(H2Se)
c.气体的压强不变 d.气体的平均摩尔质量不变
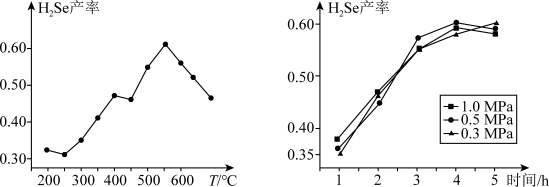
②以5小时内得到的H2Se为产量指标,且温度、压强对H2Se产率的影响如图所示:___________ 。
(3)已知常温下H2Se的电离平衡常数K1=1.3×10-4、K2=5.0×10-11,则NaHSe溶液呈___________ (填“酸性”或“碱性”),该溶液中的物料守恒关系式为___________ 。
(4)工业上从含硒废料中提取硒的方法是用硫酸和硝酸钠的混合溶液处理后获得亚硒酸和少量硒酸,再与盐酸共热,硒酸转化为亚硒酸,硒酸与盐酸反应的化学方程式为___________ ,最后通入SO2析出硒单质。
(5)H2 Se在一定条件下可以制备出CuSe,已知常温时CuSe的Ksp=7.9×10-49,CuS的Ksp=1.3×10-36,则反应CuS(s)+Se2-(aq) CuSe(s)+S2-(aq)的化学平衡常数K=
CuSe(s)+S2-(aq)的化学平衡常数K=___________ (保留2位有效数字)。
(1)已知:①2H2Se(g)+O2(g)
 2Se(s)+2H2O(l) △H =a kJ·mol-1
2Se(s)+2H2O(l) △H =a kJ·mol-1②2H2(g)+O2(g)
 2H2O(l) △H=b kJ·mol-1
2H2O(l) △H=b kJ·mol-1反应H2(g)+Se(s)
 H2Se(g)的反应热△H=
H2Se(g)的反应热△H=(2)T℃时,向一恒容密闭容器中加入3molH2和1 mol Se,发生反应H2(g)+Se(s)
 H2Se(g),
H2Se(g),①下列情况可判断反应达到平衡状态的是
a.气体的密度不变 b.v(H2)=v(H2Se)
c.气体的压强不变 d.气体的平均摩尔质量不变
②以5小时内得到的H2Se为产量指标,且温度、压强对H2Se产率的影响如图所示:
(3)已知常温下H2Se的电离平衡常数K1=1.3×10-4、K2=5.0×10-11,则NaHSe溶液呈
(4)工业上从含硒废料中提取硒的方法是用硫酸和硝酸钠的混合溶液处理后获得亚硒酸和少量硒酸,再与盐酸共热,硒酸转化为亚硒酸,硒酸与盐酸反应的化学方程式为
(5)H2 Se在一定条件下可以制备出CuSe,已知常温时CuSe的Ksp=7.9×10-49,CuS的Ksp=1.3×10-36,则反应CuS(s)+Se2-(aq)
 CuSe(s)+S2-(aq)的化学平衡常数K=
CuSe(s)+S2-(aq)的化学平衡常数K=
您最近一年使用:0次
8 . 二氧化碳催化加氢制甲醇,有利于减少温室气体二氧化碳。回答下列问题:
(1)二氧化碳加氢制甲醇的总反应可表示为:
该反应一般认为通过如下步骤来实现:
①
②
总反应的
___________  ;若反应①为慢反应,下列示意图中能体现上述反应能量变化的是
;若反应①为慢反应,下列示意图中能体现上述反应能量变化的是___________ (填标号)。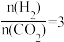 时,在不同条件下达到平衡,设体系中甲醇的物质的量分数为
时,在不同条件下达到平衡,设体系中甲醇的物质的量分数为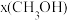 ,在
,在 ℃下的
℃下的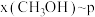 、在
、在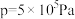 下的
下的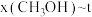 如图所示。
如图所示。
___________ ;
②图中对应等压过程的曲线是___________ ;
③当 时,
时, 的平衡转化率
的平衡转化率
___________ ,反应条件可能为___________ 或___________ 。
(1)二氧化碳加氢制甲醇的总反应可表示为:

该反应一般认为通过如下步骤来实现:
①

②

总反应的

 ;若反应①为慢反应,下列示意图中能体现上述反应能量变化的是
;若反应①为慢反应,下列示意图中能体现上述反应能量变化的是A. 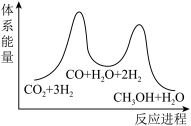 B.
B.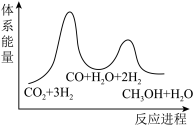
C. D.
D.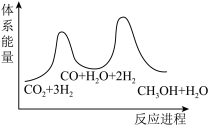
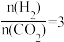 时,在不同条件下达到平衡,设体系中甲醇的物质的量分数为
时,在不同条件下达到平衡,设体系中甲醇的物质的量分数为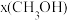 ,在
,在 ℃下的
℃下的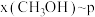 、在
、在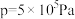 下的
下的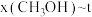 如图所示。
如图所示。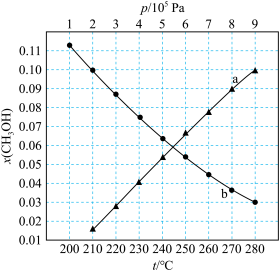

②图中对应等压过程的曲线是
③当
 时,
时, 的平衡转化率
的平衡转化率
您最近一年使用:0次
9 . 能源、环境与生产生活和社会发展密切相关。
(1)工业上利用CO和H2在催化剂作用下合成甲醇: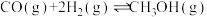 (甲醇结构式
(甲醇结构式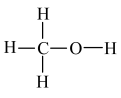 ),已知反应中有关物质的化学键键能数据如下表所示:
),已知反应中有关物质的化学键键能数据如下表所示:
则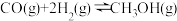
 =
=___________ kJ/mol
(2)以甲醇为燃料的新型电池,其成本大大低于以氢气为燃料的传统燃料电池。下图是目前研究较多的一类固体氧化物燃料电池工作原理示意图。___________ 极,B极的电极反应式为___________ 。
(3)如图,其中甲池的总反应式为: ,下列说法正确的是
,下列说法正确的是___________ 装置,乙池中石墨电极的名称是___________ 。
②甲池通入氧气的电极反应式为___________ 。
③电解一段时间后,乙池中溶液的pH将___________ (填“增大”“减小”或“不变”)
④丙池中阴极上发生的电极反应为___________ 。
(4)现以甲醇燃料电池,采用电解法来处理酸性含铬废水(主要含有 ),实验室利用如图装置模拟该方法:
),实验室利用如图装置模拟该方法:___________ (填“正”或“负”)极,M电极的电极反应式为___________ 。
(1)工业上利用CO和H2在催化剂作用下合成甲醇:
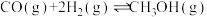 (甲醇结构式
(甲醇结构式 ),已知反应中有关物质的化学键键能数据如下表所示:
),已知反应中有关物质的化学键键能数据如下表所示:| 化学键 | H—H | C—O | C≡O | H—O | C—H |
| E/(kJ/mol) | 436 | 343 | 1076 | 465 | 413 |
则
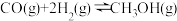
 =
=(2)以甲醇为燃料的新型电池,其成本大大低于以氢气为燃料的传统燃料电池。下图是目前研究较多的一类固体氧化物燃料电池工作原理示意图。

(3)如图,其中甲池的总反应式为:
 ,下列说法正确的是
,下列说法正确的是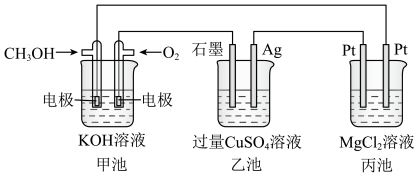
②甲池通入氧气的电极反应式为
③电解一段时间后,乙池中溶液的pH将
④丙池中阴极上发生的电极反应为
(4)现以甲醇燃料电池,采用电解法来处理酸性含铬废水(主要含有
 ),实验室利用如图装置模拟该方法:
),实验室利用如图装置模拟该方法:
您最近一年使用:0次
解题方法
10 . 以  为原料合成
为原料合成  的反应是研究热点之一,该反应体系涉及的反应如下:
的反应是研究热点之一,该反应体系涉及的反应如下:
I.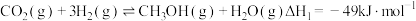
II.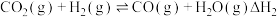
回答下列问题:
(1)已知 和101kPa下,
和101kPa下, 的燃烧热分别为
的燃烧热分别为  、
、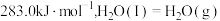
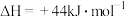 ,则∆H2=
,则∆H2=___________ kJ/mol。
(2)在恒压密闭容器中,按照 投料进行反应,反应I、
投料进行反应,反应I、 以物质的分压表示的平衡常数
以物质的分压表示的平衡常数 随温度
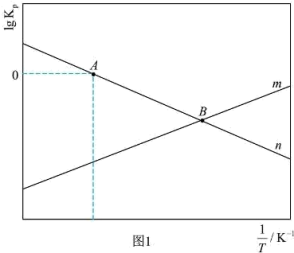
随温度  的变化关系如下图1所示(体系总压为
的变化关系如下图1所示(体系总压为 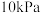 )。
)。 对应图1中
对应图1中___________ (填:“ ” 或“
” 或“ ”);
”);  点对应温度下体系达到平衡时
点对应温度下体系达到平衡时  的转化率为
的转化率为  ,反应I的Kp=
,反应I的Kp=___________ kPa-2 (保留两位有效数字)。
②通过调整温度可调控平衡时 的值。
的值。 点对应温度下,平衡时
点对应温度下,平衡时  ,则p(H2)=
,则p(H2)= ___________ kPa 。
(3)在密闭容器中,保持投料比不变,将 和
和 按一定流速通过反应器,一段时间后,测得
按一定流速通过反应器,一段时间后,测得  转化率
转化率 和甲醇选择性
和甲醇选择性 随温度
随温度 变化关系如上图2所示。
变化关系如上图2所示。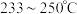 催化剂的活性受温度影响不大,则
催化剂的活性受温度影响不大,则 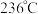 图中曲线下降的原因是
图中曲线下降的原因是___________ ;
②若气体流速过大, 的转化率会降低,原因是
的转化率会降低,原因是___________ 。
(4)向恒温恒压的两个密闭容器甲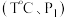 、乙
、乙 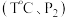 中,分别充入物质的量均为
中,分别充入物质的量均为 的
的  和
和  ,若只发生反应
,若只发生反应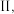 其正反应速率
其正反应速率  为气体分压。若甲、乙容器平衡时正反应速率之比
为气体分压。若甲、乙容器平衡时正反应速率之比 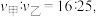 则甲、乙容器的体积之比为
则甲、乙容器的体积之比为___________ 。
 为原料合成
为原料合成  的反应是研究热点之一,该反应体系涉及的反应如下:
的反应是研究热点之一,该反应体系涉及的反应如下:I.
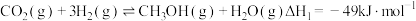
II.
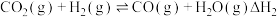
回答下列问题:
(1)已知
 和101kPa下,
和101kPa下, 的燃烧热分别为
的燃烧热分别为  、
、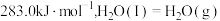
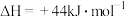 ,则∆H2=
,则∆H2=(2)在恒压密闭容器中,按照
 投料进行反应,反应I、
投料进行反应,反应I、 以物质的分压表示的平衡常数
以物质的分压表示的平衡常数 随温度
随温度  的变化关系如下图1所示(体系总压为
的变化关系如下图1所示(体系总压为  )。
)。
 对应图1中
对应图1中 ” 或“
” 或“ ”);
”);  点对应温度下体系达到平衡时
点对应温度下体系达到平衡时  的转化率为
的转化率为  ,反应I的Kp=
,反应I的Kp=②通过调整温度可调控平衡时
 的值。
的值。 点对应温度下,平衡时
点对应温度下,平衡时  ,则p(H2)=
,则p(H2)= (3)在密闭容器中,保持投料比不变,将
 和
和 按一定流速通过反应器,一段时间后,测得
按一定流速通过反应器,一段时间后,测得  转化率
转化率 和甲醇选择性
和甲醇选择性 随温度
随温度 变化关系如上图2所示。
变化关系如上图2所示。
 催化剂的活性受温度影响不大,则
催化剂的活性受温度影响不大,则  图中曲线下降的原因是
图中曲线下降的原因是②若气体流速过大,
 的转化率会降低,原因是
的转化率会降低,原因是(4)向恒温恒压的两个密闭容器甲
 、乙
、乙 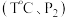 中,分别充入物质的量均为
中,分别充入物质的量均为 的
的  和
和  ,若只发生反应
,若只发生反应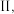 其正反应速率
其正反应速率  为气体分压。若甲、乙容器平衡时正反应速率之比
为气体分压。若甲、乙容器平衡时正反应速率之比 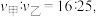 则甲、乙容器的体积之比为
则甲、乙容器的体积之比为
您最近一年使用:0次



