1 . 已知反应:
(1)CH4(g)+2O2(g)=CO2(g)+2H2O(l) ∆H1=−akJ/mol
(2)CH4(g)+2O2(g)=CO2(g)+2H2O(g) ∆H2=−bkJ/mol。
其他数据如表:
下列说法正确的是
(1)CH4(g)+2O2(g)=CO2(g)+2H2O(l) ∆H1=−akJ/mol
(2)CH4(g)+2O2(g)=CO2(g)+2H2O(g) ∆H2=−bkJ/mol。
其他数据如表:
| 化学键 | C=O | O=O | C‒H | O‒H |
| 键能/(kJ•mol‒1) | 798 | x | 413 | 463 |
| A.∆H1>∆H2 | B.H2O(g)=H2O(l)的∆S<0,∆H=(b−a)kJ/mol |
| C.甲烷燃烧热为-akJ/mol | D.上表中x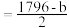 |
您最近一年使用:0次
名校
解题方法
2 . 甲醇是重要工业原料。煤化工可利用煤炭制取水煤气从而合成甲醇:CO(g)+2H2(g)⇌CH3OH(g)。
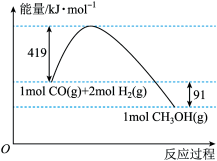
(1)常压下反应的能量变化如图所示。此反应的逆活化能为_______ ,在_______ (填“高温”或“低温”)情况下有利于CO和H2制备甲醇的反应自发进行。
(2)实验测得16g甲醇CH3OH(l)在氧气中充分燃烧生成二氧化碳气体和液态水时释放出363.25kJ的热量,试写出表示甲醇燃烧热的热化学方程式:_______ 。
(3)某兴趣小组同学利用甲醇燃料电池探究电浮选法处理污水的一种方式:保持污水的pH在5.0~6.0之间,通过电解生成Fe(OH)3胶体。Fe(OH)3胶体具有吸附性,可吸附污物而沉积下来,具有净化水的作用。装置如图所示。
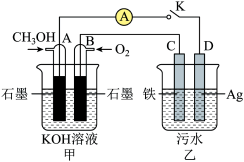
①甲池中A极电极反应式:_______ ;工作一段时间后,甲池的pH_______ (填“变大”、“变小”或“不变”)。
②甲醇中原子半径最大的元素同主族的下一周期元素的电子排布式_______ ;若乙池实验时污水中离子浓度较小,导电能力较差,净水效果不好,此时应向污水中加入适量的_______ 。
A.H2SO4 B.BaSO4 C.Na2SO4 D.NaOH E.CH3CH2OH
(4)在碱性锌电池中,用高铁酸钾作为正极材料,电池反应为:2K2FeO4+3Zn=Fe2O3+ZnO+2K2ZnO2该电池正极发生反应的电极反应式为_______ 。
(1)常压下反应的能量变化如图所示。此反应的逆活化能为

(2)实验测得16g甲醇CH3OH(l)在氧气中充分燃烧生成二氧化碳气体和液态水时释放出363.25kJ的热量,试写出表示甲醇燃烧热的热化学方程式:
(3)某兴趣小组同学利用甲醇燃料电池探究电浮选法处理污水的一种方式:保持污水的pH在5.0~6.0之间,通过电解生成Fe(OH)3胶体。Fe(OH)3胶体具有吸附性,可吸附污物而沉积下来,具有净化水的作用。装置如图所示。

①甲池中A极电极反应式:
②甲醇中原子半径最大的元素同主族的下一周期元素的电子排布式
A.H2SO4 B.BaSO4 C.Na2SO4 D.NaOH E.CH3CH2OH
(4)在碱性锌电池中,用高铁酸钾作为正极材料,电池反应为:2K2FeO4+3Zn=Fe2O3+ZnO+2K2ZnO2该电池正极发生反应的电极反应式为
您最近一年使用:0次
名校
解题方法
3 . 下列有关热化学方程式书写及对应表述均正确的是
| A.H2(g)+F2(g)=2HF(g) ΔH=-270kJ⋅mol-1,则相同条件下,2molHF(g)的能量大于1molH2(g)和1molF2(g)的能量之和 |
| B.若H+(aq)+OH_(aq)=H2O(l) ΔH=-57.3kJ/mol,则H2SO4(aq)+Ba(OH)2(aq)=BaSO4(s)+2H2O(l) ΔH=-57.3kJ/mol |
| C.I2(g)+H2(g)=2HI(g) ΔH=-9.48kJ⋅mol-1,H2和I2蒸气反应生成2molHI气体放出热量9.48kJ |
D.若S(s)+O2(g)=SO2(g) ΔH1;2SO2(g)+O2(g)⇌2SO3(g) ΔH2,硫的燃烧热为ΔH1+ ΔH2 ΔH2 |
您最近一年使用:0次
4 . 已知反应:
①CH4(g)+2O2(g)=CO2(g)+2H2O(l)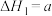 kJ·mol–1
kJ·mol–1
②CH4(g)+2O2(g)=CO2(g)+2H2O(g)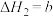 kJ·mol–1
kJ·mol–1
(键能是指气态分子中1mol化学键解离成气态原子所吸收的能量)。下列说法正确的是
①CH4(g)+2O2(g)=CO2(g)+2H2O(l)
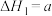 kJ·mol–1
kJ·mol–1②CH4(g)+2O2(g)=CO2(g)+2H2O(g)
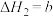 kJ·mol–1
kJ·mol–1| 化学键 | C=O | O=O | C—H | O—H |
| 键能/(kJ·mol–1) | 798 | x | 413 | 463 |
A.上表中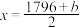 |
| B.a>b |
| C.CH4和O2的能量之和高于CO2和H2O的能量之和 |
D.甲烷燃烧热 bkJ·mol-1 bkJ·mol-1 |
您最近一年使用:0次
名校
解题方法
5 . 下列说法正确的是
A.甲烷的摩尔燃烧焓为 =-890.3kJ/mol,则甲烷燃烧的热化学方程式可表示为:CH4(g)+2O2(g)=CO2(g)+2H2O(g) =-890.3kJ/mol,则甲烷燃烧的热化学方程式可表示为:CH4(g)+2O2(g)=CO2(g)+2H2O(g)  = -890.3kJ/mol = -890.3kJ/mol |
B.500℃、30MPa下,将0.5molN2(g)和1.5molH2(g)置于密闭容器中充分反应生成NH3(g),放热19.3kJ,其热化学方程式为N2(g)+3H2(g) 2NH3(g) 2NH3(g)  = -38.6kJ/mol = -38.6kJ/mol |
| C.中和反应的反应热实验中将环形玻璃搅拌棒改为铁质搅拌器对实验结果没有影响 |
D.已知C(s)+O2(g)=CO2(g)  = - a kJ/mol,C(s)+ = - a kJ/mol,C(s)+ O2(g)=CO(g) O2(g)=CO(g)  = - b kJ/mol,则a>b = - b kJ/mol,则a>b |
您最近一年使用:0次
2022-12-09更新
|
243次组卷
|
2卷引用:2024届重庆市乌江新高考协作体高三下学期模拟预测化学试题
名校
解题方法
6 . 已知:①2H2(g)+O2(g)=2H2O(g) ΔH=-483.6 kJ·mol-1
②H2(g)+S(g)=H2S(g) ΔH=-20.1 kJ·mol-1,下列判断正确的是
②H2(g)+S(g)=H2S(g) ΔH=-20.1 kJ·mol-1,下列判断正确的是
| A.若反应②中改用固态硫,则1 mol S(s)完全反应放出的热量大于20.1 kJ |
| B.①反应的正反应活化能大于逆反应活化能 |
| C.由①②知,稳定性:H2O>H2S |
| D.氢气的燃烧热为241.8 kJ·mol-1 |
您最近一年使用:0次
2022-12-09更新
|
186次组卷
|
2卷引用:重庆市杨家坪中学2022-2023学年高二上学期1月期末考试化学试题
名校
7 . 下列说法正确的是
| A.等量的硫蒸气和硫固体分别完全燃烧,前者放出热量多 |
B.甲烷的燃烧热为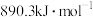 ,则甲烷燃烧的热化学方程式可表示为: ,则甲烷燃烧的热化学方程式可表示为: |
| C.在一个确定的化学反应关系中,反应物的总能量与生成物的总能量可能相同 |
D.已知热化学方程式: ,在容器中充入 ,在容器中充入 和 和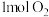 充分反应,最终放出的热量为 充分反应,最终放出的热量为 |
您最近一年使用:0次
2022-12-07更新
|
119次组卷
|
2卷引用:重庆市渝东六校共同体2022-2023学年高二上学期联合诊断考试化学试题
8 . 乙烯( )是石油化工产业的核心,作为一种可燃物,乙烯有着热值高、产物清洁的优势。在25℃、
)是石油化工产业的核心,作为一种可燃物,乙烯有着热值高、产物清洁的优势。在25℃、 的条件下,乙烯的燃烧热为
的条件下,乙烯的燃烧热为 。
。
已知:①部分化学键的键能如下表所示
②3.6g水蒸气液化会放出8kJ热量,则x的值为
 )是石油化工产业的核心,作为一种可燃物,乙烯有着热值高、产物清洁的优势。在25℃、
)是石油化工产业的核心,作为一种可燃物,乙烯有着热值高、产物清洁的优势。在25℃、 的条件下,乙烯的燃烧热为
的条件下,乙烯的燃烧热为 。
。已知:①部分化学键的键能如下表所示
| 化学键 | C=C | C-H | O=O | C=O | H-O |
键能 | 612 | 414 | 498 | x | 464 |
| A.809 | B.1041 | C.676 | D.829 |
您最近一年使用:0次
2022-12-03更新
|
366次组卷
|
2卷引用:重庆市2023届高三上学期第四次质量检测化学试题
名校
解题方法
9 . 下列说法中正确的是
A.HCl和NaOH的稀溶液反应生成1mol  (l)的反应热 (l)的反应热 ,则 ,则 和 和 的稀溶液反应生成1mol 的稀溶液反应生成1mol  (1)的反应热 (1)的反应热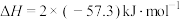 |
B.甲烷的燃烧热 ,则 ,则 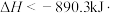  |
C.CO(g)的燃烧热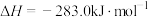 ,则 ,则 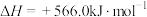 |
D.已知:500℃、30MPa下,  ,将1.5mol ,将1.5mol  和过量的 和过量的 在此条件下充分反应,放出热量46.2kJ 在此条件下充分反应,放出热量46.2kJ |
您最近一年使用:0次
2022-12-02更新
|
353次组卷
|
5卷引用:重庆市万州第二高级中学2021-2022学高二下学期入学考试化学试题
名校
解题方法
10 . 下列热化学方程式中ΔH代表燃烧热的是
| A.CH4(g)+3/2O2(g)=2H2O(l)+CO(g) ΔH1 |
| B.S(s)+3/2O2(g)=SO3(g) ΔH2 |
| C.C6H12O6(s)+6O2(g)=6CO2(g)+6H2O(l) ΔH3 |
| D.2CO(g)+O2(g)=2CO2(g) ΔH4 |
您最近一年使用:0次
2022-12-02更新
|
437次组卷
|
62卷引用:重庆市长寿中学校2021-2022学年高二10月月考化学试题
重庆市长寿中学校2021-2022学年高二10月月考化学试题(已下线)2010—2011学年内蒙古赤峰二中高一下学期期末考试化学试卷(已下线)河北省冀州中学10-11学年高一下学期期末考试(化学理)B卷(已下线)2011-2012年山东省莒南县三中高二上学期期中考试化学试卷(已下线)2011-2012学年黑龙江龙东地区高二第一学期高中教学联合体期末考试化学试卷(已下线)2011-2012学年湖南省蓝山二中高二上学期期末考试化学试卷(已下线)2011-2012学年江西上饶中学高一重点班下期末考试化学试卷2014-2015学年云南省富民县一中高二上学期期中化学试卷2014-2015学年云南省蒙自市蒙自一中高二上学期期中化学试卷2014-2015河北邢台一中高一3月月考化学试卷2015-2016学年广东省仲元中学高二上期中测试化学试卷2015-2016学年贵州省凯里一中高二上学期期末化学试卷2015-2016学年云南省开远四中高二下学期期中化学试卷2016-2017学年河北冀州中学高二上第一次月考化学试卷2016-2017学年黑龙江省大庆市杜蒙县高二上月考一化学卷2016-2017学年河北省张家口市第一中学高一3月月考(理)化学试卷【全国百强校】江苏省南菁高级中学2017-2018学年高二下学期期中考试化学试题【全国百强校】黑龙江省哈尔滨市第六中学2018-2019学年高二上学期10月月考化学试题新疆维吾尔自治区兵团第二师华山中学2018-2019学年高二上学期第一次调研考试化学试题山西省阳泉二中2018-2019学年高二上学期期中考试化学试题辽宁省普兰店市第一中学2018-2019学年高二(理)上学期期中考试化学试题云南省玉溪市元江县第一中学2018-2019学年高二下学期开学考试化学试题安徽省六安市二中2018-2019学年高二第一学期10月月考化学试题湖南省邵东县创新实验学校2019-2020学年高二上学期期中考试化学(理)试题辽宁省葫芦岛市第八高级中学2019-2020学年高二上学期期中考试化学试题福建2020届高三化学总复习专题训练——选修四化学反应原理测试2020届高三化学二轮复习———燃烧热的综合2020年春季人教版高中化学选修4第一章《化学反应与能量》测试卷【懂做原理题】2020届高三化学选修4二轮专题练——燃烧热【选择精编25题】2020届高三化学二轮复习—— 化学能与热能【精编选择25题】内蒙古包头市第六中学2019-2020学年高二上学期期中考试化学试题云南省曲靖市罗平县第三中学2020届高二下学期开学考试化学试题人教版(2019)高二选择性必修第一册 第一章 化学反应的热效应 第一节 反应热2湖南省宁乡县第七中学2020-2021学年高二10月月考化学试题吉林省榆树市第一高级中学2020-2021学年高二上学期期中考试化学试题天津市静海瀛海学校2020-2021学年高二上学期11月联考化学试题河南省新乡市长垣县第十中学2020-2021学年高二上学期期中考试化学试题广西南宁市第四中学2020-2021学年高二下学期开学考试化学试题河北省石家庄市第二十三中学2020-2021学年高一第二学期5月月考化学试题青海省海南州贵德高级中学2020-2021学年高二下学期期中化学试题安徽省淮北市树人高级中学2020-2021学年高一下学期第四次阶段考试化学试题(已下线)第二节 燃烧热 能源(备作业)-【上好课】2021-2022学年高二化学同步备课系列(人教版选修4)河南省南阳市第五完全中学2020-2021学年高二上学期开学考试化学试题青海省西宁市北外附属新华联国际学校2021-2022学年高二上学期第一次月考化学(理)试题山西省太原市第五十六中学2021-2022学年高二上学期10月月考化学试题(已下线)第1章基础巩固测评卷-【帮课堂】2022-2023学年高二化学同步精品讲义(沪科版2020选择性必修第一册)(已下线)1.3 燃料的合理利用-【帮课堂】2022-2023学年高二化学同步精品讲义(沪科版2020选择性必修第一册)(已下线)1.3 燃料的合理利用-【帮课堂】2022-2023学年高二化学同步精品讲义(沪科版2020选择性必修第一册)(已下线)第24练 反应热-2023年高考化学一轮复习小题多维练(全国通用)(已下线)第02讲 热化学方程式与燃烧热(word讲义)-【帮课堂】2022-2023学年高二化学同步精品讲义(人教2019选择性必修1)宁夏永宁县永宁中学2021-2022学年高二上学期期中考试化学试题天津市第九十五中学益中学校2022-2023学年高二上学期期中考试化学试题新疆巴音郭楞蒙古自治州第一中学2022-2023学年高三上学期期中化学试卷山西省太原市第五十六中学2022-2023学年高二上学期10月联考化学试题陕西省西安市周至县第四中学2021-2022学年高二上学期期中考试化学(理科)试题广东省连平县忠信中学2020-2021学年高二下学期第二次段考化学试题云南昆明市昆明行知中学2021-2022学年高二上学期期中考试化学试题新疆乌鲁木齐市第八中学2022-2023学年高二上学期期末考试化学试题6.2.2燃料燃烧释放的能量(课后)-2019苏教版必修2课前课中课后甘肃省天水市秦安县第一中学2022-2023学年高二上学期期末考试化学试题新疆喀什市2023-2024学年高二上学期期中考试化学试题新疆兵团第三师图木舒克市鸿德实验学校2023-2024学年高二上学期第一次月考化学试题



