解题方法
1 . 消除氮氧化物(主要为 和
和 )是治理空气污染的主要任务。
)是治理空气污染的主要任务。
(1)甲烷还原法可在催化剂作用下消除氮氧化物污染,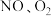 和
和 的混合物反应体系主要发生如下反应:
的混合物反应体系主要发生如下反应:
 ①
①
 ②
②
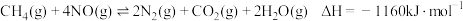 ③
③
则反应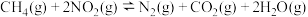 的
的
___________ 。
(2)利用电化学装置可消除氮氧化物污染,变废为宝。

①图Ⅰ装置实现的能量转化形式是___________ 。相同条件下,放电过程中消耗的 和
和 的体积比为
的体积比为___________ 。石墨Ⅱ电极上发生的电极反应为___________ 。
②图Ⅱ为电解 制备
制备 的装置。该装置中阳极的电极反应式为
的装置。该装置中阳极的电极反应式为___________ 。为使电解产物全部转化为 ,需补充物质A,物质A的化学式为
,需补充物质A,物质A的化学式为___________ 。
 和
和 )是治理空气污染的主要任务。
)是治理空气污染的主要任务。(1)甲烷还原法可在催化剂作用下消除氮氧化物污染,
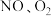 和
和 的混合物反应体系主要发生如下反应:
的混合物反应体系主要发生如下反应: ①
① ②
②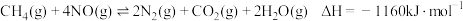 ③
③则反应
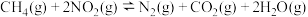 的
的
(2)利用电化学装置可消除氮氧化物污染,变废为宝。

①图Ⅰ装置实现的能量转化形式是
 和
和 的体积比为
的体积比为②图Ⅱ为电解
 制备
制备 的装置。该装置中阳极的电极反应式为
的装置。该装置中阳极的电极反应式为 ,需补充物质A,物质A的化学式为
,需补充物质A,物质A的化学式为
您最近一年使用:0次
2 . 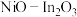 可协同催化
可协同催化 的氢化,体系中涉及以下两个反应:
的氢化,体系中涉及以下两个反应:
反应1:
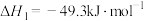
反应2:

将一定比例的 、
、 以一定流速通过催化剂,在一定温度下反应,
以一定流速通过催化剂,在一定温度下反应, 的转化率、
的转化率、 或CO的选择性[
或CO的选择性[ ]与催化剂中NiO的质量分数的关系如图所示。下列说法正确的是
]与催化剂中NiO的质量分数的关系如图所示。下列说法正确的是
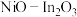 可协同催化
可协同催化 的氢化,体系中涉及以下两个反应:
的氢化,体系中涉及以下两个反应:反应1:

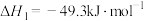
反应2:


将一定比例的
 、
、 以一定流速通过催化剂,在一定温度下反应,
以一定流速通过催化剂,在一定温度下反应, 的转化率、
的转化率、 或CO的选择性[
或CO的选择性[ ]与催化剂中NiO的质量分数的关系如图所示。下列说法正确的是
]与催化剂中NiO的质量分数的关系如图所示。下列说法正确的是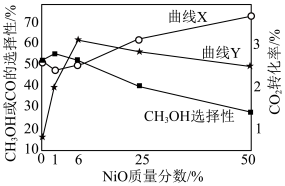
A.反应 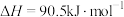 |
B.曲线Y表示 的转化率随催化剂中NiO的质量分数的变化 的转化率随催化剂中NiO的质量分数的变化 |
C.其他条件不变,催化剂中NiO的质量分数为1%时, 的产率最高 的产率最高 |
D.其他条件不变,NiO的质量分数从25%增加到50%, 的平衡选择性降低 的平衡选择性降低 |
您最近一年使用:0次
2023-11-13更新
|
680次组卷
|
5卷引用:江苏省苏州市2023-2024学年高三上学期11月期中考试化学试题
江苏省苏州市2023-2024学年高三上学期11月期中考试化学试题江苏省苏州市2023~2024学年高三上学期期中调研化学试题(已下线)选择题11-14(已下线)题型04 化学反应速率与平衡图像分析-2024年高考化学答题技巧与模板构建(已下线)FHgkyldyjhx10
3 . 二十大报告提出推动绿色发展,促进人与自然和谐共生。绿色能源是实施可持续发展的重要途径,利用生物乙醇来制取氢气的部分反应过程如图所示:

(1)已知:
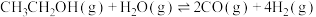
 kJ·mol
kJ·mol

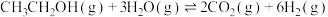
 kJ·mol
kJ·mol
请写出反应Ⅱ的热化学方程式:___________ 。
(2)反应Ⅱ,在进气比[
 ]不同时,测得相应的CO平衡转化率如图(各点对应的反应温度可能相同,也可能不同,其他反应条件都相同)。
]不同时,测得相应的CO平衡转化率如图(各点对应的反应温度可能相同,也可能不同,其他反应条件都相同)。

①求算F点的平衡常数KF=___________ 。
②比较D、E两点对应的反应速率大小:v(D)___________ v(E)(填“<”“=”或“>”)。
③在G点温度下,要提高CO平衡转化率,应采取的措施有___________ 。(写两点)
(3)以铅蓄电池(
 )为电源可将
)为电源可将
 转化为乙醇,其原理如图所示,电解所用电极材料均为惰性电极。
转化为乙醇,其原理如图所示,电解所用电极材料均为惰性电极。

①写出铅蓄电池正极的电极反应式___________ 。
②写出电解池阴极上的电极反应式___________ ;每生成1.25 mol乙醇,理论上铅蓄电池中需消耗___________ mol硫酸。

(1)已知:
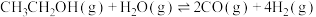
 kJ·mol
kJ·mol
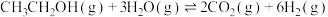
 kJ·mol
kJ·mol
请写出反应Ⅱ的热化学方程式:
(2)反应Ⅱ,在进气比[
 ]不同时,测得相应的CO平衡转化率如图(各点对应的反应温度可能相同,也可能不同,其他反应条件都相同)。
]不同时,测得相应的CO平衡转化率如图(各点对应的反应温度可能相同,也可能不同,其他反应条件都相同)。
①求算F点的平衡常数KF=
②比较D、E两点对应的反应速率大小:v(D)
③在G点温度下,要提高CO平衡转化率,应采取的措施有
(3)以铅蓄电池(
 )为电源可将
)为电源可将 转化为乙醇,其原理如图所示,电解所用电极材料均为惰性电极。
转化为乙醇,其原理如图所示,电解所用电极材料均为惰性电极。
①写出铅蓄电池正极的电极反应式
②写出电解池阴极上的电极反应式
您最近一年使用:0次
4 . 在有氧条件下,使用催化剂能催化NH3与NO反应生成N2。将一定比例的O2、NH3和NO的混合气体,匀速通入装有催化剂M的反应器中发生反应:4NH3(g)+2O2(g)+2NO (g)  3N2(g)+6H2O(g)。
3N2(g)+6H2O(g)。
(1)已知:N2(g) + O2(g) 2NO(g) ΔH1=a kJ/mol
2NO(g) ΔH1=a kJ/mol
4NH3(g)+5O2(g) 4NO(g)+6H2O(g) ΔH2= b kJ/mol
4NO(g)+6H2O(g) ΔH2= b kJ/mol
则反应4NH3(g)+2O2(g)+2NO (g) 3N2(g)+6H2O(g) ΔH=
3N2(g)+6H2O(g) ΔH=___________ kJ/mol。
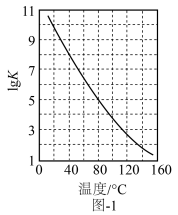
(2)该反应化学平衡常数(K)与温度的关系如图-1所示,该反应ΔH___________ 0(选填“>”或“<”)。
(3)相同时间内测得NO与N2的生成速率随温度变化的关系如题图-2所示。其它条件相同时,在不同催化剂作用下,NH3转化率与温度关系如图-3所示。
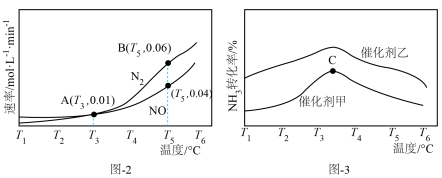
①图-2、图-3中的A、B、C三点对应的反应状态中,达到平衡状态的是___________ (填字母)。
②相同温度下,催化剂___________ (填“甲”或“乙”)活性更高。
(4)某温度下,该反应平衡常数K=1000,该温度下,某时刻测得c(NH3)=0.8 mol/L、c(O2)=0.4 mol/L、c(NO)=0.4 mol/L、c(N2)=2.5 mol/L、c(H2O)=5.0 mol/L,则此时v(正)___________ (填“>”“<”或“=”)v(逆)。
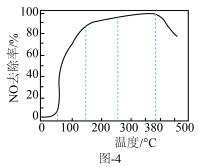
(5)反应相同时间NO的去除率随反应温度的变化曲线如图−4所示,在50~250 ℃范围内随着温度的升高,NO的去除率先迅速上升后上升缓慢的主要原因是___________ ;当反应温度高于380 ℃时,NO的去除率迅速下降的原因可能是___________ 。
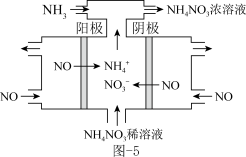
(6)工业上也可用电解法去除NO同时获得NH4NO3,其工作原理如图−5所示,该阳极发生的电极反应式为___________ 。
 3N2(g)+6H2O(g)。
3N2(g)+6H2O(g)。(1)已知:N2(g) + O2(g)
 2NO(g) ΔH1=a kJ/mol
2NO(g) ΔH1=a kJ/mol4NH3(g)+5O2(g)
 4NO(g)+6H2O(g) ΔH2= b kJ/mol
4NO(g)+6H2O(g) ΔH2= b kJ/mol则反应4NH3(g)+2O2(g)+2NO (g)
 3N2(g)+6H2O(g) ΔH=
3N2(g)+6H2O(g) ΔH=(2)该反应化学平衡常数(K)与温度的关系如图-1所示,该反应ΔH

(3)相同时间内测得NO与N2的生成速率随温度变化的关系如题图-2所示。其它条件相同时,在不同催化剂作用下,NH3转化率与温度关系如图-3所示。

①图-2、图-3中的A、B、C三点对应的反应状态中,达到平衡状态的是
②相同温度下,催化剂
(4)某温度下,该反应平衡常数K=1000,该温度下,某时刻测得c(NH3)=0.8 mol/L、c(O2)=0.4 mol/L、c(NO)=0.4 mol/L、c(N2)=2.5 mol/L、c(H2O)=5.0 mol/L,则此时v(正)
(5)反应相同时间NO的去除率随反应温度的变化曲线如图−4所示,在50~250 ℃范围内随着温度的升高,NO的去除率先迅速上升后上升缓慢的主要原因是

(6)工业上也可用电解法去除NO同时获得NH4NO3,其工作原理如图−5所示,该阳极发生的电极反应式为

您最近一年使用:0次
解题方法
5 . 国家主席习近平在9月22日召开的联合国大会上表示:“中国将争取在2060年前实现碳中和”。捕集CO2的技术对解决全球温室效应意义重大。回答下列问题:
(1)国际空间站处理CO2的一个重要方法是将CO2还原,所涉及的反应方程式为:CO2(g)+4H2(g)=CH4(g)+2H2O(g) ΔH=-270kJ·mol-1。几种化学键的键能如表所示:
则a=___________ 。
(2)将CO2还原为CH4,是实现CO2资源化利用的有效途径之一,装置如图所示:
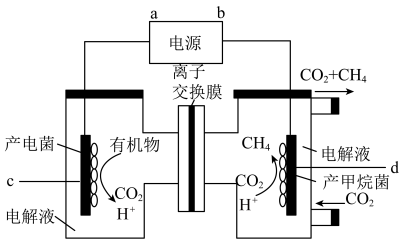
①H+的移动方向为___________ (填“自左至右”或“自右至左”);d电极的电极反应式为___________ 。
②若电源为CH3OH O2
O2 KOH清洁燃料电池,当消耗0.1molCH3OH燃料时,离子交换膜中通过
KOH清洁燃料电池,当消耗0.1molCH3OH燃料时,离子交换膜中通过___________ molH+,该清洁燃料电池中的正极反应式为___________ 。
(3)甲醇是一种可再生能源,由CO2制备甲醇的过程可能涉及的反应如下:
反应I:CO2(g)+3H2(g)=CH3OH(g)+H2O(g) ΔH1=-49.58kJ·mol-1
反应II:CO2(g)+H2(g)=CO(g)+H2O(g) ΔH2
反应III:CO(g)+2H2(g)=CH3OH(g) ΔH3=-90.77kJ·mol-1
反应II的ΔH2=___________ kJ·mol-1。
(4)利用太阳能光解Fe3O4,制备的FeO用于还原CO2合成炭黑,可实现资源的再利用。其转化关系如图2所示。过程II反应的化学方程式是___________ 。

(5)在酸性电解质溶液中,以太阳能电池作电源,惰性材料作电极,可将CO2转化为乙烯。实验装置如图所示。

①若电解过程中生成3.36L(标准状况下)O2,则电路中转移的电子至少为___________ mol。
②生成乙烯的电极反应式是___________ 。
(1)国际空间站处理CO2的一个重要方法是将CO2还原,所涉及的反应方程式为:CO2(g)+4H2(g)=CH4(g)+2H2O(g) ΔH=-270kJ·mol-1。几种化学键的键能如表所示:
| 化学键 | C H H | H H H | H O O | C O O |
| 键能/kJ·mol-1 | 413 | 436 | a | 745 |
(2)将CO2还原为CH4,是实现CO2资源化利用的有效途径之一,装置如图所示:

①H+的移动方向为
②若电源为CH3OH
 O2
O2 KOH清洁燃料电池,当消耗0.1molCH3OH燃料时,离子交换膜中通过
KOH清洁燃料电池,当消耗0.1molCH3OH燃料时,离子交换膜中通过(3)甲醇是一种可再生能源,由CO2制备甲醇的过程可能涉及的反应如下:
反应I:CO2(g)+3H2(g)=CH3OH(g)+H2O(g) ΔH1=-49.58kJ·mol-1
反应II:CO2(g)+H2(g)=CO(g)+H2O(g) ΔH2
反应III:CO(g)+2H2(g)=CH3OH(g) ΔH3=-90.77kJ·mol-1
反应II的ΔH2=
(4)利用太阳能光解Fe3O4,制备的FeO用于还原CO2合成炭黑,可实现资源的再利用。其转化关系如图2所示。过程II反应的化学方程式是

(5)在酸性电解质溶液中,以太阳能电池作电源,惰性材料作电极,可将CO2转化为乙烯。实验装置如图所示。

①若电解过程中生成3.36L(标准状况下)O2,则电路中转移的电子至少为
②生成乙烯的电极反应式是
您最近一年使用:0次
6 . 工业上,以煤炭为原料,通入一定比例的空气和水蒸气,经过系列反应可以得到满足不同需求的原料气。
(1)在C和 的反应体系中:
的反应体系中:
反应1:

反应2:

反应3:

则
___________ 。
(2)水煤气反应:
 。工业生产水煤气时,通常
。工业生产水煤气时,通常交替通入 合适量的空气和水蒸气与煤炭反应,其原因是___________ 。
(3)一氧化碳变换反应:
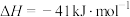 。已知:平衡体系中各组分的平衡压强,即组分的物质的量分数×总压,如CO的平衡压强:
。已知:平衡体系中各组分的平衡压强,即组分的物质的量分数×总压,如CO的平衡压强: 。
。
①一定温度下,反应后测得各组分的平衡压强: 、
、 、
、 和
和 ,则反应的平衡常数K的数值为
,则反应的平衡常数K的数值为___________ 。
②维持与题①相同的温度和总压,提高水蒸气的比例,使CO的平衡转化率提高到90%,则原料气中水蒸气和CO的物质的量之比为___________ 。
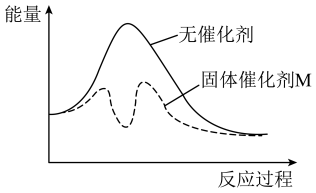
③以固体催化剂M催化变换反应,若水蒸气首先被催化剂的活性表面吸附而解离,生成中间体MO,能量变化如图所示。用化学方程式表示该催化反应的历程(反应机理):___________ 。
(1)在C和
 的反应体系中:
的反应体系中:反应1:


反应2:


反应3:


则

(2)水煤气反应:

 。工业生产水煤气时,通常
。工业生产水煤气时,通常(3)一氧化碳变换反应:

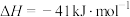 。已知:平衡体系中各组分的平衡压强,即组分的物质的量分数×总压,如CO的平衡压强:
。已知:平衡体系中各组分的平衡压强,即组分的物质的量分数×总压,如CO的平衡压强: 。
。①一定温度下,反应后测得各组分的平衡压强:
 、
、 、
、 和
和 ,则反应的平衡常数K的数值为
,则反应的平衡常数K的数值为②维持与题①相同的温度和总压,提高水蒸气的比例,使CO的平衡转化率提高到90%,则原料气中水蒸气和CO的物质的量之比为
③以固体催化剂M催化变换反应,若水蒸气首先被催化剂的活性表面吸附而解离,生成中间体MO,能量变化如图所示。用化学方程式表示该催化反应的历程(反应机理):

您最近一年使用:0次
7 . 完成下列填空
Ⅰ.二甲醚( )是一种极具发展潜力的有机化工产品和洁净燃料。由合成气制备二甲醚的主要反应原理如下:
)是一种极具发展潜力的有机化工产品和洁净燃料。由合成气制备二甲醚的主要反应原理如下:
①

②

③

(1)反应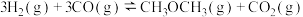 的
的
_________  ;若①②③平衡常数分别为
;若①②③平衡常数分别为 、
、 、
、 ,该反应的平衡常数K=
,该反应的平衡常数K=________ (用含 、
、 、
、 公式表示)。
公式表示)。
Ⅱ.600℃时,将0.6molCO和0.24mol 通入2L恒容密闭容器中,发生反应
通入2L恒容密闭容器中,发生反应 ,5min后达到化学平衡状态,平衡后测得氢气的浓度为
,5min后达到化学平衡状态,平衡后测得氢气的浓度为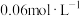 。
。
(2)则0~5min内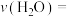
___________ ,该反应的平衡常数K=___________ 。
Ⅲ.甲醇( )广泛用作燃料电池的燃料,工业上可由CO和
)广泛用作燃料电池的燃料,工业上可由CO和 来合成,化学方程式为
来合成,化学方程式为 。
。
(3)图甲是在不同温度下CO的转化率随时间变化的曲线。该反应的
______ 0(填“>”、“<”或“=”)。

(4)一定温度下恒容容器中,分别研究在 、
、 、
、 三种压强下合成甲醇的规律。如图乙是上述三种压强下
三种压强下合成甲醇的规律。如图乙是上述三种压强下 和CO的起始组成比
和CO的起始组成比 与CO平衡转化率的关系,则
与CO平衡转化率的关系,则 、
、 、
、 的大小关系是
的大小关系是______ 。若此时a、b、c点对应的平衡常数分别为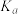 、
、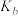 、
、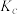 ,
,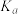 、
、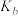 、
、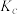 的大小关系为
的大小关系为________ 。
Ⅰ.二甲醚(
 )是一种极具发展潜力的有机化工产品和洁净燃料。由合成气制备二甲醚的主要反应原理如下:
)是一种极具发展潜力的有机化工产品和洁净燃料。由合成气制备二甲醚的主要反应原理如下:①


②


③


(1)反应
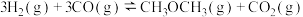 的
的
 ;若①②③平衡常数分别为
;若①②③平衡常数分别为 、
、 、
、 ,该反应的平衡常数K=
,该反应的平衡常数K= 、
、 、
、 公式表示)。
公式表示)。Ⅱ.600℃时,将0.6molCO和0.24mol
 通入2L恒容密闭容器中,发生反应
通入2L恒容密闭容器中,发生反应 ,5min后达到化学平衡状态,平衡后测得氢气的浓度为
,5min后达到化学平衡状态,平衡后测得氢气的浓度为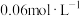 。
。(2)则0~5min内
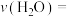
Ⅲ.甲醇(
 )广泛用作燃料电池的燃料,工业上可由CO和
)广泛用作燃料电池的燃料,工业上可由CO和 来合成,化学方程式为
来合成,化学方程式为 。
。(3)图甲是在不同温度下CO的转化率随时间变化的曲线。该反应的


(4)一定温度下恒容容器中,分别研究在
 、
、 、
、 三种压强下合成甲醇的规律。如图乙是上述三种压强下
三种压强下合成甲醇的规律。如图乙是上述三种压强下 和CO的起始组成比
和CO的起始组成比 与CO平衡转化率的关系,则
与CO平衡转化率的关系,则 、
、 、
、 的大小关系是
的大小关系是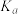 、
、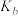 、
、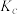 ,
,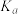 、
、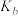 、
、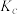 的大小关系为
的大小关系为
您最近一年使用:0次
8 .  催化加氢制甲醇过程中的主要反应有:
催化加氢制甲醇过程中的主要反应有:
反应I:

反应II:

压强分别为 、
、 时,将
时,将 的混合气体置于恒容密闭容器中反应,不同温度下平衡时体系中
的混合气体置于恒容密闭容器中反应,不同温度下平衡时体系中 转化率和
转化率和 (或CO)选择性如图所示,
(或CO)选择性如图所示, (或CO)的选择性可表示为
(或CO)的选择性可表示为 ,下列说法正确的是
,下列说法正确的是

 催化加氢制甲醇过程中的主要反应有:
催化加氢制甲醇过程中的主要反应有:反应I:


反应II:


压强分别为
 、
、 时,将
时,将 的混合气体置于恒容密闭容器中反应,不同温度下平衡时体系中
的混合气体置于恒容密闭容器中反应,不同温度下平衡时体系中 转化率和
转化率和 (或CO)选择性如图所示,
(或CO)选择性如图所示, (或CO)的选择性可表示为
(或CO)的选择性可表示为 ,下列说法正确的是
,下列说法正确的是
| A.曲线①代表的是CO选择性 |
B.反应  |
C.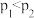 |
| D.其他条件不变,增大压强,CO选择性变小 |
您最近一年使用:0次
9 . 以新型 晶体作催化剂,氧气氧化HCl可获得
晶体作催化剂,氧气氧化HCl可获得 ,对于反应:
,对于反应: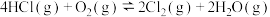
 ,下列说法正确的是
,下列说法正确的是
 晶体作催化剂,氧气氧化HCl可获得
晶体作催化剂,氧气氧化HCl可获得 ,对于反应:
,对于反应: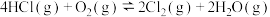
 ,下列说法正确的是
,下列说法正确的是A.反应的平衡常数可表示为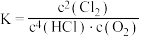 |
B.  , , |
| C.增大压强可以提高体系中活化分子百分数 |
| D.其他条件不变,升温会减小该反应的化学平衡常数 |
您最近一年使用:0次
名校
10 . Ⅰ.我国要在2030年前实现碳达峰、2060年前实现碳中和的目标, 的捕集与转化是研究的重要课题。
的捕集与转化是研究的重要课题。
(1) 和
和 重整可制合成气
重整可制合成气 和
和 ,其热化学方程式为
,其热化学方程式为
已知下列热化学方程式:
反应1:
反应2:
反应3: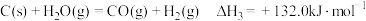
则
___________ 
(2)一种电化学法将 转化为乙烯的原理如图所示,电解所用电极材料均为惰性电极。
转化为乙烯的原理如图所示,电解所用电极材料均为惰性电极。
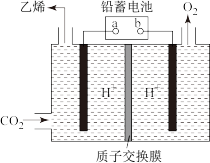
①阴极上的电极反应式为___________ 。
②以铅蓄电池为电源,每生成 乙烯,理论上需消耗铅蓄电池中的硫酸的物质的量为
乙烯,理论上需消耗铅蓄电池中的硫酸的物质的量为___________ 。
Ⅱ.过量含磷物质的排放会致使水体富营养化,因此发展水体除磷技术非常重要。常用的除磷技术有化学沉淀法,吸附法等。
(3)铁炭混合物在水溶液中形成微电池,铁转化为 进一步被氧化为
进一步被氧化为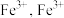 与
与 结合成
结合成 沉淀。铁炭总质量一定,反应时间相同,测得磷去除率随铁炭质量比的变化如图所示。
沉淀。铁炭总质量一定,反应时间相同,测得磷去除率随铁炭质量比的变化如图所示。

①当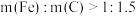 时,随着
时,随着 增加,磷去除率降低,原因是
增加,磷去除率降低,原因是___________ 。
②当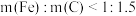 时,随着
时,随着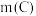 增加,磷去除率也降低。但降低幅度低于
增加,磷去除率也降低。但降低幅度低于 增加时的降低幅度,原因是
增加时的降低幅度,原因是___________ 。
(4)次磷酸根( )具有较强的还原性。利用
)具有较强的还原性。利用 联合除去废水中次磷酸根,转化过程如图所示。
联合除去废水中次磷酸根,转化过程如图所示。

①转化(Ⅰ)除生成 和羟基自由基
和羟基自由基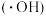 外,还生成一种离子,其化学式为
外,还生成一种离子,其化学式为___________ 。
②利用 联合除去废水中
联合除去废水中 的过程可描述为
的过程可描述为___________ 。
 的捕集与转化是研究的重要课题。
的捕集与转化是研究的重要课题。(1)
 和
和 重整可制合成气
重整可制合成气 和
和 ,其热化学方程式为
,其热化学方程式为
已知下列热化学方程式:
反应1:

反应2:

反应3:
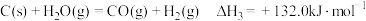
则


(2)一种电化学法将
 转化为乙烯的原理如图所示,电解所用电极材料均为惰性电极。
转化为乙烯的原理如图所示,电解所用电极材料均为惰性电极。
①阴极上的电极反应式为
②以铅蓄电池为电源,每生成
 乙烯,理论上需消耗铅蓄电池中的硫酸的物质的量为
乙烯,理论上需消耗铅蓄电池中的硫酸的物质的量为Ⅱ.过量含磷物质的排放会致使水体富营养化,因此发展水体除磷技术非常重要。常用的除磷技术有化学沉淀法,吸附法等。
(3)铁炭混合物在水溶液中形成微电池,铁转化为
 进一步被氧化为
进一步被氧化为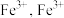 与
与 结合成
结合成 沉淀。铁炭总质量一定,反应时间相同,测得磷去除率随铁炭质量比的变化如图所示。
沉淀。铁炭总质量一定,反应时间相同,测得磷去除率随铁炭质量比的变化如图所示。
①当
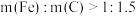 时,随着
时,随着 增加,磷去除率降低,原因是
增加,磷去除率降低,原因是②当
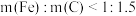 时,随着
时,随着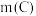 增加,磷去除率也降低。但降低幅度低于
增加,磷去除率也降低。但降低幅度低于 增加时的降低幅度,原因是
增加时的降低幅度,原因是(4)次磷酸根(
 )具有较强的还原性。利用
)具有较强的还原性。利用 联合除去废水中次磷酸根,转化过程如图所示。
联合除去废水中次磷酸根,转化过程如图所示。
①转化(Ⅰ)除生成
 和羟基自由基
和羟基自由基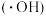 外,还生成一种离子,其化学式为
外,还生成一种离子,其化学式为②利用
 联合除去废水中
联合除去废水中 的过程可描述为
的过程可描述为
您最近一年使用:0次



