名校
解题方法
1 . 氮氧化物对环境有着巨大的危害,一种利用尿素[CO(NH2)2]脱硝的反应原理为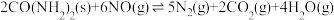 △H<0,回答下列问题:
△H<0,回答下列问题:
(1)T℃时,往2L的恒容密闭容器中加入5molCO(NH2)2(s)和3 mol NO(g),容器内混合气体总物质的量随时间的变化如图所示。
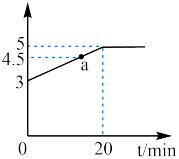
①20min末,容器内N2的物质的量为_______ mol;0~20min内,NO的平均反应速率为_______ mol·L-l·min-l。
②a点时v正_______ (填“>”、“<”或“=”)v逆,此时NO的转化率为_______ %;平衡时与初始时容器内的压强比为_______ 。
(2)向恒温恒容的密闭容器中,加入一定量的CO(NH2)2(s)和NO(g),能够说明该反应达到平衡的是_______(填标号)。
(3)汽车尾气中含有CO和NO等有害气体,三元催化转化器可将汽车尾气中的CO和NO转化为CO2和N2,每生成14gN2,反应放出373kJ热量,该反应的热化学方程式为_______ 。
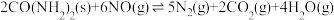 △H<0,回答下列问题:
△H<0,回答下列问题:(1)T℃时,往2L的恒容密闭容器中加入5molCO(NH2)2(s)和3 mol NO(g),容器内混合气体总物质的量随时间的变化如图所示。

①20min末,容器内N2的物质的量为
②a点时v正
(2)向恒温恒容的密闭容器中,加入一定量的CO(NH2)2(s)和NO(g),能够说明该反应达到平衡的是_______(填标号)。
| A.混合气体的密度不再改变 | B.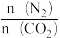 不再改变 不再改变 |
| C.混合气体中,H2O的物质的量分数不再改变 | D.3v正(NO)=v逆(CO2) |
您最近一年使用:0次
2023-08-31更新
|
139次组卷
|
5卷引用:福建省部分名校2023-2024学年高二上学期入学联考化学试题
2 . 氮及其化合物在工农业生产、生活中有着重要作用。合成氨工业中: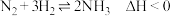 ,其化学平衡常数K与温度t的关系如表:
,其化学平衡常数K与温度t的关系如表:
完成下列填空:
(1)试比较K1、K2的大小,K1___________ K2(填写“>”、“=”或“<”)。
(2)400℃时,反应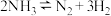 的化学平衡常数的值为
的化学平衡常数的值为___________ 。当测得NH3和N2、H2的物质的量浓度分别为3mol/L和2molL、1mol/L时,则该反应v(N2)(正)___________ v(N2)(逆)(填写“>”、“=”或“<”)。
(3)某温度下,pH=11的氨水和NaOH溶液分别加水稀释100倍,溶液的pH随溶液体积变化的曲线如图所示。根据图像判断下列说法错误的是___________
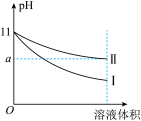
a.a值一定大于9
b.II为氨水稀释时溶液的pH变化曲线
c.稀释后氨水中水的电离程度比NaOH溶液中水的电离程度大
d.完全中和稀释后相同体积的两溶液时,消耗相同浓度的稀硫酸的体积V(NaOH)<V(氨水)
(4)甲醇是一种可再生能源,具有广泛的开发和应用前景。以CO2、H2为原料合成CH3OH涉及的主要反应如下:
I.
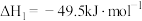
II.
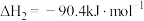
III.

回答下列问题:
①
___________ 
②若体系中只发生反应I,请写出反应I的化学平衡常数表达式,K=___________ ;保持恒温恒容,将反应I的平衡体系中各物质浓度均增大为原来的2倍,则化学平衡___________ (填“正向逆向”或“逆向”或“不”)移动,平衡常数K___________ (填“变大”“变小”或“不变”)。
③常温下,某一元弱酸HA的部分组分平衡浓度如下,
平衡浓度 V (a+b)1/2
计算出一元弱酸HA电离平衡常数Ka=___________ (用含a、b、V的代数式表示计算结果)
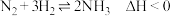 ,其化学平衡常数K与温度t的关系如表:
,其化学平衡常数K与温度t的关系如表:| t/℃ | 200 | 300 | 400 |
| K | K1 | K2 | 0.5 |
(1)试比较K1、K2的大小,K1
(2)400℃时,反应
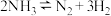 的化学平衡常数的值为
的化学平衡常数的值为(3)某温度下,pH=11的氨水和NaOH溶液分别加水稀释100倍,溶液的pH随溶液体积变化的曲线如图所示。根据图像判断下列说法错误的是

a.a值一定大于9
b.II为氨水稀释时溶液的pH变化曲线
c.稀释后氨水中水的电离程度比NaOH溶液中水的电离程度大
d.完全中和稀释后相同体积的两溶液时,消耗相同浓度的稀硫酸的体积V(NaOH)<V(氨水)
(4)甲醇是一种可再生能源,具有广泛的开发和应用前景。以CO2、H2为原料合成CH3OH涉及的主要反应如下:
I.

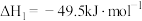
II.

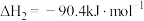
III.


回答下列问题:
①


②若体系中只发生反应I,请写出反应I的化学平衡常数表达式,K=
③常温下,某一元弱酸HA的部分组分平衡浓度如下,
HA⇌A-+H+
平衡浓度 V (a+b)1/2
计算出一元弱酸HA电离平衡常数Ka=
您最近一年使用:0次
解题方法
3 . 通过以下两步反应可实现NH4Cl分解产物的分离。
NH4Cl(s)+MgO(s)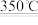 NH3(g)+Mg(OH)Cl(s) ΔH=+61.34kJ·mol-1
NH3(g)+Mg(OH)Cl(s) ΔH=+61.34kJ·mol-1
Mg(OH)Cl(s) HCl(g)+MgO(s) ΔH=+97.50kJ·mol-1
HCl(g)+MgO(s) ΔH=+97.50kJ·mol-1
下列说法不正确的是
NH4Cl(s)+MgO(s)
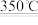 NH3(g)+Mg(OH)Cl(s) ΔH=+61.34kJ·mol-1
NH3(g)+Mg(OH)Cl(s) ΔH=+61.34kJ·mol-1Mg(OH)Cl(s)
 HCl(g)+MgO(s) ΔH=+97.50kJ·mol-1
HCl(g)+MgO(s) ΔH=+97.50kJ·mol-1下列说法不正确的是
| A.反应NH4Cl(s)=NH3(g)+HCl(g)的ΔH=+158.84kJ·mol-1 |
| B.两步反应的ΔS均大于0 |
| C.Mg(OH)Cl是NH4Cl分解反应的催化剂 |
| D.5.35gNH4Cl完全分解理论上可获得标准状况下的HCl约2.24L |
您最近一年使用:0次
4 . 依据图示关系,下列说法不正确的是
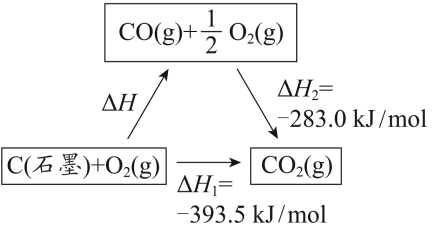

| A.石墨燃烧是放热反应 |
| B.1molC(石墨)和 1molCO 分别在足量 O2中燃烧, 全部转化为 CO2,前者放热多 |
| C.ΔH=ΔH1+ΔH2 |
| D.化学反应的ΔH,只与反应体系的始态和终态有关,与反应途径无关 |
您最近一年使用:0次
2023-08-19更新
|
276次组卷
|
3卷引用:福建省龙岩市一级校联盟2023-2024学年高二上学期11月期中考试化学试题
福建省龙岩市一级校联盟2023-2024学年高二上学期11月期中考试化学试题重庆市大足中学2021-2022学年高二上学期第一次月考化学试题(已下线)专题02 盖斯定律、反应热的计算【考点清单】(讲+练)-2023-2024学年高二化学期中考点大串讲(人教版2019选择性必修1)
名校
5 . 以下反应可表示获得乙醇并用作汽车燃料的过程,下列有关说法正确的是
①6CO2(g)+6H2O(l)=C6H12O6(s)+6O2(g) ΔH1
②C6H12O6(s)=2C2H5OH(l)+2CO2(g) ΔH2
③C2H5OH(l)+3O2(g)=2CO2(g)+3H2O(l) ΔH3
①6CO2(g)+6H2O(l)=C6H12O6(s)+6O2(g) ΔH1
②C6H12O6(s)=2C2H5OH(l)+2CO2(g) ΔH2
③C2H5OH(l)+3O2(g)=2CO2(g)+3H2O(l) ΔH3
| A.2ΔH3=-ΔH1-2ΔH2 |
| B.ΔH3、ΔH1、ΔH2均为ΔH<0 |
| C.在不同油耗汽车中发生反应③,ΔH3相同 |
| D.植物的光合作用通过反应①将热能转化为化学能 |
您最近一年使用:0次
2023-08-14更新
|
401次组卷
|
3卷引用:福建省宁德第一中学2023-2024学年高二上学期9月月考化学试题
福建省宁德第一中学2023-2024学年高二上学期9月月考化学试题作业(三) 反应热的计算(已下线)专题01 反应热、焓变与热化学方程式【考点清单】(讲+练)-2023-2024学年高二化学期中考点大串讲(人教版2019选择性必修1)
名校
6 . 多相催化反应是在催化剂表面通过吸附、解吸过程进行的。我国学者发现T ℃时(各物质均为气态),甲醇与水在铜基催化剂上的反应机理和能量图如图:

已知:
下列说法正确的是

已知:

下列说法正确的是
| A.反应Ⅱ的热化学方程式为CO(g)+H2O(g)=H2(g)+CO2(g) ΔH=+a kJ·mol-1(a>0) |
| B.1 mol CH3OH(g)和1 mol H2O(g)的总能量大于1 mol CO2(g)和3 mol H2(g)的总能量 |
| C.选择优良的催化剂,有利于减少过程中的能耗 |
| D.CO(g)在反应中生成又消耗,CO(g)可认为是催化剂 |
您最近一年使用:0次
2023-08-14更新
|
562次组卷
|
3卷引用:福建省宁德第一中学2023-2024学年高二上学期9月月考化学试题
名校
7 . 二硫化碳用于制造人造丝、杀虫剂、促进剂等,也用作溶剂。回答下列问题:
(1)下列反应的焓变及平衡常数如下:
(Ⅰ)


(Ⅱ)
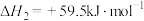
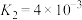
(Ⅲ)
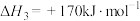
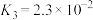
(Ⅳ)
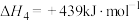

①反应(Ⅳ)自发进行的条件是_______ (填字母)。
A.高温 B.低温 C.任意温度
②
_______  ;
;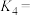
_______ 。
(2)硫化氢替代硫黄生产二硫化碳的原理为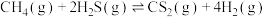 ,起始时,
,起始时,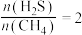 。在100 kPa压强下测得不同温度时的平衡组成如图1所示,在不同压强下测得的平衡组成如图2所示:
。在100 kPa压强下测得不同温度时的平衡组成如图1所示,在不同压强下测得的平衡组成如图2所示:

①该反应的
_______ 0(填“>”或“<”);图2中a、d代表的物质分别是_______ 、_______ 。
②图1中,X点H2S的转化率为_______ %。
③为提高该反应中H2S的平衡转化率,除改变温度和压强外,还可采取的措施是_______ 。
(1)下列反应的焓变及平衡常数如下:
(Ⅰ)



(Ⅱ)

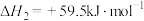
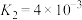
(Ⅲ)

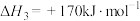
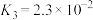
(Ⅳ)

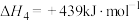

①反应(Ⅳ)自发进行的条件是
A.高温 B.低温 C.任意温度
②

 ;
;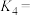
(2)硫化氢替代硫黄生产二硫化碳的原理为
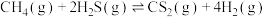 ,起始时,
,起始时,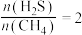 。在100 kPa压强下测得不同温度时的平衡组成如图1所示,在不同压强下测得的平衡组成如图2所示:
。在100 kPa压强下测得不同温度时的平衡组成如图1所示,在不同压强下测得的平衡组成如图2所示:
①该反应的

②图1中,X点H2S的转化率为
③为提高该反应中H2S的平衡转化率,除改变温度和压强外,还可采取的措施是
您最近一年使用:0次
2023-08-14更新
|
132次组卷
|
3卷引用:福建省三明第一中学2023-2024学年高二上学期10月月考化学试题
名校
8 . 降低大气中CO2的含量及有效地开发利用CO2引起了全世界的普遍重视。
(1)如下图所示。已知:CO(g)+H2O(g) CO2(g)+H2(g) ΔH1= -41 kJ·mol−1
CO2(g)+H2(g) ΔH1= -41 kJ·mol−1
CH3CH2OH(g)+3H2O(g) 2CO2(g)+6H2(g) ΔH2= +174.1 kJ·mol−1
2CO2(g)+6H2(g) ΔH2= +174.1 kJ·mol−1
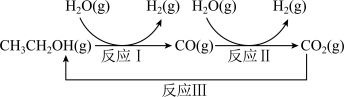
反应 Ⅰ 的热化学方程式为_________ 。
(2)目前工业上有一种方法是用CO2来生产燃料甲醇。为探究该反应原理,进行如下实验:在容积为1L的密闭容器中,充入1 mol CO2和3mol H2,在500℃下发生发应,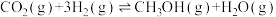 实验测得CO2和
实验测得CO2和 的物质的量(n)随时间变化如图1所示:
的物质的量(n)随时间变化如图1所示:
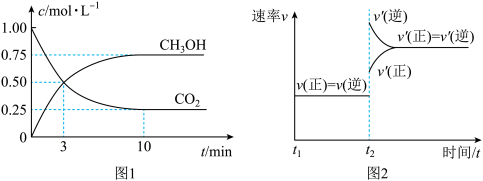
①500℃达平衡时, 物质的量分数为
物质的量分数为____________ 。图2是改变温度时速率随时间变化的示意图,则该反应的正反应为____________ 反应(填“放热”或“吸热”)。
②500℃该反应的平衡常数为____________ ,若提高温度800℃进行,达平衡时,K值____________ (填“增大”“减小”或“不变”)。
③500℃条件下,测得某时刻,CO2(g)、H2(g)、CH3OH(g) 和H2O(g) 的浓度均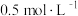 此时v(正)
此时v(正)_____________ v(逆)(填“>”“<”或“=”)
④下列措施能使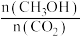 增大的是
增大的是____________ 。
A.升高温度 B.在原容器中充入
C.原容器中充入1 mol CO2和3 mol H2 D.缩小容器容积,增大压强
(1)如下图所示。已知:CO(g)+H2O(g)
 CO2(g)+H2(g) ΔH1= -41 kJ·mol−1
CO2(g)+H2(g) ΔH1= -41 kJ·mol−1CH3CH2OH(g)+3H2O(g)
 2CO2(g)+6H2(g) ΔH2= +174.1 kJ·mol−1
2CO2(g)+6H2(g) ΔH2= +174.1 kJ·mol−1
反应 Ⅰ 的热化学方程式为
(2)目前工业上有一种方法是用CO2来生产燃料甲醇。为探究该反应原理,进行如下实验:在容积为1L的密闭容器中,充入1 mol CO2和3mol H2,在500℃下发生发应,
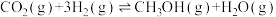 实验测得CO2和
实验测得CO2和 的物质的量(n)随时间变化如图1所示:
的物质的量(n)随时间变化如图1所示:
①500℃达平衡时,
 物质的量分数为
物质的量分数为②500℃该反应的平衡常数为
③500℃条件下,测得某时刻,CO2(g)、H2(g)、CH3OH(g) 和H2O(g) 的浓度均
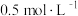 此时v(正)
此时v(正)④下列措施能使
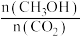 增大的是
增大的是A.升高温度 B.在原容器中充入

C.原容器中充入1 mol CO2和3 mol H2 D.缩小容器容积,增大压强
您最近一年使用:0次
2023-08-08更新
|
107次组卷
|
2卷引用:福建省泉州市南安市侨光中学2022-2023学年高二上学期10月月考化学试题
9 . 利用CO2催化加氢制二甲醚,可以实现CO2的再利用,该过程中涉及以下两个反应:
①CO2(g)+3H2(g) CH3OH(g)+H2O(g) ΔH1
CH3OH(g)+H2O(g) ΔH1
②2CH3OH(g) CH3OCH3(g)+H2O(g) ΔH2
CH3OCH3(g)+H2O(g) ΔH2
则反应2CO2(g)+6H2(g) CH3OCH3(g)+3H2O(g)的ΔH为
CH3OCH3(g)+3H2O(g)的ΔH为
①CO2(g)+3H2(g)
 CH3OH(g)+H2O(g) ΔH1
CH3OH(g)+H2O(g) ΔH1②2CH3OH(g)
 CH3OCH3(g)+H2O(g) ΔH2
CH3OCH3(g)+H2O(g) ΔH2则反应2CO2(g)+6H2(g)
 CH3OCH3(g)+3H2O(g)的ΔH为
CH3OCH3(g)+3H2O(g)的ΔH为| A.2ΔH1+ΔH2 | B.2ΔH1-ΔH2 | C.ΔH1+2ΔH2 | D.ΔH1+ΔH2 |
您最近一年使用:0次
2023-08-02更新
|
562次组卷
|
4卷引用:福建省福州市延安中学2023-2024学年高二上学期期中考试化学试题
福建省福州市延安中学2023-2024学年高二上学期期中考试化学试题新疆生产建设兵团第二师八一中学2023-2024学年高二上学期第一次月考化学试题(已下线)寒假作业01 化学反应的热效应-【寒假分层作业】2024年高二化学寒假培优练(人教版2019)辽宁省部分学校2022-2023学年高一下学期期末考试化学试题
名校
10 . NO催化 生成
生成 的过程由以下三步基元反应构成:
的过程由以下三步基元反应构成:
第1步:
 ;
;
第2步: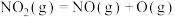
 ;
;
第3步:

 生成
生成 的过程由以下三步基元反应构成:
的过程由以下三步基元反应构成:第1步:

 ;
;第2步:
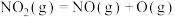
 ;
;第3步:


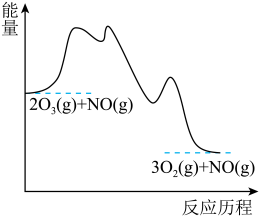
| A.第2步是总反应的决速步 |
| B.三步基元反应都是放热反应 |
| C.该过程共有两种中间产物 |
D.总反应 的焓变为 的焓变为 |
您最近一年使用:0次
2023-07-31更新
|
486次组卷
|
7卷引用:福建省福州高新区第一中学(闽侯县第三中学)2023-2024学年高二上学期12月月考化学试题
福建省福州高新区第一中学(闽侯县第三中学)2023-2024学年高二上学期12月月考化学试题福建省福州市闽 闽侯县第一中学2023-2024学年高二上学期12月月考化学试题福建省莆田第七中学、第十一中学、第十五中学等校2023-2024学年高二上学期期末联考化学试题江苏省淮安市2022-2023学年高二上学期期末考试化学试题江苏省苏州震泽中学2023~2024学年高二上学期10月月考化学试题(已下线)专题07 化学能与热能、电能-【好题汇编】备战2023-2024学年高二化学上学期期末真题分类汇编(江苏专用)江苏省苏州市吴江市高级中学2023-2024学年高二上学期10月月考化学试题



