1 . 已知: 与不足量的
与不足量的 反应时,生成S和
反应时,生成S和 。根据以下三个热化学方程式:
。根据以下三个热化学方程式:
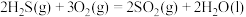
 ①
①

 ②
②

 ③
③
 、
、 、
、 三者大小关系正确的是
三者大小关系正确的是
 与不足量的
与不足量的 反应时,生成S和
反应时,生成S和 。根据以下三个热化学方程式:
。根据以下三个热化学方程式: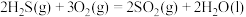
 ①
①
 ②
②
 ③
③ 、
、 、
、 三者大小关系正确的是
三者大小关系正确的是A.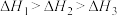 | B.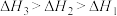 |
C.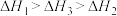 | D.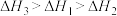 |
您最近一年使用:0次
2023-12-03更新
|
826次组卷
|
25卷引用:福建省福州格致中学2021-2022学年高二上学期第一阶段测试化学试题(10月)
福建省福州格致中学2021-2022学年高二上学期第一阶段测试化学试题(10月)江西省上饶县中学2017-2018学年高二上学期补考化学试题重庆市第三十中学2018-2019学年高二上学期第三次月考化学试题甘肃省古浪县第二中学2019-2020学年高二上学期基础知识竞赛化学试题山西省怀仁市2021-2022学年高二上学期期中化学试题广西钦州市2021-2022学年高二上学期期末考试化学试题第二节 反应热的计算 第2课时 反应热的计算甘肃省甘南藏族自治州合作第一中学2021-2022学年高二上学期期中考试化学试题(理)河南省濮阳市元龙高级中学2021-2022学年高二上学期期中考试化学试题贵州省部分学校2022-2023学年高二上学期10月联考化学试题贵州省“三新”改革联盟校联考2022-2023学年高二上学期期中考试化学试题陕西省咸阳市实验中学2021-2022学年高二上学期第三次月考化学试题湖南省怀化市雅礼实验学校2022-2023学年高二上学期第一次月考化学试题河南省洛阳市第一中学2022-2023学年高二上学期期末检测化学试题章末检测卷(一) 化学反应的热效应广东省广州市执信中学2023-2024学年高二上学期10月选考化学试题安徽省无为襄安中学2022-2023学年高二下学期开学考试化学试题山东省聊城市2023-2024学年高二上学期11月期中考试化学试题天津市南开区2023-2024学年高二上学期11月期中考试化学试题陕西省咸阳市兴平市西郊高级中学2023-2024学年高二上学期期中考试化学试题(已下线)寒假作业01 化学反应的热效应-【寒假分层作业】2024年高二化学寒假培优练(人教版2019)江西省抚州市资溪县第一中学2023-2024学年高二上学期11月期中化学试题安徽省淮北市第一中学2023-2024学年高二下学期寒假自主学习质量评估化学试题第一章 化学反应的热效应【单元测试A卷】江苏省淮安市涟水县第一中学2020届高三上学期第二次月考化学试题
名校
解题方法
2 . 甲醇( )是一种重要的化工原料,广泛应用于化工生产,也可以用作燃料。
)是一种重要的化工原料,广泛应用于化工生产,也可以用作燃料。
已知:
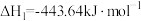
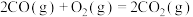
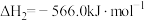
(1)试写出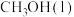 在氧气中完全燃烧生成
在氧气中完全燃烧生成 和
和 的热化学方程式:
的热化学方程式:___________ 。
(2)某公司开发了一种以甲醇为原料,以KOH为电解质的用于手机的可充电的高效燃料电池,充一次电可连续使用一个月。其中B电极的电极材料为碳,如图是一个电化学过程的示意图。请填空:

①放电时,甲醇在___________ (填“正”或“负”)极发生反应,正极的电极反应式为___________ ;
②工作时,B极的电极反应式为___________ ,当电路中通过0.1mol电子时,A极的质量___________ (填增加或减小)___________ g。
(3)某同学设计了一种用电解法制取 的实验装置(如图所示),通电后,溶液中产生大量的白色沉淀,且较长时间不变色。下列说法不正确的是___________(填序号)。
的实验装置(如图所示),通电后,溶液中产生大量的白色沉淀,且较长时间不变色。下列说法不正确的是___________(填序号)。
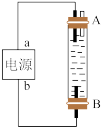
 )是一种重要的化工原料,广泛应用于化工生产,也可以用作燃料。
)是一种重要的化工原料,广泛应用于化工生产,也可以用作燃料。已知:

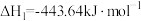
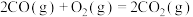
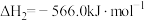
(1)试写出
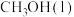 在氧气中完全燃烧生成
在氧气中完全燃烧生成 和
和 的热化学方程式:
的热化学方程式:(2)某公司开发了一种以甲醇为原料,以KOH为电解质的用于手机的可充电的高效燃料电池,充一次电可连续使用一个月。其中B电极的电极材料为碳,如图是一个电化学过程的示意图。请填空:

①放电时,甲醇在
②工作时,B极的电极反应式为
(3)某同学设计了一种用电解法制取
 的实验装置(如图所示),通电后,溶液中产生大量的白色沉淀,且较长时间不变色。下列说法不正确的是___________(填序号)。
的实验装置(如图所示),通电后,溶液中产生大量的白色沉淀,且较长时间不变色。下列说法不正确的是___________(填序号)。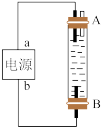
| A.a为电源正极,b为电源负极 | B.可以用NaCl溶液作为电解质溶液 |
| C.A、B两端都必须用铁作电极 | D.阴极发生的反应为 |
您最近一年使用:0次
2023-11-29更新
|
191次组卷
|
3卷引用:福建省福州高级中学2023-2024学年高二上学期期中考试化学试题
名校
解题方法
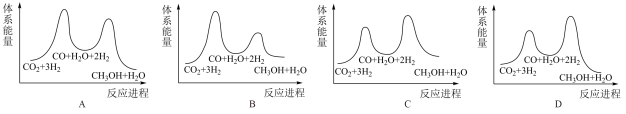
3 . 实现碳达峰、碳中和是贯彻新发展理念的内在要求,因此二氧化碳的合理利用成为研究热点,有效方式之一就是二氧化碳直接加氢合成高附加值产品。
(1)一定条件下,可用二氧化碳加氢合成甲醇。
已知CO2(g)+3H2(g) CH3OH(g)+H2O(g) ∆H= -50kJ·mol-1 ,该反应经过如下步骤来实现:
CH3OH(g)+H2O(g) ∆H= -50kJ·mol-1 ,该反应经过如下步骤来实现:
I.CO2(g)+H2(g) CO(g)+H2O(g) ∆H1= +40.9kJ·mol-1
CO(g)+H2O(g) ∆H1= +40.9kJ·mol-1
II.CO(g)+2H2(g) CH3OH(g) ∆H2
CH3OH(g) ∆H2
①求∆H2=___________ kJ·mol-1
②已知反应I是整个反应的决速步,下列示意图中能体现上述反应能量变化的是___________ (填标号)。
(2)一定条件下也可用二氧化碳加氢合成甲烷:4H2(g)+CO2(g) CH4(g)+2H2O(g)。
CH4(g)+2H2O(g)。
①在绝热恒容密闭容器中,一定能说明该反应达到平衡状态的是___________ (填字母)。
A.v正(H2)=v逆(CH4) B.t min内断裂H-H的数目与断裂O—H数目相等
C.容器温度保持不变 D.当H2(g)与CO2(g)物质的量之比保持4:1不变
一定温度下在2L恒温恒容密闭容器中初始加入2.0mol CO2和一定量H2,发生上述反应数据如下:
②则3min时容器中CH4的物质的量浓度为___________ ,该温度下反应的化学平衡常数为___________ 。
③保持温度不变,在达平衡后,向容器中再加入H2(g)和CH4(g)各1mol,则此时v(正)___________ v(逆)(填“>”、“<”或“=”)。
(3)最近科学家开发出一种新系统,“溶解”水中的二氧化碳,发生电化学反应,生成电能和氢气,其工作原理如图所示。
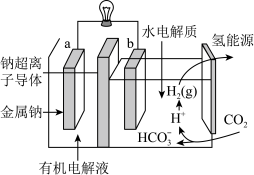
①有机电解液是有机溶剂加特定的盐加热制成,该装置的有机电解液___________ (填“能”或“不能”)用乙醇做溶剂。
②写出二氧化碳生成氢气的电极反应式:___________ 。
(1)一定条件下,可用二氧化碳加氢合成甲醇。
已知CO2(g)+3H2(g)
 CH3OH(g)+H2O(g) ∆H= -50kJ·mol-1 ,该反应经过如下步骤来实现:
CH3OH(g)+H2O(g) ∆H= -50kJ·mol-1 ,该反应经过如下步骤来实现:I.CO2(g)+H2(g)
 CO(g)+H2O(g) ∆H1= +40.9kJ·mol-1
CO(g)+H2O(g) ∆H1= +40.9kJ·mol-1II.CO(g)+2H2(g)
 CH3OH(g) ∆H2
CH3OH(g) ∆H2①求∆H2=
②已知反应I是整个反应的决速步,下列示意图中能体现上述反应能量变化的是

(2)一定条件下也可用二氧化碳加氢合成甲烷:4H2(g)+CO2(g)
 CH4(g)+2H2O(g)。
CH4(g)+2H2O(g)。①在绝热恒容密闭容器中,一定能说明该反应达到平衡状态的是
A.v正(H2)=v逆(CH4) B.t min内断裂H-H的数目与断裂O—H数目相等
C.容器温度保持不变 D.当H2(g)与CO2(g)物质的量之比保持4:1不变
一定温度下在2L恒温恒容密闭容器中初始加入2.0mol CO2和一定量H2,发生上述反应数据如下:
| t(min) | 0 | 1 | 2 | 3 | 4 | 5 | 6 |
| n(CO2)(mol) | 2.0 | 1.5 | 1.1 | 0.8 | 0.6 | 0.5 | 0.5 |
| n(H2)(mol) | 3.2 |
③保持温度不变,在达平衡后,向容器中再加入H2(g)和CH4(g)各1mol,则此时v(正)
(3)最近科学家开发出一种新系统,“溶解”水中的二氧化碳,发生电化学反应,生成电能和氢气,其工作原理如图所示。

①有机电解液是有机溶剂加特定的盐加热制成,该装置的有机电解液
②写出二氧化碳生成氢气的电极反应式:
您最近一年使用:0次
4 . 完成下列问题。
(1)在一定温度下,向体积为2L的恒容密闭容器中充入一定量的A、B发生化学变化(除物质D为固体外,其余的物质均为气体),各物质的含量随时间的变化情况如图所示,回答下列问题:
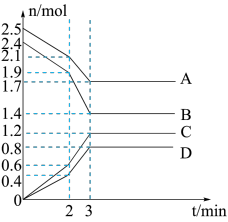
①写出该反应的化学方程式:___________ 。
② 内用D表示的化学反应速率
内用D表示的化学反应速率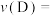
_______ 。
③该反应在 时改变了某一条件,则该条件可能为
时改变了某一条件,则该条件可能为___________ 。
(2)甲醇既是重要的化工原料,又可作为燃料,工业上将 催化加氢生产甲醇,发生如下反应:
催化加氢生产甲醇,发生如下反应:
反应Ⅰ: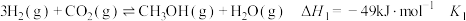
反应Ⅱ: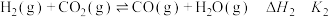
反应Ⅲ: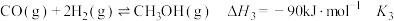
①
___________  ;相同条件下,反应Ⅲ的平衡常数
;相同条件下,反应Ⅲ的平衡常数
___________ (用平衡常数 、
、 表示)。
表示)。
②采用真空封管法制备磷化硼纳米颗粒,成功实现了高选择性电催化还原 制备甲醇,该反应历程如图所示。
制备甲醇,该反应历程如图所示。
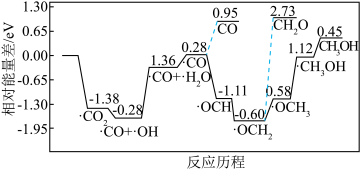
上述合成甲醇的反应速率较慢,要使反应速率加快,主要降低下列变化中___________ (填字母)的能量变化。
A. B.
B.
C. D.
D.
(1)在一定温度下,向体积为2L的恒容密闭容器中充入一定量的A、B发生化学变化(除物质D为固体外,其余的物质均为气体),各物质的含量随时间的变化情况如图所示,回答下列问题:

①写出该反应的化学方程式:
②
 内用D表示的化学反应速率
内用D表示的化学反应速率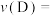
③该反应在
 时改变了某一条件,则该条件可能为
时改变了某一条件,则该条件可能为(2)甲醇既是重要的化工原料,又可作为燃料,工业上将
 催化加氢生产甲醇,发生如下反应:
催化加氢生产甲醇,发生如下反应:反应Ⅰ:
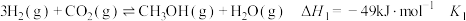
反应Ⅱ:
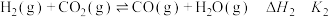
反应Ⅲ:
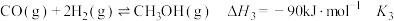
①

 ;相同条件下,反应Ⅲ的平衡常数
;相同条件下,反应Ⅲ的平衡常数
 、
、 表示)。
表示)。②采用真空封管法制备磷化硼纳米颗粒,成功实现了高选择性电催化还原
 制备甲醇,该反应历程如图所示。
制备甲醇,该反应历程如图所示。
上述合成甲醇的反应速率较慢,要使反应速率加快,主要降低下列变化中
A.
 B.
B.
C.
 D.
D.
您最近一年使用:0次
名校
5 . NO在医药化工行业有着十分重要的应用。
Ⅰ.工业上主要采用氨催化氧化法生产NO:
主反应: △H1
△H1
副反应: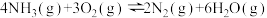 △H2=-1265kJ·mol-1
△H2=-1265kJ·mol-1
(1)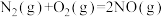 △H=+180kJ·mol-1,则△H1=
△H=+180kJ·mol-1,则△H1=_____ 。
(2)在不同的氨初始含量下,催化剂表面的反应速率与温度的关系如图。
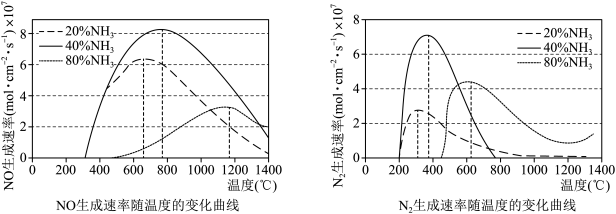
由图知,生产NO的最佳条件为_____。
(3)在一定的氨初始含量下,温度升高一段时间后,体系中 减小,可能的原因是
减小,可能的原因是_____ 。
Ⅱ.NO是空气污染物之一,以硫酸钠溶液为电解质,泡沫Cu为阴极,利用电化学装置实现NO的消除,阴极反应的模拟能量变化如图。
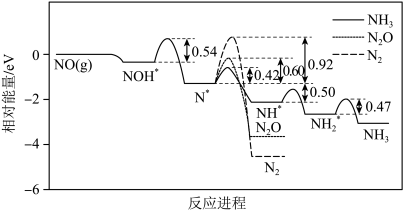
(4)从反应速率角度推断NO最终还原产物主要为_____ ,阴极的主要电极反应式为_____ 。
Ⅲ.用NO生产亚硝酰氯,反应如下: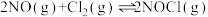 △H<0
△H<0
(5)提高NO平衡转化率可采取的措施是_____。
(6)一定温度下,在恒容密闭容器中,NO(g)和Cl2(g)按物质的量之比为2∶1进行反应,体系初始总压为p0,NO的平衡转化率为α,则平衡常数Kp=_____ (以分压表示,分压=总压×物质的量分数,用含p0、α代数式表示)。
Ⅰ.工业上主要采用氨催化氧化法生产NO:
主反应:
 △H1
△H1副反应:
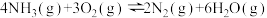 △H2=-1265kJ·mol-1
△H2=-1265kJ·mol-1(1)
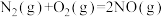 △H=+180kJ·mol-1,则△H1=
△H=+180kJ·mol-1,则△H1=(2)在不同的氨初始含量下,催化剂表面的反应速率与温度的关系如图。

由图知,生产NO的最佳条件为_____。
| A.氨含量20%、反应温度650℃ |
| B.氨含量40%、反应温度750℃ |
| C.氨含量80%、反应温度1150℃ |
| D.氨含量20%、反应温度750℃ |
(3)在一定的氨初始含量下,温度升高一段时间后,体系中
 减小,可能的原因是
减小,可能的原因是Ⅱ.NO是空气污染物之一,以硫酸钠溶液为电解质,泡沫Cu为阴极,利用电化学装置实现NO的消除,阴极反应的模拟能量变化如图。

(4)从反应速率角度推断NO最终还原产物主要为
Ⅲ.用NO生产亚硝酰氯,反应如下:
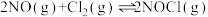 △H<0
△H<0(5)提高NO平衡转化率可采取的措施是_____。
| A.降低温度 | B.增大NO的浓度 | C.增大压强 | D.加入合适的催化剂 |
(6)一定温度下,在恒容密闭容器中,NO(g)和Cl2(g)按物质的量之比为2∶1进行反应,体系初始总压为p0,NO的平衡转化率为α,则平衡常数Kp=
您最近一年使用:0次
6 . 氮的氧化物是大气污染物之一,用活性炭或一氧化碳还原氮氧化物,可防止空气污染。
(1)已知: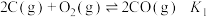 ,
,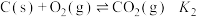 ,
,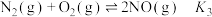 ,则反应
,则反应 的
的
___________ 。(用 、
、 、
、 表示)
表示)
(2)向容积为2L的密闭容器中加入活性炭(足量)和NO,发生反应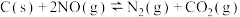 ,NO和
,NO和 的物质的量变化如下表所示。
的物质的量变化如下表所示。
①0~5min内,以 表示的该反应速率
表示的该反应速率
___________ ,最终达平衡时NO的转化率
___________ ,该温度T℃下的平衡常数
___________ 。
②保持温度T℃不变,向该2L密闭容器中加入该四种反应混合物各2mol,该时刻,正、逆反应速率的大小关系为: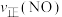
___________ 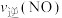 (填“>”“<”或“=”)。
(填“>”“<”或“=”)。
(3)已知下列反应在298K时的反应焓变:
①
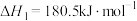
②
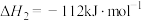
③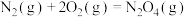
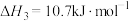
写出 转化为
转化为 的热化学方程式:
的热化学方程式:___________ 。
(1)已知:
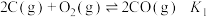 ,
,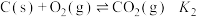 ,
,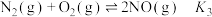 ,则反应
,则反应 的
的
 、
、 、
、 表示)
表示)(2)向容积为2L的密闭容器中加入活性炭(足量)和NO,发生反应
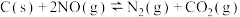 ,NO和
,NO和 的物质的量变化如下表所示。
的物质的量变化如下表所示。| 条件 | 保持温度为T/℃ | ||||||
| 时间 | 0min | 5min | 10min | 15min | 20min | 25min | 30min |
| NO物质的量/mol |  |  | 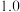 | 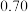 | 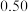 |  |  |
 物质的量/mol 物质的量/mol | 0 |  | 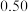 |  |  | 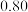 | 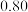 |
 表示的该反应速率
表示的该反应速率


②保持温度T℃不变,向该2L密闭容器中加入该四种反应混合物各2mol,该时刻,正、逆反应速率的大小关系为:
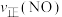
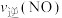 (填“>”“<”或“=”)。
(填“>”“<”或“=”)。(3)已知下列反应在298K时的反应焓变:
①

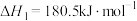
②

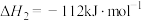
③
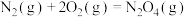
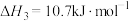
写出
 转化为
转化为 的热化学方程式:
的热化学方程式:
您最近一年使用:0次
解题方法
7 . I.碳是形成化合物种类最多的元素,其单质及化合物是人类生产生活的主要能源物质,请回答下列问题:
(1)有机物M经过太阳光光照可转化成N,转化过程如下:

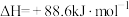
则M、N相比,较稳定的是___________ 。
(2)火箭和导弹表面的薄层是耐高温物质。将石墨、铝粉和二氧化钛按一定比例混合在高温下煅烧,所得物质可作耐高温材料,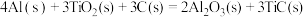
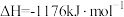 ,则反应过程中,每转移
,则反应过程中,每转移 电子放出的热量为
电子放出的热量为___________ kJ。
(3) 、
、 、C都是优质的能源物质,它们燃烧的热化学方程式分别为
、C都是优质的能源物质,它们燃烧的热化学方程式分别为
①
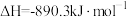 ;
;
②
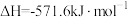 ;
;
③
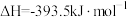 ;
;
已知 、
、 组成的混合气体
组成的混合气体 ,又
,又 与
与 的物质的量之比
的物质的量之比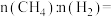 3:2,则该混合气体完全燃烧后放出的热量为
3:2,则该混合气体完全燃烧后放出的热量为___________ kJ; 的反应热无法直接测量,但通过上述反应可求出其反应热
的反应热无法直接测量,但通过上述反应可求出其反应热
___________  。
。
II. 的盐酸与
的盐酸与 的
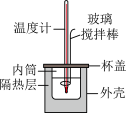
的 溶液在如图所示的装置中进行中和反应,通过测定反应过程中所放出的热量可计算中和反应反应热,回答下列问题:
溶液在如图所示的装置中进行中和反应,通过测定反应过程中所放出的热量可计算中和反应反应热,回答下列问题:
(4)实验中若改用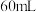
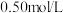 的盐酸与
的盐酸与
 的氢氧化钠溶液进行反应,若实验操作均正确,则所求中和热
的氢氧化钠溶液进行反应,若实验操作均正确,则所求中和热___________ (填“相等”或“不相等”)。
(5)下列说法正确的是___________(填字母)。
(1)有机物M经过太阳光光照可转化成N,转化过程如下:

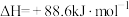
则M、N相比,较稳定的是
(2)火箭和导弹表面的薄层是耐高温物质。将石墨、铝粉和二氧化钛按一定比例混合在高温下煅烧,所得物质可作耐高温材料,
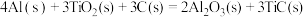
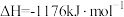 ,则反应过程中,每转移
,则反应过程中,每转移 电子放出的热量为
电子放出的热量为(3)
 、
、 、C都是优质的能源物质,它们燃烧的热化学方程式分别为
、C都是优质的能源物质,它们燃烧的热化学方程式分别为①

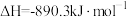 ;
;②

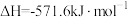 ;
;③

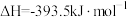 ;
;已知
 、
、 组成的混合气体
组成的混合气体 ,又
,又 与
与 的物质的量之比
的物质的量之比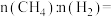 3:2,则该混合气体完全燃烧后放出的热量为
3:2,则该混合气体完全燃烧后放出的热量为 的反应热无法直接测量,但通过上述反应可求出其反应热
的反应热无法直接测量,但通过上述反应可求出其反应热
 。
。II.
 的盐酸与
的盐酸与 的
的 溶液在如图所示的装置中进行中和反应,通过测定反应过程中所放出的热量可计算中和反应反应热,回答下列问题:
溶液在如图所示的装置中进行中和反应,通过测定反应过程中所放出的热量可计算中和反应反应热,回答下列问题:
(4)实验中若改用
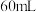
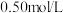 的盐酸与
的盐酸与
 的氢氧化钠溶液进行反应,若实验操作均正确,则所求中和热
的氢氧化钠溶液进行反应,若实验操作均正确,则所求中和热(5)下列说法正确的是___________(填字母)。
| A.玻璃搅拌棒可用铜丝搅拌棒替代 |
| B.向内筒中加入稀碱时,应当缓慢而匀速地加入 |
| C.实验中如果用相同体积、相同浓度的醋酸代替盐酸,测得的中和热数值将偏小 |
| D.将用量筒量取好的稀盐酸加入内筒后,应当快速用水冲洗量筒内壁剩余的稀盐酸至内筒中,以免造成测量误差 |
您最近一年使用:0次
名校
解题方法
8 . 二氧化碳催化加氢制甲醇有利于减少温室气体排放。涉及的主要反应如下:
Ⅰ.

Ⅱ.
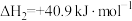
Ⅲ.
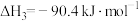
(1)
_______  ,该反应一般认为通过反应Ⅱ和反应Ⅲ两步来实现,若反应Ⅱ为慢反应,下列示意图中能体现上述反应能量变化的是
,该反应一般认为通过反应Ⅱ和反应Ⅲ两步来实现,若反应Ⅱ为慢反应,下列示意图中能体现上述反应能量变化的是_______ (填标号)。
A.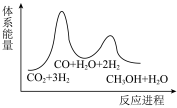 B.
B.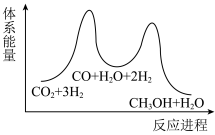
C.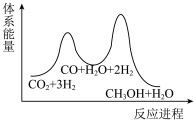 D.
D.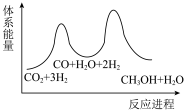
(2)一定条件下,恒容密闭容器中 和
和 发生上述反应。下列说法正确的是_______。
发生上述反应。下列说法正确的是_______。
(3)不同压强下,按照 投料,实验测得
投料,实验测得 的平衡转化率和
的平衡转化率和 的平衡产率随温度的变化关系如下图所示。
的平衡产率随温度的变化关系如下图所示。
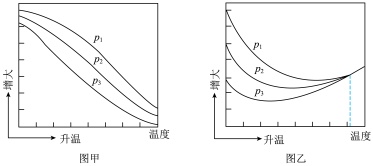
已知: 的平衡转化率
的平衡转化率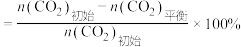
 的平衡产率
的平衡产率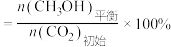
其中纵坐标表示 平衡转化率的是图
平衡转化率的是图_______ (填“甲”或“乙”),压强 、
、 、
、 由大到小的顺序为
由大到小的顺序为_______ ,图乙中 温度时,三条曲线几乎交于一点的原因是
温度时,三条曲线几乎交于一点的原因是_______ 。
(4)乙醇是重要的有机化工原料,可由乙烯气相直接水合法或间接水合法生产。热化学方程式为:C2H4(g)+H2O(g) CH3CH2OH(g) ΔH=-45.5kJ·mol-1,下图为气相直接水合法中乙烯的平衡转化率与温度、压强的关系[其中n(H2O)∶n(C2H4)=1∶1]。
CH3CH2OH(g) ΔH=-45.5kJ·mol-1,下图为气相直接水合法中乙烯的平衡转化率与温度、压强的关系[其中n(H2O)∶n(C2H4)=1∶1]。
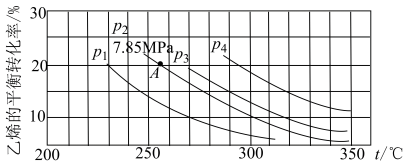
计算乙烯水合制乙醇反应在图中A点的平衡常数Kp=_______ (用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。
Ⅰ.


Ⅱ.

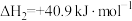
Ⅲ.

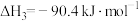
(1)

 ,该反应一般认为通过反应Ⅱ和反应Ⅲ两步来实现,若反应Ⅱ为慢反应,下列示意图中能体现上述反应能量变化的是
,该反应一般认为通过反应Ⅱ和反应Ⅲ两步来实现,若反应Ⅱ为慢反应,下列示意图中能体现上述反应能量变化的是A.
 B.
B.
C.
 D.
D.
(2)一定条件下,恒容密闭容器中
 和
和 发生上述反应。下列说法正确的是_______。
发生上述反应。下列说法正确的是_______。| A.当混合气体密度不变时说明体系达到平衡状态 |
| B.反应达到平衡状态后通入氦气,体系压强增大,反应速率不变,平衡不移动 |
| C.使用高效催化剂,可提高甲醇的生产效率,但不能改变甲醇的平衡产率 |
| D.实际生产中温度越低越有利于甲醇的合成 |
(3)不同压强下,按照
 投料,实验测得
投料,实验测得 的平衡转化率和
的平衡转化率和 的平衡产率随温度的变化关系如下图所示。
的平衡产率随温度的变化关系如下图所示。
已知:
 的平衡转化率
的平衡转化率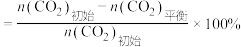
 的平衡产率
的平衡产率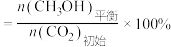
其中纵坐标表示
 平衡转化率的是图
平衡转化率的是图 、
、 、
、 由大到小的顺序为
由大到小的顺序为 温度时,三条曲线几乎交于一点的原因是
温度时,三条曲线几乎交于一点的原因是(4)乙醇是重要的有机化工原料,可由乙烯气相直接水合法或间接水合法生产。热化学方程式为:C2H4(g)+H2O(g)
 CH3CH2OH(g) ΔH=-45.5kJ·mol-1,下图为气相直接水合法中乙烯的平衡转化率与温度、压强的关系[其中n(H2O)∶n(C2H4)=1∶1]。
CH3CH2OH(g) ΔH=-45.5kJ·mol-1,下图为气相直接水合法中乙烯的平衡转化率与温度、压强的关系[其中n(H2O)∶n(C2H4)=1∶1]。
计算乙烯水合制乙醇反应在图中A点的平衡常数Kp=
您最近一年使用:0次
名校
解题方法
9 . 按要求完成下列问题
(1)向某恒温体积固定的密闭容器中加入0.6mol A、0.2mol C和一定量(未知)的B三种气体,一定条件下发生反应,各物质浓度随时间变化如图所示(已知反应前后容器压强保持不变)。
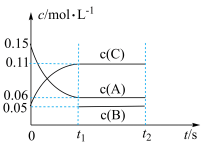
①平衡时A的转化率为___________ ;
②写出该反应的化学方程式___________ ;
③B的起始物质的量是___________ ;
(2)一定条件下,在水溶液中1molCl-、ClO (x=1、2、3、4)的能量(kJ)相对大小(微粒的价态和对应的能量座标)如图所示:
(x=1、2、3、4)的能量(kJ)相对大小(微粒的价态和对应的能量座标)如图所示:
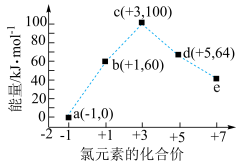
①这些微粒里最不稳定的是___________ (填离子符号)
②写出a+d→b的热化学方程式:___________ 。
(3)甲烷水蒸气催化重整是制高纯氢的方法之一。已知反应器中存在如下反应:
ⅰ.CH4(g)+2H2O(g)=CO2(g)+4H2(g) ΔH1
ⅱ.CO(g)+H2O(g)=CO2(g)+H2(g) ΔH2
ⅲ.CH4(g)=C(s)+2H2(g) ΔH3
①ⅲ为积炭反应,常温下不能自发,请判断该反应ΔH3___________ 0(填“>”、“<”或“=”)
②若想利用盖斯定律计算出ΔH3的具体值时,除了ΔH1和ΔH2之外,还需要知道反应___________ ΔH4(写一个合适的方程式,注明物质的状态)。
(1)向某恒温体积固定的密闭容器中加入0.6mol A、0.2mol C和一定量(未知)的B三种气体,一定条件下发生反应,各物质浓度随时间变化如图所示(已知反应前后容器压强保持不变)。

①平衡时A的转化率为
②写出该反应的化学方程式
③B的起始物质的量是
(2)一定条件下,在水溶液中1molCl-、ClO
 (x=1、2、3、4)的能量(kJ)相对大小(微粒的价态和对应的能量座标)如图所示:
(x=1、2、3、4)的能量(kJ)相对大小(微粒的价态和对应的能量座标)如图所示:
①这些微粒里最不稳定的是
②写出a+d→b的热化学方程式:
(3)甲烷水蒸气催化重整是制高纯氢的方法之一。已知反应器中存在如下反应:
ⅰ.CH4(g)+2H2O(g)=CO2(g)+4H2(g) ΔH1
ⅱ.CO(g)+H2O(g)=CO2(g)+H2(g) ΔH2
ⅲ.CH4(g)=C(s)+2H2(g) ΔH3
①ⅲ为积炭反应,常温下不能自发,请判断该反应ΔH3
②若想利用盖斯定律计算出ΔH3的具体值时,除了ΔH1和ΔH2之外,还需要知道反应
您最近一年使用:0次
10 . 几种物质间的转化焓变如图所示,下列说法不正确 的是
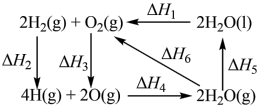

| A.ΔH3>ΔH4 | B.ΔH1>ΔH6 |
| C.ΔH1+ΔH2+ΔH3+ΔH4+ΔH5=0 | D.H—H的键能为ΔH2 |
您最近一年使用:0次
2023-11-11更新
|
230次组卷
|
2卷引用:福建省福州市八县一中2023-2024学年高二上学期11月期中化学试题



