名校
解题方法
1 . Ⅰ.完成下列问题
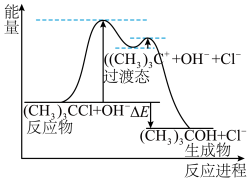
(1)叔丁基氯与碱溶液经两步反应得到叔丁基醇,反应(CH3)3CCl+OH-→(CH3)3COH+Cl-的能量与反应进程如图所示。下列说法正确的是______
(2)下列有关热化学方程式的叙述正确的是_______
(3)已知反应:2NO(g)+2CO(g)=N₂(g)+2CO₂(g),在298K、100kPa的条件下,其中ΔH=-113.0kJ·mol-1,ΔS=-145.3J·mol-1·K-1,该反应___________ (填“能”或“不能”)用于消除汽车尾气中的NO,理由为___________ 。实际上,如果不采取一定措施,汽车尾气并不会自动消除,原因是___________ ;
Ⅱ.CH4和CO2在催化剂作用下可以转化为合成气(主要含H2、CO和少量H2O的混合气体)。
主反应为:I.CH4(g)+CO2(g) 2CO(g)+2H2(g),ΔH1=+247kJ·mol-1
2CO(g)+2H2(g),ΔH1=+247kJ·mol-1
主要副反应有:Ⅱ.CO2(g)+H2(g) CO(g)+H2O(g),ΔH2=+41.2kJ·mol-1
CO(g)+H2O(g),ΔH2=+41.2kJ·mol-1
Ⅲ.CH4(g) C(s)+2H2(g),ΔH3=+74.8kJ·mol-1
C(s)+2H2(g),ΔH3=+74.8kJ·mol-1
Ⅳ.CO(g)+H2(g) C(s)+H2O(g),ΔH4=-131kJ·mol-1
C(s)+H2O(g),ΔH4=-131kJ·mol-1
完成下列填空:
(4)写出CH4和水蒸气反应生成CO和H2的热化学方程式___________ 。
(5)对于反应Ⅰ,有利于提高CH4平衡转化率的措施是___________ 、___________ (任写两条)。
(6)反应Ⅰ温度控制在550~750℃之间,从反应速率角度分析,选择该温度范围的可能原因:___________ 。
(7)某温度下,反应Ⅰ的平衡常数K=0.16,该温度下,测得容器中CH4、CO2、CO和H2的浓度分别为0.5mol/L、0.5mol/L、0.25mol/L、0.25mol/L,此时,反应Ⅰ是否处于平衡状态?若不是,预测反应的方向。___________ 。
(8)CH4和CO2各1mol充入密闭容器中,发生反应I。
①300℃,100kPa,反应达到平衡时CO2体积分数与温度的关系如图中曲线所示。则n(平衡时气体):n(初始气体)=___________ 。
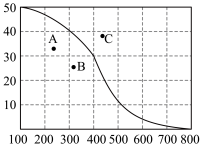
②若A、B、C三点表示不同温度和压强下已达平衡时CO2体积分数___________ 点对应的平衡常数最小,理由是:___________ ;___________ 点对应压强最大,理由是:___________ 。
(1)叔丁基氯与碱溶液经两步反应得到叔丁基醇,反应(CH3)3CCl+OH-→(CH3)3COH+Cl-的能量与反应进程如图所示。下列说法正确的是______

| A.该反应为吸热反应 |
| B.(CH3)3C+比(CH3)3CCl稳定 |
| C.第一步反应一定比第二步反应快 |
| D.增大碱的浓度和升高温度均可加快反应速率 |
(2)下列有关热化学方程式的叙述正确的是_______
A.已知C(石墨,s) C(金刚石,s)ΔH>0,则金刚石比石墨稳定 C(金刚石,s)ΔH>0,则金刚石比石墨稳定 |
| B.含20.0gNaOH的稀溶液与稀盐酸完全中和,放出28.7kJ的热量,则该反应的热化学方程式为NaOH(aq)+HCl(aq)=NaCl(aq)+H2O(l);ΔH=-57.4kJ·mol-1 |
| C.等质量的硫蒸气和硫固体分别完全燃烧,后者放出的热量多 |
D.N2(g)+3H2(g) 2NH3(g);ΔH=-akJ·mol-1,则将14gN2(g)和足量H2置于一密闭容器中,充分反应后放出0.5akJ的热量 2NH3(g);ΔH=-akJ·mol-1,则将14gN2(g)和足量H2置于一密闭容器中,充分反应后放出0.5akJ的热量 |
(3)已知反应:2NO(g)+2CO(g)=N₂(g)+2CO₂(g),在298K、100kPa的条件下,其中ΔH=-113.0kJ·mol-1,ΔS=-145.3J·mol-1·K-1,该反应
Ⅱ.CH4和CO2在催化剂作用下可以转化为合成气(主要含H2、CO和少量H2O的混合气体)。
主反应为:I.CH4(g)+CO2(g)
 2CO(g)+2H2(g),ΔH1=+247kJ·mol-1
2CO(g)+2H2(g),ΔH1=+247kJ·mol-1主要副反应有:Ⅱ.CO2(g)+H2(g)
 CO(g)+H2O(g),ΔH2=+41.2kJ·mol-1
CO(g)+H2O(g),ΔH2=+41.2kJ·mol-1Ⅲ.CH4(g)
 C(s)+2H2(g),ΔH3=+74.8kJ·mol-1
C(s)+2H2(g),ΔH3=+74.8kJ·mol-1Ⅳ.CO(g)+H2(g)
 C(s)+H2O(g),ΔH4=-131kJ·mol-1
C(s)+H2O(g),ΔH4=-131kJ·mol-1完成下列填空:
(4)写出CH4和水蒸气反应生成CO和H2的热化学方程式
(5)对于反应Ⅰ,有利于提高CH4平衡转化率的措施是
(6)反应Ⅰ温度控制在550~750℃之间,从反应速率角度分析,选择该温度范围的可能原因:
(7)某温度下,反应Ⅰ的平衡常数K=0.16,该温度下,测得容器中CH4、CO2、CO和H2的浓度分别为0.5mol/L、0.5mol/L、0.25mol/L、0.25mol/L,此时,反应Ⅰ是否处于平衡状态?若不是,预测反应的方向。
(8)CH4和CO2各1mol充入密闭容器中,发生反应I。
①300℃,100kPa,反应达到平衡时CO2体积分数与温度的关系如图中曲线所示。则n(平衡时气体):n(初始气体)=

②若A、B、C三点表示不同温度和压强下已达平衡时CO2体积分数
您最近一年使用:0次
2 . 回答下列问题
(1)下列 原子的核外电子排布式中,能量最高的是
原子的核外电子排布式中,能量最高的是___________ 。
a.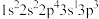 b.
b.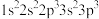 c.
c.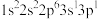 d.
d.
(2)下列各组多电子原子的能级能量比较不正确的是___________ 。
a. b.
b. c.
c.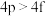 d.
d.
(3)可用焓变和熵变来判断化学反应进行的方向,下列都是能自发进行的化学反应,其中是吸热反应且反应后熵增的是___________ 。
a.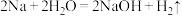 b.
b.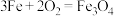
c. d.
d.
(4)某反应过程中的能量变化如图所示:

①若加入催化剂,则b___________ (填“增大”、“减小”或“不变”)。
②根据图像,该反应
___________ (用含a、b的代数式表示)。
(5)写出基态P原子价电子排布式___________ ,该基态原子中能量最高的电子所占的轨道形状是___________ 。
(6)已知:在25℃, 时。
时。
反应Ⅰ.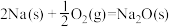
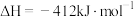 ;
;
反应Ⅱ.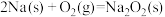
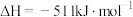 。
。
写出 与
与 反应生成
反应生成 的热化学方程式
的热化学方程式___________ 。
(7) 在火焰上灼烧时火焰的颜色为砖红色,试从原子光谱角度解释原因
在火焰上灼烧时火焰的颜色为砖红色,试从原子光谱角度解释原因___________ 。
(1)下列
 原子的核外电子排布式中,能量最高的是
原子的核外电子排布式中,能量最高的是a.
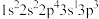 b.
b.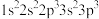 c.
c.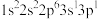 d.
d.
(2)下列各组多电子原子的能级能量比较不正确的是
a.
 b.
b. c.
c.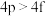 d.
d.
(3)可用焓变和熵变来判断化学反应进行的方向,下列都是能自发进行的化学反应,其中是吸热反应且反应后熵增的是
a.
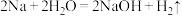 b.
b.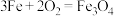
c.
 d.
d.
(4)某反应过程中的能量变化如图所示:

①若加入催化剂,则b
②根据图像,该反应

(5)写出基态P原子价电子排布式
(6)已知:在25℃,
 时。
时。反应Ⅰ.
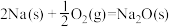
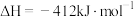 ;
;反应Ⅱ.
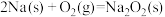
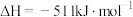 。
。写出
 与
与 反应生成
反应生成 的热化学方程式
的热化学方程式(7)
 在火焰上灼烧时火焰的颜色为砖红色,试从原子光谱角度解释原因
在火焰上灼烧时火焰的颜色为砖红色,试从原子光谱角度解释原因
您最近一年使用:0次
3 . 尿素 是一种重要的氮肥。工业上以
是一种重要的氮肥。工业上以 和
和 为原料合成尿素,在尿素合成塔中的主要反应可表示如下:
为原料合成尿素,在尿素合成塔中的主要反应可表示如下:
反应I: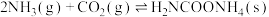 (氨基甲酸铵)
(氨基甲酸铵) 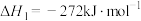
反应Ⅱ: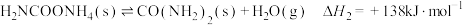
总反应Ⅲ: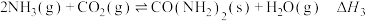
(1) 的电子式为
的电子式为___________ ; 中含有
中含有___________ 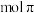 键。
键。
(2)反应I的熵变
___________ 0(填“>”“=”或“<”),反应Ⅲ的
___________ 。
(3)下列关于尿素合成的说法正确的是___________。
研究反应I的逆反应对提高尿素产率有重要意义。某研究学习小组把一定量的氨基甲酸铵固体放入容积为 的密闭容器中,在
的密闭容器中,在 下分解:
下分解: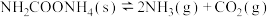 ,
,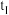 时达到化学平衡。
时达到化学平衡。 随时间
随时间 变化曲线如图所示。
变化曲线如图所示。

(4)可以判断该分解反应已经达到平衡的是___________。
(5) 时,该反应的化学平衡常数
时,该反应的化学平衡常数 的值为
的值为___________ 。
(6)在 时间内该化学反应速率
时间内该化学反应速率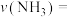
___________ 。
(7)若其他条件不变, 时将容器体积压缩到1L,
时将容器体积压缩到1L, 时达到新的平衡。请在图中画出
时达到新的平衡。请在图中画出 时间内
时间内 随时间
随时间 变化的曲线
变化的曲线___________ 。
 是一种重要的氮肥。工业上以
是一种重要的氮肥。工业上以 和
和 为原料合成尿素,在尿素合成塔中的主要反应可表示如下:
为原料合成尿素,在尿素合成塔中的主要反应可表示如下:反应I:
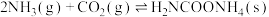 (氨基甲酸铵)
(氨基甲酸铵) 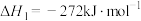
反应Ⅱ:
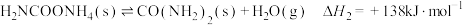
总反应Ⅲ:
(1)
 的电子式为
的电子式为 中含有
中含有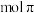 键。
键。(2)反应I的熵变


(3)下列关于尿素合成的说法正确的是___________。
| A.及时分离出尿素可促使反应Ⅱ向正反应方向移动 |
| B.从合成塔出来的混合气体分离出水蒸气后可以循环使用 |
| C.保持容积不变,充入惰性气体增大压强,可提高总反应Ⅲ的反应速率 |
D.保持压强不变,降低氨碳比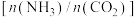 可提高反应I中 可提高反应I中 的平衡转化率 的平衡转化率 |
研究反应I的逆反应对提高尿素产率有重要意义。某研究学习小组把一定量的氨基甲酸铵固体放入容积为
 的密闭容器中,在
的密闭容器中,在 下分解:
下分解: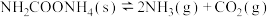 ,
,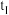 时达到化学平衡。
时达到化学平衡。 随时间
随时间 变化曲线如图所示。
变化曲线如图所示。
(4)可以判断该分解反应已经达到平衡的是___________。
| A.混合气体的平均摩尔质量不变 | B.密闭容器中总压强不变 |
| C.密闭容器中混合气体的密度不变 | D.密闭容器中氮气的体积分数不变 |
(5)
 时,该反应的化学平衡常数
时,该反应的化学平衡常数 的值为
的值为(6)在
 时间内该化学反应速率
时间内该化学反应速率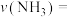
(7)若其他条件不变,
 时将容器体积压缩到1L,
时将容器体积压缩到1L, 时达到新的平衡。请在图中画出
时达到新的平衡。请在图中画出 时间内
时间内 随时间
随时间 变化的曲线
变化的曲线
您最近一年使用:0次
名校
解题方法
4 . 由H、C、N、O、S等元素形成的多种化合物在生产生活中有着重要应用。
Ⅰ.化工生产中用甲烷和水蒸气反应得到以CO和H2为主的混合气体,这种混合气体可用于生产甲醇。对甲烷而言,有如下两个主要反应:
①

②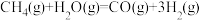

(1)若不考虑热量耗散,物料转化率均为100%,最终炉中出来的气体只有CO、H2,假设体系温度不变,则参与反应的O2(g)与H2O(g)的体积比为___________ ;当生成1molCO,转移电子的数目为___________ 。
Ⅱ.甲醇催化脱氢可制得重要的化工产品——甲醛,制备过程中能量的转化关系如图所示。

(2)写出上述反应的热化学方程式___________ 。
(3)该反应的△H___________ 0(填“<”或“>”);过程I的活化能为___________ ;反应热大小比较:过程I___________ (填“>”“<”或“=”)过程Ⅱ。
Ⅰ.化工生产中用甲烷和水蒸气反应得到以CO和H2为主的混合气体,这种混合气体可用于生产甲醇。对甲烷而言,有如下两个主要反应:
①


②
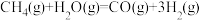

(1)若不考虑热量耗散,物料转化率均为100%,最终炉中出来的气体只有CO、H2,假设体系温度不变,则参与反应的O2(g)与H2O(g)的体积比为
Ⅱ.甲醇催化脱氢可制得重要的化工产品——甲醛,制备过程中能量的转化关系如图所示。

(2)写出上述反应的热化学方程式
(3)该反应的△H
您最近一年使用:0次
名校
解题方法
5 . 氮循环为动植物的生长提供所需的营养物质,对生物和人类活动具有重要意义。游离态的氮气很难被植物吸收,将空气中的游离态氮转化为化合态氮的过程称为固氮,固氮的方式主要有天然固氮和人工固氮。
(1)N原子的结构示意图为_____ ,15N核内有_____ 个中子。
(2)大气固氮是在放电或高温下,空气中的N2最终转化为HNO3的过程,请将该转化过程补充完整。
(填化学式):N2→_____ HNO3.
人工固氮目前主要通过工业合成氨来实现。合成氨工业的巨大成功,改变了世界粮食生产的历史,解决了人类因人口增长所需要的粮食。1754年,人类首次在实验室制出了氨,直到1913年,才实现了合成氨的工业化生产。
(3)氨分子的电子式为_____ 。
在Haber-Bosch工艺开发前,Frank于1908年开发了一种通过碳化钙合成氨的方法。
CaCO3(s)+ C(s)=CaC2(s)+
C(s)=CaC2(s)+ CO2(g) ΔH=557.8kJ·mol
CO2(g) ΔH=557.8kJ·mol
CaC2(s)+N2(g)=CaCN2(s)+C(s) ΔH=﹣288.4kJ·mol-1
CaCN2(s)+3H2O(l)=2NH3(g)+CaCO3(s) ΔH=﹣94.2kJ·mol-1
(4)写出以N2、H2O和C为原料合成NH3的反应热化学方程式_____ 。
(5)根据热化学方程式,说明碳化钙合成氨的方法的缺点_____ 。
1913年,Haber-Bosch发明的催化合成氨技术实现了工业化生产:N2(g)+3H2(g) 2NH3(g)
2NH3(g)
(6)关于该反应的ΔH与ΔS判断正确的是_____(单选)。
(7)将N2与H2以体积比1∶3置于密闭容器中发生上述反应,下列能说明反应达到平衡状态的是_____(双选)。
(8)请从化学反应速率与化学平衡的角度,分析工业合成氨条件选择的原因_____ 。
化合态的氮元素在微生物等的作用下最终返回大气,如此反复循环,建立起平衡。
(9)水体中的 ,在反硝化菌作用下与
,在反硝化菌作用下与 反应生成N2,写出发生反应的离子方程式
反应生成N2,写出发生反应的离子方程式_____ 。
(1)N原子的结构示意图为
(2)大气固氮是在放电或高温下,空气中的N2最终转化为HNO3的过程,请将该转化过程补充完整。
(填化学式):N2→
人工固氮目前主要通过工业合成氨来实现。合成氨工业的巨大成功,改变了世界粮食生产的历史,解决了人类因人口增长所需要的粮食。1754年,人类首次在实验室制出了氨,直到1913年,才实现了合成氨的工业化生产。
(3)氨分子的电子式为
在Haber-Bosch工艺开发前,Frank于1908年开发了一种通过碳化钙合成氨的方法。
CaCO3(s)+
 C(s)=CaC2(s)+
C(s)=CaC2(s)+ CO2(g) ΔH=557.8kJ·mol
CO2(g) ΔH=557.8kJ·molCaC2(s)+N2(g)=CaCN2(s)+C(s) ΔH=﹣288.4kJ·mol-1
CaCN2(s)+3H2O(l)=2NH3(g)+CaCO3(s) ΔH=﹣94.2kJ·mol-1
(4)写出以N2、H2O和C为原料合成NH3的反应热化学方程式
(5)根据热化学方程式,说明碳化钙合成氨的方法的缺点
1913年,Haber-Bosch发明的催化合成氨技术实现了工业化生产:N2(g)+3H2(g)
 2NH3(g)
2NH3(g)(6)关于该反应的ΔH与ΔS判断正确的是_____(单选)。
| A.ΔH与ΔS均大于0 | B.ΔH与ΔS均小于0 |
| C.ΔH大于0,ΔS小于0 | D.ΔH小于0,ΔS大于0 |
| A.体系压强保持不变 |
| B.混合气体密度保持不变 |
| C.N2和H2的体积比保持不变 |
| D.混合气体的平均相对分子质量保持不变 |
化合态的氮元素在微生物等的作用下最终返回大气,如此反复循环,建立起平衡。
(9)水体中的
 ,在反硝化菌作用下与
,在反硝化菌作用下与 反应生成N2,写出发生反应的离子方程式
反应生成N2,写出发生反应的离子方程式
您最近一年使用:0次
22-23高二下·上海徐汇·期中
名校
6 . 化学反应都会伴随能量变化,还可以进行化学能与热能、电能、光能等各种形式能量之间的转化。
(1)化学家借助太阳能产生的电能和热能,用空气和水作原料成功地合成了氨气。下列说法错误的是_______
(2)下列反应中,生成物总能量高于反应物总能量的是_______
(3)研究表明,在一定条件下,气态HCN(a)与HNC(b)两种分子的互变反应过程能量变化如图所示。下列说法正确的是_______
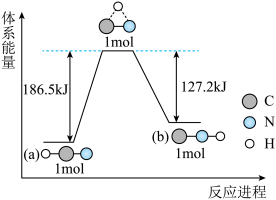
(4)已知乙炔与苯蒸气完全燃烧的热化学方程式如下所示:
①
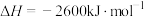
②
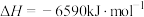
①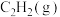 的燃烧热为
的燃烧热为___________ 。
②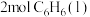 完全燃烧生成液态水时
完全燃烧生成液态水时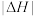
___________ 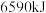 (填“>、<或=”,下同),相同条件下,等质量
(填“>、<或=”,下同),相同条件下,等质量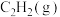 与
与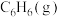 完全燃烧,热值:
完全燃烧,热值: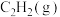
___________ 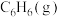 。
。
③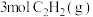 转化为
转化为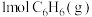 反应的
反应的
___________  。
。
(5) 是大气污染物之一,通过化学方法消除污染是当今环境化学研究的热点:
是大气污染物之一,通过化学方法消除污染是当今环境化学研究的热点: 产生的原因之一是汽车发动机工作时引发
产生的原因之一是汽车发动机工作时引发 和
和 反应,根据表中数据,书写反应的热化学方程式:
反应,根据表中数据,书写反应的热化学方程式:___________ 。
(6)科学家探索利用燃料气体中的甲烷等将氮的氧化物还原为氮气和水,反应机理为:

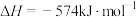
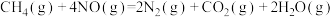
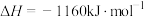
则甲烷直接将 还原为
还原为 的热化学方程式为
的热化学方程式为___________ 。
(1)化学家借助太阳能产生的电能和热能,用空气和水作原料成功地合成了氨气。下列说法错误的是_______
| A.该过程中电能转化为了化学能 | B.该过程属于氮的固定 |
| C.太阳能为可再生资源 | D.断裂 键会释放出能量 键会释放出能量 |
| A.强酸强碱的中和反应 | B.酒精燃烧 |
C.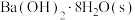 与氯化铵(s)混合 与氯化铵(s)混合 | D. 催化氧化制取 催化氧化制取 |

A.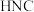 比 比 更稳定 更稳定 |
B. 转化为 转化为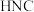 ,反应条件一定要加热 ,反应条件一定要加热 |
C. 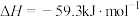 |
| D.加入催化剂,可以减小反应的热效应 |
①

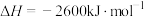
②

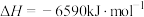
①
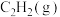 的燃烧热为
的燃烧热为②
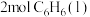 完全燃烧生成液态水时
完全燃烧生成液态水时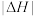
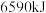 (填“>、<或=”,下同),相同条件下,等质量
(填“>、<或=”,下同),相同条件下,等质量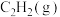 与
与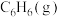 完全燃烧,热值:
完全燃烧,热值: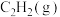
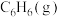 。
。③
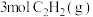 转化为
转化为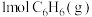 反应的
反应的
 。
。(5)
 是大气污染物之一,通过化学方法消除污染是当今环境化学研究的热点:
是大气污染物之一,通过化学方法消除污染是当今环境化学研究的热点: 产生的原因之一是汽车发动机工作时引发
产生的原因之一是汽车发动机工作时引发 和
和 反应,根据表中数据,书写反应的热化学方程式:
反应,根据表中数据,书写反应的热化学方程式:| 物质 |  |  |  |
键能 | 954 | 498 | 630 |

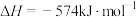
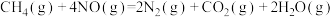
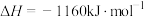
则甲烷直接将
 还原为
还原为 的热化学方程式为
的热化学方程式为
您最近一年使用:0次
22-23高一下·上海宝山·期中
名校
解题方法
7 . 胆矾化学式为CuSO4●5H2O,在我国历代多部医学宝典记载了胆矾的药用价值,比如:《唐本草》:主下血赤白,面黄,女子脏寒,等等。然而,胆矾属于重金属化合物,稍有不慎会使人中毒。
已知:胆矾溶于水时, kJ/mol;
kJ/mol; 溶于水时
溶于水时 kJ/mol。
kJ/mol。
(1)写出CuSO4●5H2O晶体转化为无水CuSO4的热化学方程式___________ 。
(2)测定胆矾中结晶水含量时,坩埚中附着有热稳定性杂质,则测定结果___________ (填“偏高”“偏低”“无影响”)。
(3)加热时,胆矾完全失水的标志是___________ 。
已知:胆矾溶于水时,
 kJ/mol;
kJ/mol; 溶于水时
溶于水时 kJ/mol。
kJ/mol。(1)写出CuSO4●5H2O晶体转化为无水CuSO4的热化学方程式
(2)测定胆矾中结晶水含量时,坩埚中附着有热稳定性杂质,则测定结果
(3)加热时,胆矾完全失水的标志是
您最近一年使用:0次
名校
解题方法
8 . (一)2021年度中国科学十大进展之一就是人工淀粉合成途径的研究,其关键步骤之一就是利用CO2合成出有机小分子。这将有利于我国实现碳达峰碳中和,有利于建设友好型社会。如CO2可与H2生成CH4:CO2(g)+4H2(g) CH4(g)+2H2O(g)。
CH4(g)+2H2O(g)。
(1)写出该反应的平衡常数表达式K=_______ 。
(2)在恒温(T>100℃)恒容装置中进行该反应,能判断反应已达平衡状态的是_______。
(3)将1mol CO2和4mol H2置于体积为2L的密闭容器中发生反应,测得H2O(g)的物质的量分数与温度的关系如图所示,该反应的平衡常数K随温度升高而_______ (填“增大”或“减小”)。
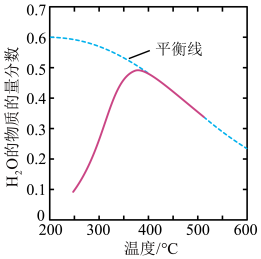
(4)下列措施有利于提高反应中CO2的平衡转化率的是_______。
(二)我国科研人员提出了由CO2和CH4转化为高附加值产品CH3COOH的催化反应历程。该历程示意图如下:
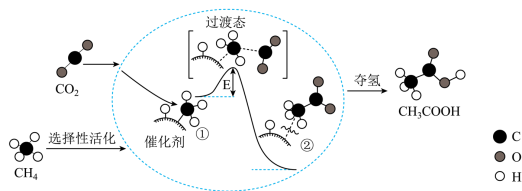
(5)①、②与过滤态三种物质中,最不稳定的是_______ ;①转化为②过程中_______ (选填“吸收”或“放出”)能量。
(6)25℃时,100kPa下,CH4(g)、CH3COOH(l)的燃烧热分别-893kJ·mol-1、-870kJ·mol-1,计算转化反应CO2(g)+CH4(g)=CH3COOH(l)的焓变
_______ kJ·mol-1。该转化反应的熵变
_______ 0(填“>”“<”或“=”),对该转化反应自发性的判断正确的是_______ (单选)。
A. 高温下自发 B. 低温下自发 C. 始终自发 D. 始终不自发
 CH4(g)+2H2O(g)。
CH4(g)+2H2O(g)。(1)写出该反应的平衡常数表达式K=
(2)在恒温(T>100℃)恒容装置中进行该反应,能判断反应已达平衡状态的是_______。
| A.混合气体密度不再改变 | B.混合气体压强不再改变 |
| C.混合气体平均摩尔质量不再改变 | D.n(CO2):n(H2)=1:4 |

(4)下列措施有利于提高反应中CO2的平衡转化率的是_______。
| A.使用催化剂 | B.加压 |
| C.升高温度 | D.增大初始投料比n(CO2)/n(H2) |
(二)我国科研人员提出了由CO2和CH4转化为高附加值产品CH3COOH的催化反应历程。该历程示意图如下:

(5)①、②与过滤态三种物质中,最不稳定的是
(6)25℃时,100kPa下,CH4(g)、CH3COOH(l)的燃烧热分别-893kJ·mol-1、-870kJ·mol-1,计算转化反应CO2(g)+CH4(g)=CH3COOH(l)的焓变


A. 高温下自发 B. 低温下自发 C. 始终自发 D. 始终不自发
您最近一年使用:0次
9 . 环戊二烯( )重要的有机合成中间体。一定条件下,存在以下转化:
)重要的有机合成中间体。一定条件下,存在以下转化:
反应①:

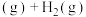

反应②: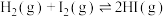

反应③:



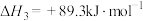
(1)反应①的
_______  。
。
(2)反应③的化学平衡常数表达式
_______ 。
(3)在恒温恒容的容器中,当反应②达到化学平衡时,则下列一定正确的是_______ 。
a.气体分子数不变 b.
c. d.断裂
d.断裂 键的同时断裂
键的同时断裂 键
键
(4)恒温恒容时, 和
和
 (g)发生反应③,测得平衡时容器内压强变为起始的1.2倍,则环戊烯的转化率为
(g)发生反应③,测得平衡时容器内压强变为起始的1.2倍,则环戊烯的转化率为_______ 。
(5)欲提高反应③的正反应速率,且K值不变,可采取的措施有_______ (选填编号)。
a.通入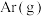 b.升高温度
b.升高温度
c.提高环戊烯浓度 d.分离出
(6)已知两分子环戊二烯易发生加成反应形成二聚体。不同温度下在 容器中环戊二烯物质的量与反应时间的关系如图所示。推测
容器中环戊二烯物质的量与反应时间的关系如图所示。推测
_______  (选填=、<或>);
(选填=、<或>); 时,用二聚体表示
时,用二聚体表示 的平均反应速率
的平均反应速率
_______ 。

 )重要的有机合成中间体。一定条件下,存在以下转化:
)重要的有机合成中间体。一定条件下,存在以下转化:反应①:

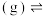

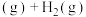

反应②:
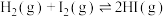

反应③:




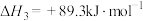
(1)反应①的

 。
。(2)反应③的化学平衡常数表达式

(3)在恒温恒容的容器中,当反应②达到化学平衡时,则下列一定正确的是
a.气体分子数不变 b.

c.
 d.断裂
d.断裂 键的同时断裂
键的同时断裂 键
键(4)恒温恒容时,
 和
和
 (g)发生反应③,测得平衡时容器内压强变为起始的1.2倍,则环戊烯的转化率为
(g)发生反应③,测得平衡时容器内压强变为起始的1.2倍,则环戊烯的转化率为(5)欲提高反应③的正反应速率,且K值不变,可采取的措施有
a.通入
 b.升高温度
b.升高温度c.提高环戊烯浓度 d.分离出

(6)已知两分子环戊二烯易发生加成反应形成二聚体。不同温度下在
 容器中环戊二烯物质的量与反应时间的关系如图所示。推测
容器中环戊二烯物质的量与反应时间的关系如图所示。推测
 (选填=、<或>);
(选填=、<或>); 时,用二聚体表示
时,用二聚体表示 的平均反应速率
的平均反应速率

您最近一年使用:0次
名校
解题方法
10 . 化学反应的研究视角多种多样,指导着我们的生产和生活。
(1)以 和
和 为原料合成尿素是固定和利用
为原料合成尿素是固定和利用 的成功范例。在尿素合成塔中的主要反应可表示如下:
的成功范例。在尿素合成塔中的主要反应可表示如下:
反应I: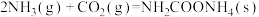

反应II: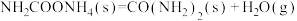

已知:
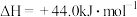
请回答下列问题:
写出 和
和 为原料生成尿素和液态水的热化学方程式:
为原料生成尿素和液态水的热化学方程式:_______ ,反应II自发进行的条件是:_______ 温。(选填“高”或“低”)
(2)如图表示氧族元素中的氧、硫、硒、碲在生成 气态氢化物时的焓变数据,根据焓变数据可确定b代表的氢化物的化学式为:
气态氢化物时的焓变数据,根据焓变数据可确定b代表的氢化物的化学式为:_______ 。

 可用于合成甲醇,化学方程式为
可用于合成甲醇,化学方程式为 。
。
(3)图1是不同温度下 的转化率随时间变化的曲线。
的转化率随时间变化的曲线。

①由图1可知:
_______  ;该反应的焓变
;该反应的焓变
_______ 0 (均填“>”、“<”或“=”)。
②在 温度下,往体积为
温度下,往体积为 的密闭容器中,充入
的密闭容器中,充入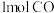 和
和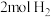 ,测得
,测得 和
和 的物质的量随时间变化如图2所示,则
的物质的量随时间变化如图2所示,则 ,用氢气表示的平均反应速率为:
,用氢气表示的平均反应速率为:_______  ,
, 温度下,反应的平衡常数为
温度下,反应的平衡常数为_______ 。
③若保持容器体积不变,再充 和
和 ,此时
,此时
_______  (填“>”“<”或“=”)。
(填“>”“<”或“=”)。
(4)若容器容积不变,下列措施可增加 转化率的是
转化率的是_______ (填字母)。
a.升高温度 b.将 从体系中分离
从体系中分离
c.使用合适的催化剂 d.充入 ,使体系总压强增大
,使体系总压强增大
e.充入
(5) 在不同温度下的平衡转化率与压强的关系如图所示。实际生产条件控制在250℃、
在不同温度下的平衡转化率与压强的关系如图所示。实际生产条件控制在250℃、 左右,选择此压强的理由是
左右,选择此压强的理由是_______ 。

(1)以
 和
和 为原料合成尿素是固定和利用
为原料合成尿素是固定和利用 的成功范例。在尿素合成塔中的主要反应可表示如下:
的成功范例。在尿素合成塔中的主要反应可表示如下:反应I:
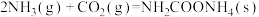

反应II:
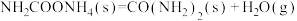

已知:

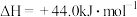
请回答下列问题:
写出
 和
和 为原料生成尿素和液态水的热化学方程式:
为原料生成尿素和液态水的热化学方程式:(2)如图表示氧族元素中的氧、硫、硒、碲在生成
 气态氢化物时的焓变数据,根据焓变数据可确定b代表的氢化物的化学式为:
气态氢化物时的焓变数据,根据焓变数据可确定b代表的氢化物的化学式为:
 可用于合成甲醇,化学方程式为
可用于合成甲醇,化学方程式为 。
。(3)图1是不同温度下
 的转化率随时间变化的曲线。
的转化率随时间变化的曲线。
①由图1可知:

 ;该反应的焓变
;该反应的焓变
②在
 温度下,往体积为
温度下,往体积为 的密闭容器中,充入
的密闭容器中,充入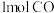 和
和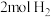 ,测得
,测得 和
和 的物质的量随时间变化如图2所示,则
的物质的量随时间变化如图2所示,则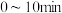 ,用氢气表示的平均反应速率为:
,用氢气表示的平均反应速率为: ,
, 温度下,反应的平衡常数为
温度下,反应的平衡常数为③若保持容器体积不变,再充
 和
和 ,此时
,此时
 (填“>”“<”或“=”)。
(填“>”“<”或“=”)。(4)若容器容积不变,下列措施可增加
 转化率的是
转化率的是a.升高温度 b.将
 从体系中分离
从体系中分离c.使用合适的催化剂 d.充入
 ,使体系总压强增大
,使体系总压强增大e.充入

(5)
 在不同温度下的平衡转化率与压强的关系如图所示。实际生产条件控制在250℃、
在不同温度下的平衡转化率与压强的关系如图所示。实际生产条件控制在250℃、 左右,选择此压强的理由是
左右,选择此压强的理由是
您最近一年使用:0次



