名校
解题方法
1 . 近年来,碳中和、碳达峰成为热点。以CO2、H2为原料生产甲醇是一种有效利用二氧化碳的途径。
途径一:涉及的反应有
I.
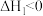
Ⅱ.

III.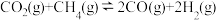
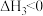
(1)关于反应I,下列描述正确的是___________(填字母序号)。
(2)根据反应I~Ⅲ,计算 ΔH=
ΔH=___________ 。
(3)工业中,对于反应I,通常同时存在副反应IV: ΔH4。在一定条件下,在合成塔中充入一定量CO2和H2。不同压强时,CO2的平衡转化率如图a所示。当气体总压强恒定为1MPa时,平衡时各物质的物质的量分数如图b所示。
ΔH4。在一定条件下,在合成塔中充入一定量CO2和H2。不同压强时,CO2的平衡转化率如图a所示。当气体总压强恒定为1MPa时,平衡时各物质的物质的量分数如图b所示。

①图a中,相同温度下,压强越大,CO2的平衡转化率越大,其原因是___________ 。
②由图b可知,ΔH4___________ 0(填“>”、“<”或“=”);H2的物质的量分数随温度升高而增大,原因是___________ 。
(4)在一定条件下(温度为T1℃),往恒容密闭容器中充入1.0molCO2和4.0molH2,发生反应I,初始压强为p0,5min达到平衡,压强为0.8p0,则CO2的平衡转化率为___________ 。
途径二:涉及的反应有
I.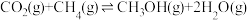
Ⅱ.
III.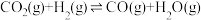
(5)一定条件下,向体积为VL的恒容密闭容器中通入1molCO2和3molH2发生上述反应,达到平行时,容器中CH3OH(g)为amol,CO为bmol,反应Ⅲ的平衡常数为___________ (用含a、b、V的代数式表示)。
途径一:涉及的反应有
I.

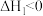
Ⅱ.


III.
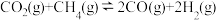
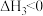
(1)关于反应I,下列描述正确的是___________(填字母序号)。
| A.恒容下达平衡状态时,再充入少量氦气,正逆反应速率不变 |
| B.当混合气体的平均摩尔质量不再发生变化时,反应达平衡状态 |
| C.当反应达平衡状态时,2V正(H2)=V逆(H2O) |
| D.恒温下缩小容器体积,反应物的活化分子百分数增大 |
 ΔH=
ΔH=(3)工业中,对于反应I,通常同时存在副反应IV:
 ΔH4。在一定条件下,在合成塔中充入一定量CO2和H2。不同压强时,CO2的平衡转化率如图a所示。当气体总压强恒定为1MPa时,平衡时各物质的物质的量分数如图b所示。
ΔH4。在一定条件下,在合成塔中充入一定量CO2和H2。不同压强时,CO2的平衡转化率如图a所示。当气体总压强恒定为1MPa时,平衡时各物质的物质的量分数如图b所示。
①图a中,相同温度下,压强越大,CO2的平衡转化率越大,其原因是
②由图b可知,ΔH4
(4)在一定条件下(温度为T1℃),往恒容密闭容器中充入1.0molCO2和4.0molH2,发生反应I,初始压强为p0,5min达到平衡,压强为0.8p0,则CO2的平衡转化率为
途径二:涉及的反应有
I.
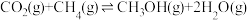
Ⅱ.

III.
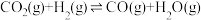
(5)一定条件下,向体积为VL的恒容密闭容器中通入1molCO2和3molH2发生上述反应,达到平行时,容器中CH3OH(g)为amol,CO为bmol,反应Ⅲ的平衡常数为
您最近一年使用:0次
2 . 资源化利用 ,不仅可以减少温室气体的排放,还可以获得燃料或重要的化工产品.回答下列问题.
,不仅可以减少温室气体的排放,还可以获得燃料或重要的化工产品.回答下列问题.
(1)理论研究表明,在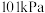 和
和 下,
下, 异构化反应过程的能量变化如图所示:计算可得
异构化反应过程的能量变化如图所示:计算可得
_____________  ,
, 与
与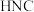 稳定性较强的是
稳定性较强的是_____________ . 吸附剂.
吸附剂.结合下图 分析聚合离子液体吸附 的有利条件是
的有利条件是_____________ .
工业上以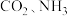 为原料生产尿素
为原料生产尿素 ,该反应分为二步进行:
,该反应分为二步进行:
第一步: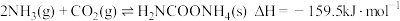
第二步: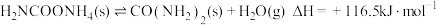
①写出上述合成尿素的热化学方程式_____________ .
②某实验小组模拟工业上合成尿素,在一定体积的密闭容器中投入 和
和 ,实验测得反应中各组分物质的量随时间的变化如下图所示:
,实验测得反应中各组分物质的量随时间的变化如下图所示:_____________ 步反应决定,总反应进行到_____________  时到达平衡.
时到达平衡.
(4)合成乙酸:
中国科学家首次以 和
和 为原料高效合成乙酸,其反应路径如下图所示:
为原料高效合成乙酸,其反应路径如下图所示:根据图示 ,写出总反应的化学方程式_____________ .
 ,不仅可以减少温室气体的排放,还可以获得燃料或重要的化工产品.回答下列问题.
,不仅可以减少温室气体的排放,还可以获得燃料或重要的化工产品.回答下列问题.(1)理论研究表明,在
 和
和 下,
下, 异构化反应过程的能量变化如图所示:计算可得
异构化反应过程的能量变化如图所示:计算可得
 ,
, 与
与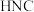 稳定性较强的是
稳定性较强的是
 吸附剂.
吸附剂. 的有利条件是
的有利条件是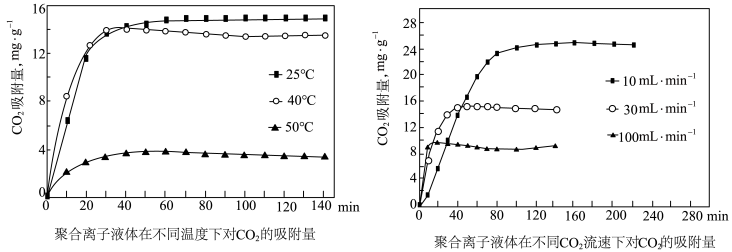
工业上以
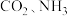 为原料生产尿素
为原料生产尿素 ,该反应分为二步进行:
,该反应分为二步进行:第一步:
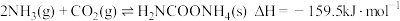
第二步:
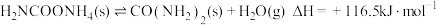
①写出上述合成尿素的热化学方程式
②某实验小组模拟工业上合成尿素,在一定体积的密闭容器中投入
 和
和 ,实验测得反应中各组分物质的量随时间的变化如下图所示:
,实验测得反应中各组分物质的量随时间的变化如下图所示: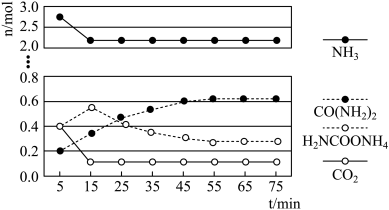
 时到达平衡.
时到达平衡.(4)合成乙酸:
中国科学家首次以
 和
和 为原料高效合成乙酸,其反应路径如下图所示:
为原料高效合成乙酸,其反应路径如下图所示: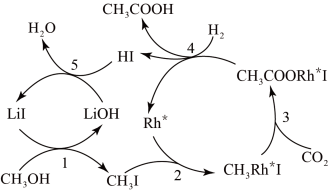
您最近一年使用:0次
3 . 二氧化碳的回收利用是环保领域研究的热点课题。结合所学知识回答下列问题:
Ⅰ.利用太阳能实现 制取某些物质是一种非常理想的
制取某些物质是一种非常理想的 减排途径。
减排途径。
(1)在太阳能的作用下,以 为原料制取炭黑的流程如图所示。其总反应的化学方程式为
为原料制取炭黑的流程如图所示。其总反应的化学方程式为___________ 。
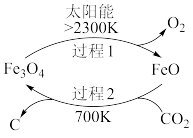
(2)以稀硫酸为电解质溶液,利用太阳能将 转化为低碳烯烃,工作原理如图:
转化为低碳烯烃,工作原理如图:
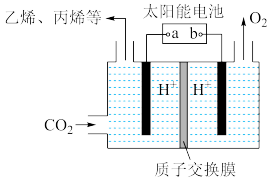
①b是电源的___________ (填“正”或“负”)极。
②生成乙烯( )的电极反应式为
)的电极反应式为___________ 。
③电场作用下,氢离子从___________ (填:“从左到右”或“从右到左”)移动。
Ⅱ.通过化学的方法实现 的资源化利用也是一种非常理想的
的资源化利用也是一种非常理想的 减排途径。
减排途径。
(3)工业上用 和
和 反应合成二甲醚。已知:
反应合成二甲醚。已知:
 ;
;
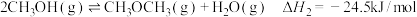 。
。
则 反应的
反应的
___________  。
。
(4)已知该反应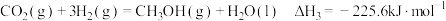 ,在恒温恒压下进行,以下叙述能说明该反应达到平衡状态的是___________(填序号)。
,在恒温恒压下进行,以下叙述能说明该反应达到平衡状态的是___________(填序号)。
(5)工业上用 和
和 反应合成甲醇
反应合成甲醇
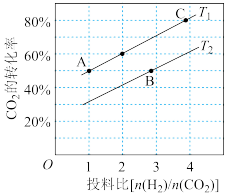
 ,在2L刚性密闭容器中,不同温度、不同投料比时,
,在2L刚性密闭容器中,不同温度、不同投料比时, 的平衡转化率如图所示。
的平衡转化率如图所示。 温度下,将
温度下,将 和
和 充入该密闭容器中,
充入该密闭容器中, 后反应达到平衡状态,则0-5min内的用甲醇表示的平均反应速率为
后反应达到平衡状态,则0-5min内的用甲醇表示的平均反应速率为___________ ;反应的平衡常数
___________ ,从图中可知:
___________  (填>或<或=,判断的依据是
(填>或<或=,判断的依据是___________ , 、
、 、
、 三者之间的大小关系为
三者之间的大小关系为___________ 。
Ⅰ.利用太阳能实现
 制取某些物质是一种非常理想的
制取某些物质是一种非常理想的 减排途径。
减排途径。(1)在太阳能的作用下,以
 为原料制取炭黑的流程如图所示。其总反应的化学方程式为
为原料制取炭黑的流程如图所示。其总反应的化学方程式为
(2)以稀硫酸为电解质溶液,利用太阳能将
 转化为低碳烯烃,工作原理如图:
转化为低碳烯烃,工作原理如图:
①b是电源的
②生成乙烯(
 )的电极反应式为
)的电极反应式为③电场作用下,氢离子从
Ⅱ.通过化学的方法实现
 的资源化利用也是一种非常理想的
的资源化利用也是一种非常理想的 减排途径。
减排途径。(3)工业上用
 和
和 反应合成二甲醚。已知:
反应合成二甲醚。已知: ;
;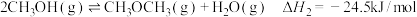 。
。则
 反应的
反应的
 。
。(4)已知该反应
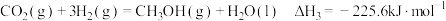 ,在恒温恒压下进行,以下叙述能说明该反应达到平衡状态的是___________(填序号)。
,在恒温恒压下进行,以下叙述能说明该反应达到平衡状态的是___________(填序号)。A. 和 和 的物质的量浓度之比是 的物质的量浓度之比是 |
| B.容器中混合气体的平均摩尔质量保持不变 |
| C.容器中混合气体的体积保持不变 |
D. 的消耗速率等于 的消耗速率等于 的生成速率的3倍 的生成速率的3倍 |
(5)工业上用
 和
和 反应合成甲醇
反应合成甲醇 ,在2L刚性密闭容器中,不同温度、不同投料比时,
,在2L刚性密闭容器中,不同温度、不同投料比时, 的平衡转化率如图所示。
的平衡转化率如图所示。 温度下,将
温度下,将 和
和 充入该密闭容器中,
充入该密闭容器中, 后反应达到平衡状态,则0-5min内的用甲醇表示的平均反应速率为
后反应达到平衡状态,则0-5min内的用甲醇表示的平均反应速率为

 (填>或<或=,判断的依据是
(填>或<或=,判断的依据是 、
、 、
、 三者之间的大小关系为
三者之间的大小关系为
您最近一年使用:0次
4 . 采取高效经济方式利用 对人类社会发展具有重要意义。以
对人类社会发展具有重要意义。以 和
和 为原料合成甲醇主要发生反应Ⅰ和反应Ⅱ(不考虑其他反应):
为原料合成甲醇主要发生反应Ⅰ和反应Ⅱ(不考虑其他反应):
Ⅰ.

Ⅱ.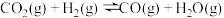
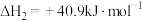
回答以下问题:
(1)已知: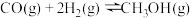
 ,则反应Ⅰ的
,则反应Ⅰ的
___________  。
。
(2)有利于提高 平衡转化率的措施有___________(填标号)。
平衡转化率的措施有___________(填标号)。
(3)在催化剂作用下,测得 平衡转化率(曲线Y)和平衡时
平衡转化率(曲线Y)和平衡时 的选择性(曲线X)随温度变化如图所示。(已知:
的选择性(曲线X)随温度变化如图所示。(已知: 的选择性
的选择性 )
)

① 加氢制
加氢制 时,温度选择
时,温度选择 的原因为
的原因为___________ 。
②510K时,往恒容密闭容器中按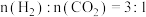 充入
充入 和
和 ,若平衡时容器内
,若平衡时容器内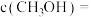
 ,则反应Ⅰ的平衡常数
,则反应Ⅰ的平衡常数
___________ (列计算式即可)。
(4) 和
和 在某催化剂表面合成甲醇(反应Ⅰ)的反应历程如图所示,其中吸附在催化剂表面上的物种用*标注,“TS”表示过渡状态。
在某催化剂表面合成甲醇(反应Ⅰ)的反应历程如图所示,其中吸附在催化剂表面上的物种用*标注,“TS”表示过渡状态。
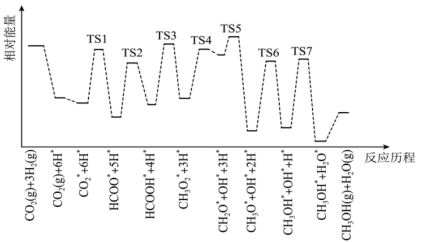
①气体在催化剂表面的吸附是___________ (填“吸热”或“放热”)过程。
②该反应历程中反应速率最快步骤的化学方程式为___________ 。
(5)甲醇催化制取丙烯( )的过程中发生如下反应:
)的过程中发生如下反应:
Ⅰ.
Ⅱ.
反应Ⅰ的Arrhenius经验公式的实验数据如图所示,已知Arrhenius经验公式为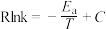 (
( 为活化能,
为活化能, 为速率常数,R和C为常数)。当改变外界条件时,实验数据由图中直线a变为直线b,则实验可能改变的外界条件是
为速率常数,R和C为常数)。当改变外界条件时,实验数据由图中直线a变为直线b,则实验可能改变的外界条件是___________ 。

 对人类社会发展具有重要意义。以
对人类社会发展具有重要意义。以 和
和 为原料合成甲醇主要发生反应Ⅰ和反应Ⅱ(不考虑其他反应):
为原料合成甲醇主要发生反应Ⅰ和反应Ⅱ(不考虑其他反应):Ⅰ.


Ⅱ.
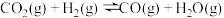
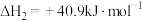
回答以下问题:
(1)已知:
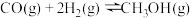
 ,则反应Ⅰ的
,则反应Ⅰ的
 。
。(2)有利于提高
 平衡转化率的措施有___________(填标号)。
平衡转化率的措施有___________(填标号)。A.增大 投料比 投料比 | B.增大压强 |
| C.使用高效催化剂 | D.及时将 分离 分离 |
 平衡转化率(曲线Y)和平衡时
平衡转化率(曲线Y)和平衡时 的选择性(曲线X)随温度变化如图所示。(已知:
的选择性(曲线X)随温度变化如图所示。(已知: 的选择性
的选择性 )
)
①
 加氢制
加氢制 时,温度选择
时,温度选择 的原因为
的原因为②510K时,往恒容密闭容器中按
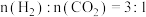 充入
充入 和
和 ,若平衡时容器内
,若平衡时容器内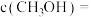
 ,则反应Ⅰ的平衡常数
,则反应Ⅰ的平衡常数
(4)
 和
和 在某催化剂表面合成甲醇(反应Ⅰ)的反应历程如图所示,其中吸附在催化剂表面上的物种用*标注,“TS”表示过渡状态。
在某催化剂表面合成甲醇(反应Ⅰ)的反应历程如图所示,其中吸附在催化剂表面上的物种用*标注,“TS”表示过渡状态。
①气体在催化剂表面的吸附是
②该反应历程中反应速率最快步骤的化学方程式为
(5)甲醇催化制取丙烯(
 )的过程中发生如下反应:
)的过程中发生如下反应:Ⅰ.

Ⅱ.

反应Ⅰ的Arrhenius经验公式的实验数据如图所示,已知Arrhenius经验公式为
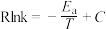 (
( 为活化能,
为活化能, 为速率常数,R和C为常数)。当改变外界条件时,实验数据由图中直线a变为直线b,则实验可能改变的外界条件是
为速率常数,R和C为常数)。当改变外界条件时,实验数据由图中直线a变为直线b,则实验可能改变的外界条件是
您最近一年使用:0次
5 . 甲醇是重要的化工基础原料和清洁液体燃料,在 加氢合成
加氢合成 的体系中,同时发生下列竞争反应:
的体系中,同时发生下列竞争反应:
(ⅰ)
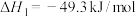
(ⅱ)
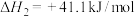
由CO也能直接加氢合成甲醇:(ⅲ)

(1)
_____ kJ/mol。
(2)反应(ⅱ) 的正、逆反应平衡常数随温度变化曲线如图所示。
的正、逆反应平衡常数随温度变化曲线如图所示。
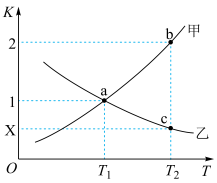
下列分析正确的是______ 。
A.曲线甲为K(逆),曲线乙为K(正) B.a点时,一定有 C.c点时,x=0.5
C.c点时,x=0.5
(3)催化剂M、N对 反应进程的能量影响如下图(a)所示,两种催化剂对应的
反应进程的能量影响如下图(a)所示,两种催化剂对应的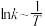 关系如下图(b)所示(已知;
关系如下图(b)所示(已知; ,其中
,其中 为活化能,k为速率常数,R和C为常数)。
为活化能,k为速率常数,R和C为常数)。
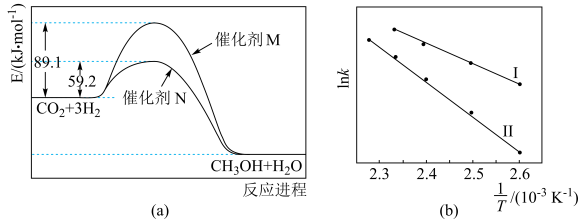
①使用催化剂M时,逆反应的活化能为______ kJ/mol。
②催化剂N对应曲线是图(b)中的______ (填“Ⅰ”或“Ⅱ”)
(4)为进一步研究 与
与 反应制
反应制 的过程中原料气组成对反应速率的影响,分别向三个压强恒定为P的密闭容器(装有等量催化剂,且在实验温度范围内催化剂活性变化不大)中通入相同碳氢比的三种混合气,相同时间内。测得生成甲醇的速率与温度的关系如图所示。
的过程中原料气组成对反应速率的影响,分别向三个压强恒定为P的密闭容器(装有等量催化剂,且在实验温度范围内催化剂活性变化不大)中通入相同碳氢比的三种混合气,相同时间内。测得生成甲醇的速率与温度的关系如图所示。
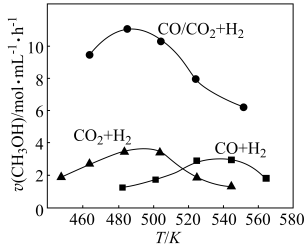
①三个容器中,甲醇的生成速率达峰值后均随温度升高而下降的原因是_______ 。
②结合研究目的,参照图中三条曲线,你可得出的结论是____ (写一条)。
(5)恒温下,在压强恒定为P的装置中,按 加入反应物,发生反应(ⅰ)、(ⅱ)。达到平衡时,若
加入反应物,发生反应(ⅰ)、(ⅱ)。达到平衡时,若 转化率为20%,甲醇的选择性为50%。列出反应(ⅰ)
转化率为20%,甲醇的选择性为50%。列出反应(ⅰ)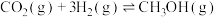
 的平衡常数计算式:
的平衡常数计算式:
______ (不必化简)。(已知: 的选择性
的选择性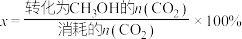 ;
; 为用分压代替浓度的平衡常数。)
为用分压代替浓度的平衡常数。)
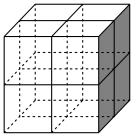
(6) 是一种贮氢的金属氢化物,可通过氢化镁和镍单质球磨制成。
是一种贮氢的金属氢化物,可通过氢化镁和镍单质球磨制成。 晶胞形状为如图立方体。边长为a nm,Ni原子占据顶点和面心,
晶胞形状为如图立方体。边长为a nm,Ni原子占据顶点和面心, 处于八个小立方体的体心。
处于八个小立方体的体心。
①Ni原子的价电子排布式为______ 。
② 位于Ni原子形成的
位于Ni原子形成的______ (填“八面体空隙”或“四面体空隙”)。
③该晶体的密度为_____  (用含a、
(用含a、 代数式表示)。
代数式表示)。
 加氢合成
加氢合成 的体系中,同时发生下列竞争反应:
的体系中,同时发生下列竞争反应:(ⅰ)

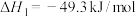
(ⅱ)

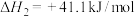
由CO也能直接加氢合成甲醇:(ⅲ)


(1)

(2)反应(ⅱ)
 的正、逆反应平衡常数随温度变化曲线如图所示。
的正、逆反应平衡常数随温度变化曲线如图所示。
下列分析正确的是
A.曲线甲为K(逆),曲线乙为K(正) B.a点时,一定有
 C.c点时,x=0.5
C.c点时,x=0.5(3)催化剂M、N对
 反应进程的能量影响如下图(a)所示,两种催化剂对应的
反应进程的能量影响如下图(a)所示,两种催化剂对应的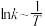 关系如下图(b)所示(已知;
关系如下图(b)所示(已知; ,其中
,其中 为活化能,k为速率常数,R和C为常数)。
为活化能,k为速率常数,R和C为常数)。
①使用催化剂M时,逆反应的活化能为
②催化剂N对应曲线是图(b)中的
(4)为进一步研究
 与
与 反应制
反应制 的过程中原料气组成对反应速率的影响,分别向三个压强恒定为P的密闭容器(装有等量催化剂,且在实验温度范围内催化剂活性变化不大)中通入相同碳氢比的三种混合气,相同时间内。测得生成甲醇的速率与温度的关系如图所示。
的过程中原料气组成对反应速率的影响,分别向三个压强恒定为P的密闭容器(装有等量催化剂,且在实验温度范围内催化剂活性变化不大)中通入相同碳氢比的三种混合气,相同时间内。测得生成甲醇的速率与温度的关系如图所示。
①三个容器中,甲醇的生成速率达峰值后均随温度升高而下降的原因是
②结合研究目的,参照图中三条曲线,你可得出的结论是
(5)恒温下,在压强恒定为P的装置中,按
 加入反应物,发生反应(ⅰ)、(ⅱ)。达到平衡时,若
加入反应物,发生反应(ⅰ)、(ⅱ)。达到平衡时,若 转化率为20%,甲醇的选择性为50%。列出反应(ⅰ)
转化率为20%,甲醇的选择性为50%。列出反应(ⅰ)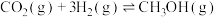
 的平衡常数计算式:
的平衡常数计算式:
 的选择性
的选择性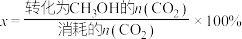 ;
; 为用分压代替浓度的平衡常数。)
为用分压代替浓度的平衡常数。)(6)
 是一种贮氢的金属氢化物,可通过氢化镁和镍单质球磨制成。
是一种贮氢的金属氢化物,可通过氢化镁和镍单质球磨制成。 晶胞形状为如图立方体。边长为a nm,Ni原子占据顶点和面心,
晶胞形状为如图立方体。边长为a nm,Ni原子占据顶点和面心, 处于八个小立方体的体心。
处于八个小立方体的体心。
①Ni原子的价电子排布式为
②
 位于Ni原子形成的
位于Ni原子形成的③该晶体的密度为
 (用含a、
(用含a、 代数式表示)。
代数式表示)。
您最近一年使用:0次
名校
6 . 温室气体让地球发烧,倡导低碳生活,是一种可持续发展的环保责任,将 应用于生产中实现其综合利用是目前的研究热点。
应用于生产中实现其综合利用是目前的研究热点。
(1)在催化作用下由 和
和 转化为
转化为 的反应历程示意图如下图。
的反应历程示意图如下图。

在合成 的反应历程中,下列有关说法正确的是
的反应历程中,下列有关说法正确的是___________ (填字母)。
a.该催化剂使反应的平衡常数增大
b. 过程中,有
过程中,有 键断裂和
键断裂和 键形成
键形成
c.生成乙酸的反应原子利用率等于100%
d.
(2)以 为原料合成
为原料合成 涉及的主要反应如下:
涉及的主要反应如下:
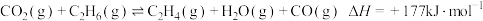 (主反应)
(主反应)
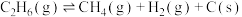
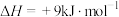 (副反应)
(副反应)
①主反应的反应历程可分为如下两步,反应过程中能量变化如图所示:

i.

ii.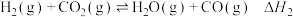

___________ ,主反应的决速步骤为___________ (填“反应i”或“反应ii”)。
②向恒压密闭容器中充入 和
和 ,温度对催化剂K—Fe—Mn/Si—2性能的影响如图所示,工业生产中主反应应选择的温度是
,温度对催化剂K—Fe—Mn/Si—2性能的影响如图所示,工业生产中主反应应选择的温度是___________ 。
 应用于生产中实现其综合利用是目前的研究热点。
应用于生产中实现其综合利用是目前的研究热点。(1)在催化作用下由
 和
和 转化为
转化为 的反应历程示意图如下图。
的反应历程示意图如下图。
在合成
 的反应历程中,下列有关说法正确的是
的反应历程中,下列有关说法正确的是a.该催化剂使反应的平衡常数增大
b.
 过程中,有
过程中,有 键断裂和
键断裂和 键形成
键形成c.生成乙酸的反应原子利用率等于100%
d.

(2)以
 为原料合成
为原料合成 涉及的主要反应如下:
涉及的主要反应如下: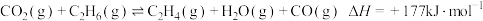 (主反应)
(主反应)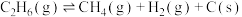
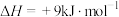 (副反应)
(副反应)①主反应的反应历程可分为如下两步,反应过程中能量变化如图所示:

i.


ii.
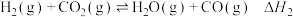

②向恒压密闭容器中充入
 和
和 ,温度对催化剂K—Fe—Mn/Si—2性能的影响如图所示,工业生产中主反应应选择的温度是
,温度对催化剂K—Fe—Mn/Si—2性能的影响如图所示,工业生产中主反应应选择的温度是
您最近一年使用:0次
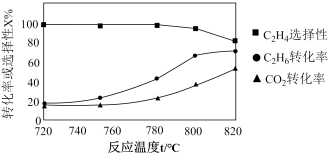
7 . 丙烯是重要的有机合成原料。由丙烷制备丙烯是近年研究的热点,主要涉及如下反应:
反应Ⅰ:2C3H8(g)+O2(g) 2C3H6(g)+2H2O(g) ΔH1= -235 kJ·mol-1
2C3H6(g)+2H2O(g) ΔH1= -235 kJ·mol-1
反应Ⅱ:2C3H8(g)+7O2(g) 6CO(g)+8H2O(g) ΔH2= -2742 kJ·mol-1
6CO(g)+8H2O(g) ΔH2= -2742 kJ·mol-1
回答下列问题:
(1)反应2C3H6(g)+6O2(g) 6CO(g)+6H2O(g)的ΔH=
6CO(g)+6H2O(g)的ΔH=___________ 。
(2)在刚性绝热容器中发生反应Ⅰ,下列叙述能说明反应已达到平衡状态的是___________(填标号)。
(3)在压强恒定为100 kPa条件下,将n(C3H8) n(O2)=2
n(O2)=2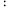 1的混合气体,匀速通入装有催化剂的反应器中发生反应Ⅰ和反应Ⅱ,不同温度下丙烷和氧气的转化率如图所示。
1的混合气体,匀速通入装有催化剂的反应器中发生反应Ⅰ和反应Ⅱ,不同温度下丙烷和氧气的转化率如图所示。
①曲线___________ (填“L1”或“L2”)表示丙烷的转化率。
②温度高于T1 K后曲线L2随温度升高而降低的原因为___________ 。
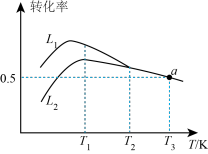
③当温度高于___________ (填“T1”或“T2”)时,反应Ⅱ不再发生,a点对应的温度下,丙烯的分压 p(C3H6) =___________ kPa(保留3位有效数字),反应I的标准平衡常数 Kθ=___________ (已知:分压=总压×该组分物质的量分数,对于反应:dD(g)+eE(g) gG(g)+hH(g),Kθ=
gG(g)+hH(g),Kθ=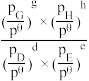 ;其中 pθ=100 kPa,pG、pH、pD、pE为各组分的平衡分压)。
;其中 pθ=100 kPa,pG、pH、pD、pE为各组分的平衡分压)。
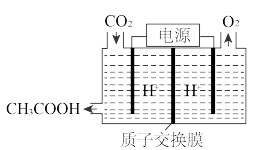
(4)在“碳中和”实施过程中,可将工业生产中产生的CO2气体通过如图所示的电解原理转化成重要的有机物,阴极的电极反应式为___________ 。
反应Ⅰ:2C3H8(g)+O2(g)
 2C3H6(g)+2H2O(g) ΔH1= -235 kJ·mol-1
2C3H6(g)+2H2O(g) ΔH1= -235 kJ·mol-1反应Ⅱ:2C3H8(g)+7O2(g)
 6CO(g)+8H2O(g) ΔH2= -2742 kJ·mol-1
6CO(g)+8H2O(g) ΔH2= -2742 kJ·mol-1回答下列问题:
(1)反应2C3H6(g)+6O2(g)
 6CO(g)+6H2O(g)的ΔH=
6CO(g)+6H2O(g)的ΔH=(2)在刚性绝热容器中发生反应Ⅰ,下列叙述能说明反应已达到平衡状态的是___________(填标号)。
| A.每断裂1 mol O=O键,同时生成4 mol O-H键 | B.容器内温度不再变化 |
| C.混合气体的密度不再变化 | D.n(C3H8) = n(C3H6) |
(3)在压强恒定为100 kPa条件下,将n(C3H8)
 n(O2)=2
n(O2)=2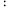 1的混合气体,匀速通入装有催化剂的反应器中发生反应Ⅰ和反应Ⅱ,不同温度下丙烷和氧气的转化率如图所示。
1的混合气体,匀速通入装有催化剂的反应器中发生反应Ⅰ和反应Ⅱ,不同温度下丙烷和氧气的转化率如图所示。
①曲线
②温度高于T1 K后曲线L2随温度升高而降低的原因为
③当温度高于
 gG(g)+hH(g),Kθ=
gG(g)+hH(g),Kθ=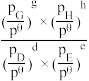 ;其中 pθ=100 kPa,pG、pH、pD、pE为各组分的平衡分压)。
;其中 pθ=100 kPa,pG、pH、pD、pE为各组分的平衡分压)。(4)在“碳中和”实施过程中,可将工业生产中产生的CO2气体通过如图所示的电解原理转化成重要的有机物,阴极的电极反应式为

您最近一年使用:0次
名校
8 . “双碳”目标大背景下,采取高效经济方式利用 对人类社会发展具有重要意义。二氧化碳加氢合成甲醇是重要途径。以
对人类社会发展具有重要意义。二氧化碳加氢合成甲醇是重要途径。以 和
和 为原料合成甲醇主要发生反应I和反应II(不考虑其他反应):
为原料合成甲醇主要发生反应I和反应II(不考虑其他反应):
I.

II.
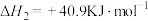
回答以下问题:
(1)已知:
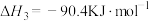 ,则反应I的
,则反应I的
_______ 。
(2)有利于提高 平衡转化率的措施有_______(填标号)。
平衡转化率的措施有_______(填标号)。
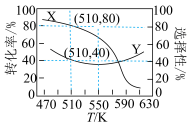
(3)实验测得 平衡转化率(曲线
平衡转化率(曲线 )和平衡时
)和平衡时 的选择性(曲线
的选择性(曲线 )随温度变化如图所示。(已知:
)随温度变化如图所示。(已知: 的选择性
的选择性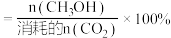 )
)
① 加氢制
加氢制 时,温度选择
时,温度选择 的原因为
的原因为_______ 。
②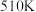 时,往恒容密闭容器中按
时,往恒容密闭容器中按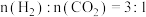 充入
充入 和
和 ,若平衡时容器内
,若平衡时容器内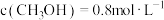 ,则反应
,则反应 的平衡常数
的平衡常数
_______ (列计算式)。
(4) 和
和 在某催化剂表面合成甲醇的反应历程如图所示,其中吸附在催化剂表面上的物种用*标注,“TS”表示过渡状态。
在某催化剂表面合成甲醇的反应历程如图所示,其中吸附在催化剂表面上的物种用*标注,“TS”表示过渡状态。
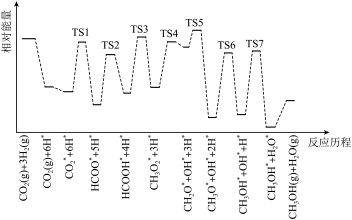
①气体在催化剂表面的吸附是_______ (填“吸热”或“放热”)过程。
②该反应历程中反应速率最快步骤的化学方程式为_______ 。
(5)甲醇脱水可制得二甲醚: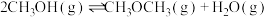
 。实验测得:
。实验测得: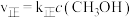 ,
,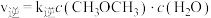 ,
, 、
、 为速率常数。
为速率常数。 温度下,向2L恒容密闭容器中加入
温度下,向2L恒容密闭容器中加入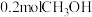 ,起始压强为
,起始压强为 ,
, 时该反应达到平衡。此时测得
时该反应达到平衡。此时测得 的体积分数为
的体积分数为 ,则平衡时
,则平衡时 的转化率
的转化率
_______ :当温度改变为 时,
时,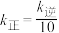 ,则
,则
_______  (填“<”、“>”或“=”)。
(填“<”、“>”或“=”)。
 对人类社会发展具有重要意义。二氧化碳加氢合成甲醇是重要途径。以
对人类社会发展具有重要意义。二氧化碳加氢合成甲醇是重要途径。以 和
和 为原料合成甲醇主要发生反应I和反应II(不考虑其他反应):
为原料合成甲醇主要发生反应I和反应II(不考虑其他反应):I.


II.

回答以下问题:
(1)已知:

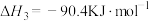 ,则反应I的
,则反应I的
(2)有利于提高
 平衡转化率的措施有_______(填标号)。
平衡转化率的措施有_______(填标号)。A.增大 投料比 投料比 | B.增大压强 |
| C.使用高效催化剂 | D.及时将 分离 分离 |
(3)实验测得
 平衡转化率(曲线
平衡转化率(曲线 )和平衡时
)和平衡时 的选择性(曲线
的选择性(曲线 )随温度变化如图所示。(已知:
)随温度变化如图所示。(已知: 的选择性
的选择性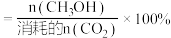 )
)
①
 加氢制
加氢制 时,温度选择
时,温度选择 的原因为
的原因为②
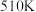 时,往恒容密闭容器中按
时,往恒容密闭容器中按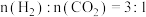 充入
充入 和
和 ,若平衡时容器内
,若平衡时容器内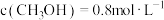 ,则反应
,则反应 的平衡常数
的平衡常数
(4)
 和
和 在某催化剂表面合成甲醇的反应历程如图所示,其中吸附在催化剂表面上的物种用*标注,“TS”表示过渡状态。
在某催化剂表面合成甲醇的反应历程如图所示,其中吸附在催化剂表面上的物种用*标注,“TS”表示过渡状态。
①气体在催化剂表面的吸附是
②该反应历程中反应速率最快步骤的化学方程式为
(5)甲醇脱水可制得二甲醚:
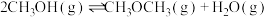
 。实验测得:
。实验测得: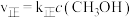 ,
,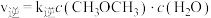 ,
, 、
、 为速率常数。
为速率常数。 温度下,向2L恒容密闭容器中加入
温度下,向2L恒容密闭容器中加入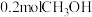 ,起始压强为
,起始压强为 ,
, 时该反应达到平衡。此时测得
时该反应达到平衡。此时测得 的体积分数为
的体积分数为 ,则平衡时
,则平衡时 的转化率
的转化率
 时,
时,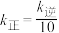 ,则
,则
 (填“<”、“>”或“=”)。
(填“<”、“>”或“=”)。
您最近一年使用:0次
2023-10-08更新
|
79次组卷
|
2卷引用:福建省福州格致中学2023-2024学年高三上学期10月月考化学试题
9 . 党的二十大报告指出,要积极稳妥推进碳达峰、碳中和。二氧化碳的捕集、利用与封存(CCUS)已成为科学家研究的重要课题。
I.工业上用 和
和 在一定条件下可以合成乙烯:
在一定条件下可以合成乙烯: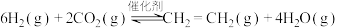

已知:①
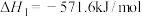
②
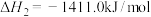
③
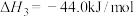
(1)
__________ (用 、
、 、
、 表示)。
表示)。
(2)恒温恒容下,向密闭容器按投料比 通入原料气,能判断该反应处于平衡状态的是_______(填标号)。
通入原料气,能判断该反应处于平衡状态的是_______(填标号)。
(3)向密闭容器按投料比 通入原料气(,不同温度对
通入原料气(,不同温度对 的平衡转化率和催化剂催化效率的影响如图所示,则压强
的平衡转化率和催化剂催化效率的影响如图所示,则压强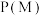
__________ 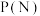 ,原因是:
,原因是:__________ 。

Ⅱ. 催化加氢可以直接合成二甲醚。涉及以下主要反应:
催化加氢可以直接合成二甲醚。涉及以下主要反应:
①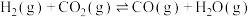

②

恒压条件下, 、起始量相等时,
、起始量相等时, 的平衡转化率和的选择性随温度变化如下图所示。
的平衡转化率和的选择性随温度变化如下图所示。
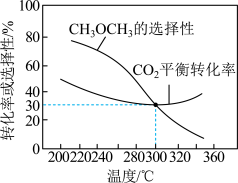
已知:的选择性 %
%
(4)300℃时,通入 、
、 各
各 ,平衡时
,平衡时 的选择性、
的选择性、 的平衡转化率均为30%,则此温度下反应①的平衡常数
的平衡转化率均为30%,则此温度下反应①的平衡常数
__________ (保留2位有效数字)。
(5)温度高于300℃, 的平衡转化率随温度升高而增大的原因可能是
的平衡转化率随温度升高而增大的原因可能是__________ 。
Ⅲ.电化学法也可还原二氧化碳制乙烯,原理如下图所示。
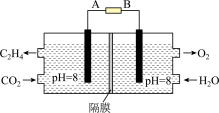
(6)该电池的阴极电极反应式为:__________ 。
I.工业上用
 和
和 在一定条件下可以合成乙烯:
在一定条件下可以合成乙烯: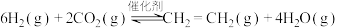

已知:①

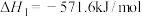
②

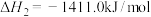
③

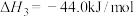
(1)

 、
、 、
、 表示)。
表示)。(2)恒温恒容下,向密闭容器按投料比
 通入原料气,能判断该反应处于平衡状态的是_______(填标号)。
通入原料气,能判断该反应处于平衡状态的是_______(填标号)。A. |
| B.混合气体的密度保持不变 |
| C.混合气体的平均相对分子质量保持不变 |
D.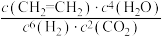 保持不变 保持不变 |
(3)向密闭容器按投料比
 通入原料气(,不同温度对
通入原料气(,不同温度对 的平衡转化率和催化剂催化效率的影响如图所示,则压强
的平衡转化率和催化剂催化效率的影响如图所示,则压强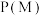
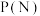 ,原因是:
,原因是:
Ⅱ.
 催化加氢可以直接合成二甲醚。涉及以下主要反应:
催化加氢可以直接合成二甲醚。涉及以下主要反应:①
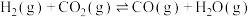

②


恒压条件下,
 、起始量相等时,
、起始量相等时, 的平衡转化率和的选择性随温度变化如下图所示。
的平衡转化率和的选择性随温度变化如下图所示。
已知:的选择性
 %
%(4)300℃时,通入
 、
、 各
各 ,平衡时
,平衡时 的选择性、
的选择性、 的平衡转化率均为30%,则此温度下反应①的平衡常数
的平衡转化率均为30%,则此温度下反应①的平衡常数
(5)温度高于300℃,
 的平衡转化率随温度升高而增大的原因可能是
的平衡转化率随温度升高而增大的原因可能是Ⅲ.电化学法也可还原二氧化碳制乙烯,原理如下图所示。

(6)该电池的阴极电极反应式为:
您最近一年使用:0次
10 . 氮及其化合物在工农业生产、生活中有着重要作用。合成氨工业中: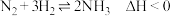 ,其化学平衡常数K与温度t的关系如表:
,其化学平衡常数K与温度t的关系如表:
完成下列填空:
(1)试比较K1、K2的大小,K1___________ K2(填写“>”、“=”或“<”)。
(2)400℃时,反应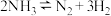 的化学平衡常数的值为
的化学平衡常数的值为___________ 。当测得NH3和N2、H2的物质的量浓度分别为3mol/L和2molL、1mol/L时,则该反应v(N2)(正)___________ v(N2)(逆)(填写“>”、“=”或“<”)。
(3)某温度下,pH=11的氨水和NaOH溶液分别加水稀释100倍,溶液的pH随溶液体积变化的曲线如图所示。根据图像判断下列说法错误的是___________
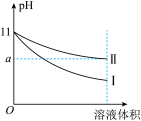
a.a值一定大于9
b.II为氨水稀释时溶液的pH变化曲线
c.稀释后氨水中水的电离程度比NaOH溶液中水的电离程度大
d.完全中和稀释后相同体积的两溶液时,消耗相同浓度的稀硫酸的体积V(NaOH)<V(氨水)
(4)甲醇是一种可再生能源,具有广泛的开发和应用前景。以CO2、H2为原料合成CH3OH涉及的主要反应如下:
I.
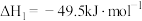
II.
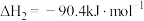
III.

回答下列问题:
①
___________ 
②若体系中只发生反应I,请写出反应I的化学平衡常数表达式,K=___________ ;保持恒温恒容,将反应I的平衡体系中各物质浓度均增大为原来的2倍,则化学平衡___________ (填“正向逆向”或“逆向”或“不”)移动,平衡常数K___________ (填“变大”“变小”或“不变”)。
③常温下,某一元弱酸HA的部分组分平衡浓度如下,
平衡浓度 V (a+b)1/2
计算出一元弱酸HA电离平衡常数Ka=___________ (用含a、b、V的代数式表示计算结果)
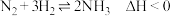 ,其化学平衡常数K与温度t的关系如表:
,其化学平衡常数K与温度t的关系如表:| t/℃ | 200 | 300 | 400 |
| K | K1 | K2 | 0.5 |
(1)试比较K1、K2的大小,K1
(2)400℃时,反应
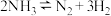 的化学平衡常数的值为
的化学平衡常数的值为(3)某温度下,pH=11的氨水和NaOH溶液分别加水稀释100倍,溶液的pH随溶液体积变化的曲线如图所示。根据图像判断下列说法错误的是

a.a值一定大于9
b.II为氨水稀释时溶液的pH变化曲线
c.稀释后氨水中水的电离程度比NaOH溶液中水的电离程度大
d.完全中和稀释后相同体积的两溶液时,消耗相同浓度的稀硫酸的体积V(NaOH)<V(氨水)
(4)甲醇是一种可再生能源,具有广泛的开发和应用前景。以CO2、H2为原料合成CH3OH涉及的主要反应如下:
I.

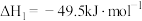
II.

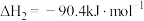
III.


回答下列问题:
①


②若体系中只发生反应I,请写出反应I的化学平衡常数表达式,K=
③常温下,某一元弱酸HA的部分组分平衡浓度如下,
HA⇌A-+H+
平衡浓度 V (a+b)1/2
计算出一元弱酸HA电离平衡常数Ka=
您最近一年使用:0次



