解题方法
1 . 捕集 转化为合成气(
转化为合成气( 和
和 ),再转化为烃类及含氧化合物等高附加值化学品(即费-托合成),有利于实现碳循环利用。
),再转化为烃类及含氧化合物等高附加值化学品(即费-托合成),有利于实现碳循环利用。
(1)捕集 涉及下列反应:
涉及下列反应:
①

②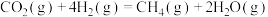

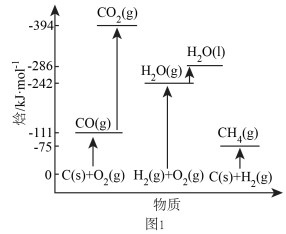
有关物质能量变化如图1所示,设稳定单质的焓(H)为0,则
_______  。
。
(2)保持总压 恒定,初始
恒定,初始 和
和 的物质的量之比
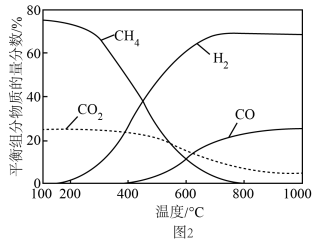
的物质的量之比 ,发生上述①②反应,不同温度下平衡组分物质的量分数如图2,在600℃以下时,
,发生上述①②反应,不同温度下平衡组分物质的量分数如图2,在600℃以下时, 含量高于
含量高于 的原因为
的原因为_______ ;某温度下,平衡体系中 和
和 的物质的量分数均为10%,则反应①的平衡常数
的物质的量分数均为10%,则反应①的平衡常数
_______ (用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。
(3)在恒温恒压条件下, 和
和 按一定体积比投料,通过费-托合成反应生成甲烷和气态水,假设副反应忽略不计。
按一定体积比投料,通过费-托合成反应生成甲烷和气态水,假设副反应忽略不计。
(ⅰ)反应的热化学方程式为_______ 。
(ⅱ)下列措施可以增大 平衡转化率的是
平衡转化率的是_______ (填标号)。
A.适当升高温度
B.降低温度
C.增大原料气中 的体积分数
的体积分数
D.选择更高效的催化剂
(ⅲ)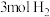 和
和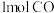 反应达平衡时,
反应达平衡时, 的转化率为
的转化率为 ,则反应的平衡常数
,则反应的平衡常数
_______ (写出含有 的计算式;对于反应
的计算式;对于反应 ,
,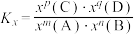 ,x为体积分数)。
,x为体积分数)。
 转化为合成气(
转化为合成气( 和
和 ),再转化为烃类及含氧化合物等高附加值化学品(即费-托合成),有利于实现碳循环利用。
),再转化为烃类及含氧化合物等高附加值化学品(即费-托合成),有利于实现碳循环利用。(1)捕集
 涉及下列反应:
涉及下列反应:①


②
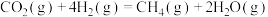

有关物质能量变化如图1所示,设稳定单质的焓(H)为0,则

 。
。
(2)保持总压
 恒定,初始
恒定,初始 和
和 的物质的量之比
的物质的量之比 ,发生上述①②反应,不同温度下平衡组分物质的量分数如图2,在600℃以下时,
,发生上述①②反应,不同温度下平衡组分物质的量分数如图2,在600℃以下时, 含量高于
含量高于 的原因为
的原因为 和
和 的物质的量分数均为10%,则反应①的平衡常数
的物质的量分数均为10%,则反应①的平衡常数

(3)在恒温恒压条件下,
 和
和 按一定体积比投料,通过费-托合成反应生成甲烷和气态水,假设副反应忽略不计。
按一定体积比投料,通过费-托合成反应生成甲烷和气态水,假设副反应忽略不计。(ⅰ)反应的热化学方程式为
(ⅱ)下列措施可以增大
 平衡转化率的是
平衡转化率的是A.适当升高温度
B.降低温度
C.增大原料气中
 的体积分数
的体积分数D.选择更高效的催化剂
(ⅲ)
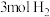 和
和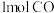 反应达平衡时,
反应达平衡时, 的转化率为
的转化率为 ,则反应的平衡常数
,则反应的平衡常数
 的计算式;对于反应
的计算式;对于反应 ,
,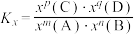 ,x为体积分数)。
,x为体积分数)。
您最近一年使用:0次
2 . 工业上常用 和
和 合成尿素
合成尿素 ,反应可分两步进行:
,反应可分两步进行:
①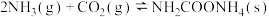
 kJ⋅mol
kJ⋅mol
②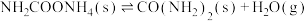
 kJ⋅mol
kJ⋅mol
(1)以 、
、 为原料生产尿素
为原料生产尿素 的总反应热化学方程式为
的总反应热化学方程式为_______ 。
(2)反应①为快反应,需在高压冷凝器中进行,采用高压冷凝的原因为_______ 。
(3)一定温度下,将 和
和 按2∶1的物质的量之比充入一容积恒为10 L的密闭容器中发生总反应。20 min时达到平衡,各物质的浓度变化曲线如图所示。
按2∶1的物质的量之比充入一容积恒为10 L的密闭容器中发生总反应。20 min时达到平衡,各物质的浓度变化曲线如图所示。
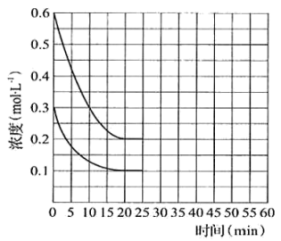
①能说明体系达到平衡状态的是_______ (填字母)。
A.混合气体的平均相对分子质量不再变化 B.容器内固体质量不再变化
C. 和
和 的转化率相等 D.水蒸气的浓度不再变化
的转化率相等 D.水蒸气的浓度不再变化
②25 min时再向容器中充入2 mol的 和1.5 mol
和1.5 mol  ,在45 min时重新达到平衡。45 min时
,在45 min时重新达到平衡。45 min时 的总转化率为
的总转化率为_______ (精确至0.1%);再次平衡时总反应的平衡常数为_______ 。
③请在图中画出25~50 min内 的浓度变化曲线
的浓度变化曲线_______ 。
(4)用尿素溶液吸收氮氧化物,可用于处理汽车尾气。NO和 不同配比混合气通入尿素溶液中,总氮还原率与配比关系如下图。
不同配比混合气通入尿素溶液中,总氮还原率与配比关系如下图。
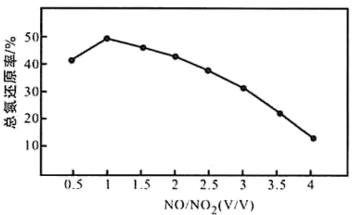
①用尿素水溶液吸收体积比为1∶1的NO和 混合气,可将N元素转变为对环境无害的气体。该反应的化学方程式
混合气,可将N元素转变为对环境无害的气体。该反应的化学方程式_______ 。
②随着NO和 配比的提高,总氮还原率降低的主要原因是
配比的提高,总氮还原率降低的主要原因是_______ 。
 和
和 合成尿素
合成尿素 ,反应可分两步进行:
,反应可分两步进行:①
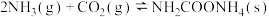
 kJ⋅mol
kJ⋅mol
②
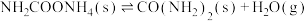
 kJ⋅mol
kJ⋅mol
(1)以
 、
、 为原料生产尿素
为原料生产尿素 的总反应热化学方程式为
的总反应热化学方程式为(2)反应①为快反应,需在高压冷凝器中进行,采用高压冷凝的原因为
(3)一定温度下,将
 和
和 按2∶1的物质的量之比充入一容积恒为10 L的密闭容器中发生总反应。20 min时达到平衡,各物质的浓度变化曲线如图所示。
按2∶1的物质的量之比充入一容积恒为10 L的密闭容器中发生总反应。20 min时达到平衡,各物质的浓度变化曲线如图所示。
①能说明体系达到平衡状态的是
A.混合气体的平均相对分子质量不再变化 B.容器内固体质量不再变化
C.
 和
和 的转化率相等 D.水蒸气的浓度不再变化
的转化率相等 D.水蒸气的浓度不再变化②25 min时再向容器中充入2 mol的
 和1.5 mol
和1.5 mol  ,在45 min时重新达到平衡。45 min时
,在45 min时重新达到平衡。45 min时 的总转化率为
的总转化率为③请在图中画出25~50 min内
 的浓度变化曲线
的浓度变化曲线(4)用尿素溶液吸收氮氧化物,可用于处理汽车尾气。NO和
 不同配比混合气通入尿素溶液中,总氮还原率与配比关系如下图。
不同配比混合气通入尿素溶液中,总氮还原率与配比关系如下图。
①用尿素水溶液吸收体积比为1∶1的NO和
 混合气,可将N元素转变为对环境无害的气体。该反应的化学方程式
混合气,可将N元素转变为对环境无害的气体。该反应的化学方程式②随着NO和
 配比的提高,总氮还原率降低的主要原因是
配比的提高,总氮还原率降低的主要原因是
您最近一年使用:0次
3 . 甲醇是重要的化工原料,广泛应用于有机合成、医药生产等领域。在一定条件下,用 和
和 可以合成甲醇,这对于减少
可以合成甲醇,这对于减少 排放,实现“碳中和”具有重要意义。以
排放,实现“碳中和”具有重要意义。以 和
和 为原料合成甲醇主要发生反应Ⅰ和反应Ⅱ(不考虑其他反应):
为原料合成甲醇主要发生反应Ⅰ和反应Ⅱ(不考虑其他反应):
Ⅰ.
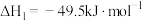
Ⅱ.

(1)已知:
 ,则反应Ⅱ的
,则反应Ⅱ的
___________ 。
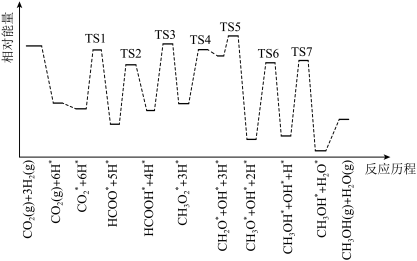
(2) 和
和 在某催化剂表面合成甲醇(反应I)的反应历程如图所示,其中吸附在催化剂表面上的物种用∗标注,“TS”表示过渡状态。
在某催化剂表面合成甲醇(反应I)的反应历程如图所示,其中吸附在催化剂表面上的物种用∗标注,“TS”表示过渡状态。
①气体在催化剂表面的吸附是___________ (填“吸热”或“放热”)过程。
②该反应历程中反应速率最快步骤的化学方程式为___________ 。
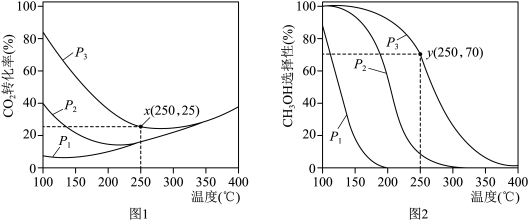
(3)往恒容密闭容器中按 充入
充入 和
和 ,在催化剂作用下合成甲醇,
,在催化剂作用下合成甲醇, 平衡转化率和
平衡转化率和 选择性随温度和压强的变化情况如图1、图2所示。
选择性随温度和压强的变化情况如图1、图2所示。
已知: 的选择性
的选择性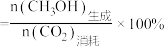
①据图可知,压强 、
、 、
、 由小到大的顺序是
由小到大的顺序是___________ 。
②图2中 选择性随温度变化的原因是
选择性随温度变化的原因是___________ 。
③当温度为250℃、压强为 时,
时, 平衡转化率和
平衡转化率和 选择性如图中
选择性如图中 和
和 点所示。若平衡时容器内
点所示。若平衡时容器内 ,则反应I的平衡常数
,则反应I的平衡常数
___________ (列计算式)。
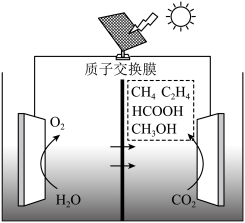
(4)目前,科研人员在研究 光电催化还原为甲醇的领域也取得了一定的进展,其原理如图所示,则生成甲醇的电极反应式为
光电催化还原为甲醇的领域也取得了一定的进展,其原理如图所示,则生成甲醇的电极反应式为___________ 。
 和
和 可以合成甲醇,这对于减少
可以合成甲醇,这对于减少 排放,实现“碳中和”具有重要意义。以
排放,实现“碳中和”具有重要意义。以 和
和 为原料合成甲醇主要发生反应Ⅰ和反应Ⅱ(不考虑其他反应):
为原料合成甲醇主要发生反应Ⅰ和反应Ⅱ(不考虑其他反应):Ⅰ.

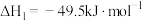
Ⅱ.


(1)已知:

 ,则反应Ⅱ的
,则反应Ⅱ的
(2)
 和
和 在某催化剂表面合成甲醇(反应I)的反应历程如图所示,其中吸附在催化剂表面上的物种用∗标注,“TS”表示过渡状态。
在某催化剂表面合成甲醇(反应I)的反应历程如图所示,其中吸附在催化剂表面上的物种用∗标注,“TS”表示过渡状态。①气体在催化剂表面的吸附是
②该反应历程中反应速率最快步骤的化学方程式为

(3)往恒容密闭容器中按
 充入
充入 和
和 ,在催化剂作用下合成甲醇,
,在催化剂作用下合成甲醇, 平衡转化率和
平衡转化率和 选择性随温度和压强的变化情况如图1、图2所示。
选择性随温度和压强的变化情况如图1、图2所示。
已知:
 的选择性
的选择性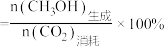
①据图可知,压强
 、
、 、
、 由小到大的顺序是
由小到大的顺序是②图2中
 选择性随温度变化的原因是
选择性随温度变化的原因是③当温度为250℃、压强为
 时,
时, 平衡转化率和
平衡转化率和 选择性如图中
选择性如图中 和
和 点所示。若平衡时容器内
点所示。若平衡时容器内 ,则反应I的平衡常数
,则反应I的平衡常数
(4)目前,科研人员在研究
 光电催化还原为甲醇的领域也取得了一定的进展,其原理如图所示,则生成甲醇的电极反应式为
光电催化还原为甲醇的领域也取得了一定的进展,其原理如图所示,则生成甲醇的电极反应式为
您最近一年使用:0次
2022-03-09更新
|
455次组卷
|
2卷引用:福建省漳州市2022届高三毕业班第二次教学质量检测化学试题
名校
4 . 温室气体让地球发烧,倡导低碳生活,是一种可持续发展的环保责任,将CO2应用于生产中实现其综合利用是目前的研究热点。
I.在催化作用下由CO2和CH4转化为CH3COOH的反应历程示意图如图。
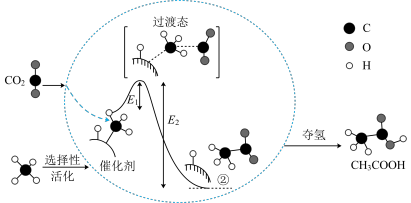
(1)在合成CH3COOH的反应历程中,下列有关说法正确的是_______(填字母)。
II.以CO2、H2为原料制备“21世纪的清洁燃料”二甲醚(CH3OCH3)涉及的主要反应如下:
①2CO2(g)+6 H2(g) CH3OCH3(g)+3H2O(g) ΔH1= -122.5kJ·mol-1。
CH3OCH3(g)+3H2O(g) ΔH1= -122.5kJ·mol-1。
②CO2(g)+ H2(g) CO (g)+ H2O(g) ΔH2 = +41.1kJ·mol-1。
CO (g)+ H2O(g) ΔH2 = +41.1kJ·mol-1。
(2)反应2CO(g)+4 H2(g) CH3OCH3(g)+ H2O(g) 的 ΔH=
CH3OCH3(g)+ H2O(g) 的 ΔH=_______ ;
(3)在压强、CO2和H2的起始投料一定的条件下,发生反应①、②,实验测得CO2平衡转化率和平衡时CH3OCH3的选择性随温度的变化如图所示。
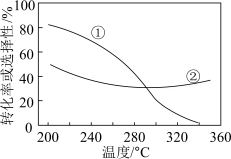
i.已知:CH3OCH3的选择性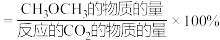 ,其中表示平衡时CH3OCH3的选择性的是曲线
,其中表示平衡时CH3OCH3的选择性的是曲线_______ (填“①”或“②”,下同);温度高于300℃时,曲线②随温度升高而升高的原因是高于300℃时,以反应_______ 为主,温度升高平衡正向移动,CO2的平衡转化增大。
ii.为同时提高CO2的平衡转化率和平衡时CH3OCH3的选择性,应选择的反应条件为_______ (填标号)。
a.低温、低压 b.高温、高压 c.高温、低压 d.低温、高压
III.以CO2、C2H6为原料合成的主要反应为:CO2(g) + C2H6(g) C2H4(g) + H2O(g)+CO(g) ΔH1= +177kJ·mol-1。
C2H4(g) + H2O(g)+CO(g) ΔH1= +177kJ·mol-1。
(4)某温度下,在0.1MPa恒压密闭容器中充入等物质的量的CO2和C2H6达到平衡时C2H4的物质的量分数为20%,该温度下反应的平衡常数Kp=_______ MPa(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)
IV.以稀硫酸为电解质溶液,由甲醇(CH3OH)、O2构成的原电池作为电解饱和食盐水的电源(电解池中左右两室均为1L的NaCl溶液)。
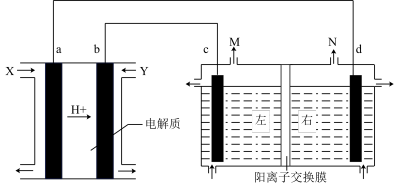
(5)a电极的电极反应式为_______ 。电解饱和食盐水装置溶液中的阳离子由_______ (填“左向右”或“右向左”)移动,
(6)室温下,当电解池中共产生224mL(已折算成标况下,不考虑气体溶解损失)气体时,右室溶液(体积变化忽略不计)的pH为_______ 。
I.在催化作用下由CO2和CH4转化为CH3COOH的反应历程示意图如图。

(1)在合成CH3COOH的反应历程中,下列有关说法正确的是_______(填字母)。
| A.该催化剂使反应的平衡常数增大 |
| B.CH4 →CH3COOH过程中,有C-H键断裂和C-C键形成 |
| C.生成乙酸的反应原子利用率100% |
| D.ΔH =E2-E1 |
II.以CO2、H2为原料制备“21世纪的清洁燃料”二甲醚(CH3OCH3)涉及的主要反应如下:
①2CO2(g)+6 H2(g)
 CH3OCH3(g)+3H2O(g) ΔH1= -122.5kJ·mol-1。
CH3OCH3(g)+3H2O(g) ΔH1= -122.5kJ·mol-1。②CO2(g)+ H2(g)
 CO (g)+ H2O(g) ΔH2 = +41.1kJ·mol-1。
CO (g)+ H2O(g) ΔH2 = +41.1kJ·mol-1。(2)反应2CO(g)+4 H2(g)
 CH3OCH3(g)+ H2O(g) 的 ΔH=
CH3OCH3(g)+ H2O(g) 的 ΔH=(3)在压强、CO2和H2的起始投料一定的条件下,发生反应①、②,实验测得CO2平衡转化率和平衡时CH3OCH3的选择性随温度的变化如图所示。

i.已知:CH3OCH3的选择性
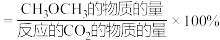 ,其中表示平衡时CH3OCH3的选择性的是曲线
,其中表示平衡时CH3OCH3的选择性的是曲线ii.为同时提高CO2的平衡转化率和平衡时CH3OCH3的选择性,应选择的反应条件为
a.低温、低压 b.高温、高压 c.高温、低压 d.低温、高压
III.以CO2、C2H6为原料合成的主要反应为:CO2(g) + C2H6(g)
 C2H4(g) + H2O(g)+CO(g) ΔH1= +177kJ·mol-1。
C2H4(g) + H2O(g)+CO(g) ΔH1= +177kJ·mol-1。(4)某温度下,在0.1MPa恒压密闭容器中充入等物质的量的CO2和C2H6达到平衡时C2H4的物质的量分数为20%,该温度下反应的平衡常数Kp=
IV.以稀硫酸为电解质溶液,由甲醇(CH3OH)、O2构成的原电池作为电解饱和食盐水的电源(电解池中左右两室均为1L的NaCl溶液)。

(5)a电极的电极反应式为
(6)室温下,当电解池中共产生224mL(已折算成标况下,不考虑气体溶解损失)气体时,右室溶液(体积变化忽略不计)的pH为
您最近一年使用:0次
名校
5 . 利用CO2可合成烷烃、醇等系列重要化工原料。回答下列有关问题:
I.制备甲烷:CO2(g)+4H2(g)=CH4(g)+2H2O (g) △H
已知:CH4、H2的燃烧热分别为 △H1 =—893kJ·mol-1、△H2=—285.8 kJ· mol-1,1mol液态H2O变成水蒸气需吸收44kJ的热量。
(1)△H=___________ kJ· mol-1。
II.制备甲醇:
主反应: CO2(g) + 3H2 CH3OH(g) +H2O (g) △H1=—58 kJ·mol-1
CH3OH(g) +H2O (g) △H1=—58 kJ·mol-1
副反应: CO2(g) + H2(g) CO(g) + H2O (g) △H2= +41 kJ·mol-1
CO(g) + H2O (g) △H2= +41 kJ·mol-1
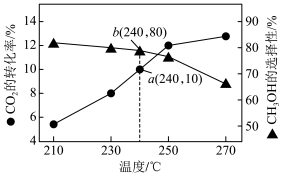
某一刚性容器中充入1molCO2和3molH2,在催化剂存在的条件下进行反应,测得温度与平衡转化率、产物选择性的关系如下图所示。
(2)240℃该反应达到平衡时,产生的CH3OH的物质的量为___________ mol,240℃时副反应的化学平衡常数为___________ 。
(3)有研究表明,在原料气中掺入适量的CO有利于提高CH3OH选择性,说明其可能的原因是___________ , 有利于提高CH3OH选择性反应条件还可以是_____ (填标号)。
A.高温高压 B.高温低压 C.低温高压 D.低温低压
I.制备甲烷:CO2(g)+4H2(g)=CH4(g)+2H2O (g) △H
已知:CH4、H2的燃烧热分别为 △H1 =—893kJ·mol-1、△H2=—285.8 kJ· mol-1,1mol液态H2O变成水蒸气需吸收44kJ的热量。
(1)△H=
II.制备甲醇:
主反应: CO2(g) + 3H2
 CH3OH(g) +H2O (g) △H1=—58 kJ·mol-1
CH3OH(g) +H2O (g) △H1=—58 kJ·mol-1副反应: CO2(g) + H2(g)
 CO(g) + H2O (g) △H2= +41 kJ·mol-1
CO(g) + H2O (g) △H2= +41 kJ·mol-1某一刚性容器中充入1molCO2和3molH2,在催化剂存在的条件下进行反应,测得温度与平衡转化率、产物选择性的关系如下图所示。

(2)240℃该反应达到平衡时,产生的CH3OH的物质的量为
(3)有研究表明,在原料气中掺入适量的CO有利于提高CH3OH选择性,说明其可能的原因是
A.高温高压 B.高温低压 C.低温高压 D.低温低压
您最近一年使用:0次
名校
6 . CO2是主要的温室气体,以CO2和H2为原料制造更高价值的化学产品是用来缓解温室效应的研究方向,回答下列问题:
(1)工业上常用CO2和H2为原料合成甲醇( ),过程中发生如下两个反应:
),过程中发生如下两个反应:
反应I: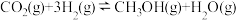
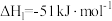
反应II: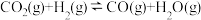
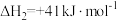
①则

_______  ;
;
②若反应II逆反应活化能Ea(逆)为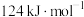 ,则该反应的Ea (正)活化能为
,则该反应的Ea (正)活化能为_______  。
。
(2)若将等物质的量的CO和H2混合气体充入恒温恒容密闭容器中进行反应: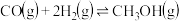 ,下列事实能说明此反应已达到平衡状态的是_______。
,下列事实能说明此反应已达到平衡状态的是_______。
(3)向2L容器中充入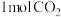 和
和 ,若只发生反应I,测得反应在不同压强、不同温度下,平衡混合物中
,若只发生反应I,测得反应在不同压强、不同温度下,平衡混合物中 体积分数如图1所示,测得反应时逆反应速率与容器中
体积分数如图1所示,测得反应时逆反应速率与容器中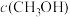 关系如图II所示:
关系如图II所示:
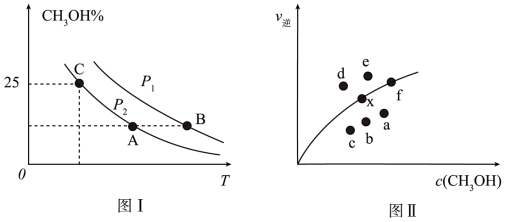
①图I中P1_______ P2(填“>”、“<”或“=”)。
②图II中当x点平衡体系升高至某一温度时,反应可重新达平衡状态,新平衡点可能是_______ 。
③利用图I中C点对应的数据,计算求出对应温度下反应Ⅰ的平衡常数K=_______ 。
(1)工业上常用CO2和H2为原料合成甲醇(
 ),过程中发生如下两个反应:
),过程中发生如下两个反应:反应I:
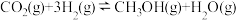
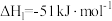
反应II:
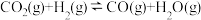
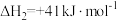
①则


 ;
;②若反应II逆反应活化能Ea(逆)为
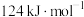 ,则该反应的Ea (正)活化能为
,则该反应的Ea (正)活化能为 。
。(2)若将等物质的量的CO和H2混合气体充入恒温恒容密闭容器中进行反应:
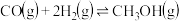 ,下列事实能说明此反应已达到平衡状态的是_______。
,下列事实能说明此反应已达到平衡状态的是_______。| A.容器内气体密度保持不变 |
| B.混合气体的平均相对分子质量不变 |
C.生成 的速率与生成H2的速率相等 的速率与生成H2的速率相等 |
| D.CO的体积分数保持不变 |
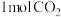 和
和 ,若只发生反应I,测得反应在不同压强、不同温度下,平衡混合物中
,若只发生反应I,测得反应在不同压强、不同温度下,平衡混合物中 体积分数如图1所示,测得反应时逆反应速率与容器中
体积分数如图1所示,测得反应时逆反应速率与容器中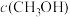 关系如图II所示:
关系如图II所示:
①图I中P1
②图II中当x点平衡体系升高至某一温度时,反应可重新达平衡状态,新平衡点可能是
③利用图I中C点对应的数据,计算求出对应温度下反应Ⅰ的平衡常数K=
您最近一年使用:0次
7 . “低碳经济”已成为全世界科学家研究的重要课题。为减小和消除CO2对环境的影响,一方面世界各国都在限制其排放量,另一方面科学家加强了对CO2创新利用的研究。
(1)科学家们经过探索实践,建立了如图所示的CO2新循环体系:

根据上图分析,下列相关说法错误的是___________
(2)研究证明,CO2可作为合成甲烷的原料,已知:
①CO(g)+H2O(g)⇌H2(g)+CO2(g) ΔH=-41kJ·mol-1
②C(s)+2H2(g)⇌CH4(g) ΔH=-73kJ·mol-1
③2CO(g)⇌C(s)+CO2(g) ΔH=-171kJ·mol-1
写出CO2与H2反应生成CH4和H2O(g)的热化学方程式:___________ 。
(3)工业上有一种“降碳”方法是用CO2生产燃料甲醇:CO2(g)+3H2(g)⇌CH3OH(g)+H2O(g)。在容积为2L密闭容器中,充入1molCO2和3.25molH2在一定条件下发生反应,测得CO2、CH3OH(g)和H2O(g)的物质的量(n)随时间的变化如图所示:
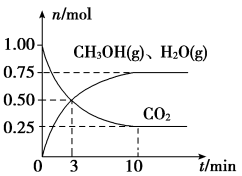
①从反应开始到平衡,氢气的平均反应速率v(H2)=___________ ,平衡时CO2的转化率为___________ ,平衡时甲醇的体积分数=___________ 。
②下列措施可以增大CO2平衡转化率的是___________ 。
A.在原容器中再充入1molCO2
B.在原容器中再充入1molH2
C.在原容器中充入1mol氦气
D.使用更有效的催化剂
E.扩大容器的容积
F.将水蒸气从体系中分离
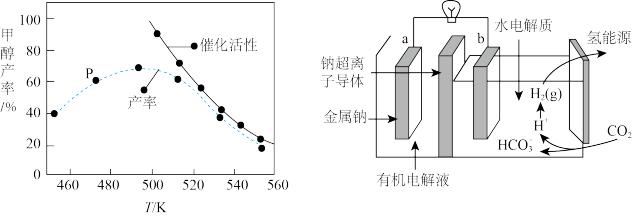
③一定比例的合成气在装有催化剂的反应器中反应12小时。体系中甲醇的产率和催化剂的催化活性与温度的关系如图所示。温度为470K时,图中P点___________ (填“是”或“不是”)处于平衡状态。490K之后,甲醇产率下降的原因是___________ 。
(4)碳排放是影响气候变化的重要因素之一、最近,科学家开发出一种新系统,“溶解”水中的二氧化碳,以触发电化学反应,生成电能和氢气,其工作原理如图所示。
①系统工作时,有机电解液___________ (填“能”或“不能”)用含水·电解液替换。
②写出二氧化碳生成氢气的电极反应式___________ 。
(1)科学家们经过探索实践,建立了如图所示的CO2新循环体系:

根据上图分析,下列相关说法错误的是___________
| A.化学变化中质量和能量都是守恒的 |
| B.CO2和H2生成甲烷的反应中原子利用率为100% |
| C.将CO2还原为甲醇能有效促进“碳中和” |
| D.无机物和有机物可以相互转化 |
①CO(g)+H2O(g)⇌H2(g)+CO2(g) ΔH=-41kJ·mol-1
②C(s)+2H2(g)⇌CH4(g) ΔH=-73kJ·mol-1
③2CO(g)⇌C(s)+CO2(g) ΔH=-171kJ·mol-1
写出CO2与H2反应生成CH4和H2O(g)的热化学方程式:
(3)工业上有一种“降碳”方法是用CO2生产燃料甲醇:CO2(g)+3H2(g)⇌CH3OH(g)+H2O(g)。在容积为2L密闭容器中,充入1molCO2和3.25molH2在一定条件下发生反应,测得CO2、CH3OH(g)和H2O(g)的物质的量(n)随时间的变化如图所示:

①从反应开始到平衡,氢气的平均反应速率v(H2)=
②下列措施可以增大CO2平衡转化率的是
A.在原容器中再充入1molCO2
B.在原容器中再充入1molH2
C.在原容器中充入1mol氦气
D.使用更有效的催化剂
E.扩大容器的容积
F.将水蒸气从体系中分离
③一定比例的合成气在装有催化剂的反应器中反应12小时。体系中甲醇的产率和催化剂的催化活性与温度的关系如图所示。温度为470K时,图中P点

(4)碳排放是影响气候变化的重要因素之一、最近,科学家开发出一种新系统,“溶解”水中的二氧化碳,以触发电化学反应,生成电能和氢气,其工作原理如图所示。
①系统工作时,有机电解液
②写出二氧化碳生成氢气的电极反应式
您最近一年使用:0次
8 . 碳汇是指通过植树造林、植被恢复等措施,利用植物光合作用吸收大气中的二氧化碳,从而减少温室气体在大气中浓度的过程、活动或机制。已知利用植物的光合作用每吸收1molCO2需要吸收的能量约为470 kJ。请回答下列问题:
(1)碳汇过程中能量的转化形式为___________ 能转化为___________ 能;有资料表明,某块林木通过光合作用大约吸收了1.88×107 kJ能量,则吸收的CO2物质的量为___________ mol;CO2与液态水光合作用生成葡萄糖(C6H12O6)固体和氧气的热化学方程式为___________ 。
(2)工业废气中的CO2可用碱液吸收。已知:
①CO2(g) + NaOH(aq) = NaHCO3(aq) ΔH=-a kJ·mol-1;
②CO2(g) + 2NaOH(aq) = Na2CO3(aq) + H2O(l) ΔH=-b kJ·mol-1。
反应CO2(g) + H2O(l) + Na2CO3(aq) = 2NaHCO3(aq)的 =
=___________ kJ/mol(用含a、b的代数式表示)。
(3)利用工业废气中的CO2、H2为原料合成甲醇(CH3OH),已知298K时,每转化1mol CO2生成CH3OH(g)和水蒸气放出49.0 kJ热量,请写出该反应的热化学方程式___________ ;研究发现以二氧化碳和氢气为原料合成甲醇时,通常伴随着以下反应:
I.CO2(g)+H2(g)=CO(g)+H2O(g) △H= +41.2 kJ∙mol−1
II.CO(g)+2H2(g)=CH3OH(g) △H3
请应用盖斯定律计算△H3=___________ kJ∙mol−1。
(1)碳汇过程中能量的转化形式为
(2)工业废气中的CO2可用碱液吸收。已知:
①CO2(g) + NaOH(aq) = NaHCO3(aq) ΔH=-a kJ·mol-1;
②CO2(g) + 2NaOH(aq) = Na2CO3(aq) + H2O(l) ΔH=-b kJ·mol-1。
反应CO2(g) + H2O(l) + Na2CO3(aq) = 2NaHCO3(aq)的
 =
=(3)利用工业废气中的CO2、H2为原料合成甲醇(CH3OH),已知298K时,每转化1mol CO2生成CH3OH(g)和水蒸气放出49.0 kJ热量,请写出该反应的热化学方程式
I.CO2(g)+H2(g)=CO(g)+H2O(g) △H= +41.2 kJ∙mol−1
II.CO(g)+2H2(g)=CH3OH(g) △H3
请应用盖斯定律计算△H3=
您最近一年使用:0次
名校
解题方法
9 . 近年来CO2变废为宝,改善环境是科学研究的重要课题,对于实现废气资源的再利用及碳循环经济技术的发展都具有重要意义。
I.已知CO2、C2H6为原料合成C2H4涉及的主要反应如下:
①C2H6(g) CH4(g)+H2(g)+C(s) △H1=+9kJ·mol-1
CH4(g)+H2(g)+C(s) △H1=+9kJ·mol-1
②C2H4(g)+H2(g) C2H6(g) △H2=-136 kJ·mol-1
C2H6(g) △H2=-136 kJ·mol-1
③H2(g)+CO2(g) H2O(g)+CO(g) △H3=+41 kJ·mol-1
H2O(g)+CO(g) △H3=+41 kJ·mol-1
④CO2(g)+C2H6(g) C2H4(g)+H2O(g)+CO(g) △H4
C2H4(g)+H2O(g)+CO(g) △H4
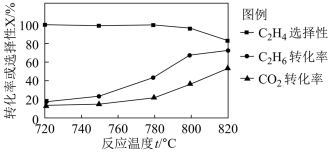
(1)△H4=_____ ,0.1MPa 时向密闭容器中充入CO2和C2H6,发生反应④,温度对催化剂K- Fe-Mn/Si 性能的影响如图:
工业生产综合各方面的因素,根据图中的信息判断反应的最佳温度是______ °C。
(2)在800°C时,n(CO2):n(C2H6)=1: 3,充入一定体积的密闭容器中,在有催化剂存在的条件下,发生反应④,初始压强为p0,一段时间后达到平衡,产物的总物质的量与剩余反应物的总物质的量相等,则该温度下反应的平衡常数Kp=_____ (用平衡分压代替平衡浓度计算,分压=总压×物质的量分数,用最简分式表示)。
II.CO2和H2制备CH3OH,可实现CO2的资源化利用,涉及的反应如下:
主反应: CO2(g)+3H2(g) CH3OH(g)+H2O(g) △H <0
CH3OH(g)+H2O(g) △H <0
副反应: CO2(g)+H2(g) CO(g)+H2O(g) △H>0
CO(g)+H2O(g) △H>0
将反应物混合气体按进料比n(CO2): n(H2)=1: 3通入反应装置中,选择合适的催化剂,发生上述反应。
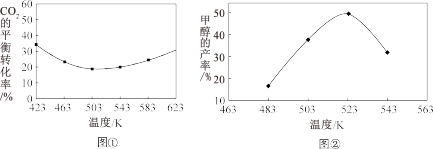
(3)不同温度下,CO2的平衡转化率如图①所示,温度高于503K时,CO2 的平衡转化率随温度的升高而增大的原因是___________ 。 实际生产中,保持压强不变,相同反应时间内不同温度下CH3OH的产率如图②所示,由图可知,523K时CH3OH的产率最大,可能的原因是___________ 。
III.捕碳技术(主要指捕获CO2在降低温室气体排放中具有重要的作用。
(4)已知: NH3·H2O的Kb=1.7 ×10-5, H2CO3的Ka1=4.3 ×10-7, Ka2 =5.6 ×10-11。工业生产尾气中的CO2捕获技术之一是氨水溶液吸收技术,工艺流程是将烟气冷却至20°C后用氨水吸收过量的CO2。吸收反应的化学反应方程式为___________ ,所得溶液离子浓度由大到小的顺序是___________ (不考虑二氧化碳的溶解)。
I.已知CO2、C2H6为原料合成C2H4涉及的主要反应如下:
①C2H6(g)
 CH4(g)+H2(g)+C(s) △H1=+9kJ·mol-1
CH4(g)+H2(g)+C(s) △H1=+9kJ·mol-1②C2H4(g)+H2(g)
 C2H6(g) △H2=-136 kJ·mol-1
C2H6(g) △H2=-136 kJ·mol-1③H2(g)+CO2(g)
 H2O(g)+CO(g) △H3=+41 kJ·mol-1
H2O(g)+CO(g) △H3=+41 kJ·mol-1④CO2(g)+C2H6(g)
 C2H4(g)+H2O(g)+CO(g) △H4
C2H4(g)+H2O(g)+CO(g) △H4(1)△H4=

工业生产综合各方面的因素,根据图中的信息判断反应的最佳温度是
(2)在800°C时,n(CO2):n(C2H6)=1: 3,充入一定体积的密闭容器中,在有催化剂存在的条件下,发生反应④,初始压强为p0,一段时间后达到平衡,产物的总物质的量与剩余反应物的总物质的量相等,则该温度下反应的平衡常数Kp=
II.CO2和H2制备CH3OH,可实现CO2的资源化利用,涉及的反应如下:
主反应: CO2(g)+3H2(g)
 CH3OH(g)+H2O(g) △H <0
CH3OH(g)+H2O(g) △H <0副反应: CO2(g)+H2(g)
 CO(g)+H2O(g) △H>0
CO(g)+H2O(g) △H>0将反应物混合气体按进料比n(CO2): n(H2)=1: 3通入反应装置中,选择合适的催化剂,发生上述反应。
(3)不同温度下,CO2的平衡转化率如图①所示,温度高于503K时,CO2 的平衡转化率随温度的升高而增大的原因是

III.捕碳技术(主要指捕获CO2在降低温室气体排放中具有重要的作用。
(4)已知: NH3·H2O的Kb=1.7 ×10-5, H2CO3的Ka1=4.3 ×10-7, Ka2 =5.6 ×10-11。工业生产尾气中的CO2捕获技术之一是氨水溶液吸收技术,工艺流程是将烟气冷却至20°C后用氨水吸收过量的CO2。吸收反应的化学反应方程式为
您最近一年使用:0次
2022-03-16更新
|
324次组卷
|
2卷引用:福建省福州第三中学2021-2022学年高三上学期第六次质量检测化学试题
10 . 工业上常以水煤气( 和
和 )为原料合成甲醇。
)为原料合成甲醇。
(1)已知: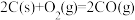


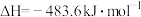
则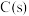 与
与 制备水煤气的热化学方程式为
制备水煤气的热化学方程式为_______ 。
(2)工业上通常用水煤气在恒容、催化剂和加热条件下生产甲醇,其热化学方程式为: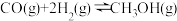
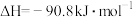 。以下各项能说明该反应达到平衡状态的是_______。
。以下各项能说明该反应达到平衡状态的是_______。
(3)在2L恒容容器中,分别在 、
、 两种温度下模拟工业合成甲醇。两种温度下不同
两种温度下模拟工业合成甲醇。两种温度下不同 和CO起始组成比
和CO起始组成比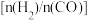 与CO平衡转化率的关系如图所示:
与CO平衡转化率的关系如图所示:
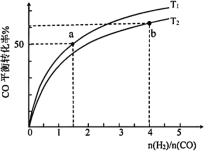
①温度
_______  (填“>”、“<”或“=”)。
(填“>”、“<”或“=”)。
② 时,往恒容容器中充入
时,往恒容容器中充入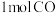 、
、 ,经过
,经过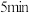 达到平衡,则
达到平衡,则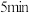 内用
内用 表示的反应速率为
表示的反应速率为
_______ ,反应平衡常数
_______ 。
③b点CO平衡转化率比a点高的原因是_______ 。
(4)研究证实, 可在酸性溶液中通过电解在阴极生成甲醇,阴极的电极反应式是
可在酸性溶液中通过电解在阴极生成甲醇,阴极的电极反应式是_______ 。
 和
和 )为原料合成甲醇。
)为原料合成甲醇。(1)已知:
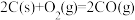


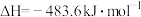
则
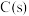 与
与 制备水煤气的热化学方程式为
制备水煤气的热化学方程式为(2)工业上通常用水煤气在恒容、催化剂和加热条件下生产甲醇,其热化学方程式为:
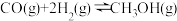
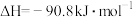 。以下各项能说明该反应达到平衡状态的是_______。
。以下各项能说明该反应达到平衡状态的是_______。| A.混合气体的密度保持不变 | B.容器内总压强保持不变 |
| C.CO的体积分数保持不变 | D.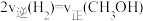 |
 、
、 两种温度下模拟工业合成甲醇。两种温度下不同
两种温度下模拟工业合成甲醇。两种温度下不同 和CO起始组成比
和CO起始组成比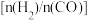 与CO平衡转化率的关系如图所示:
与CO平衡转化率的关系如图所示:
①温度

 (填“>”、“<”或“=”)。
(填“>”、“<”或“=”)。②
 时,往恒容容器中充入
时,往恒容容器中充入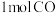 、
、 ,经过
,经过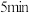 达到平衡,则
达到平衡,则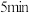 内用
内用 表示的反应速率为
表示的反应速率为

③b点CO平衡转化率比a点高的原因是
(4)研究证实,
 可在酸性溶液中通过电解在阴极生成甲醇,阴极的电极反应式是
可在酸性溶液中通过电解在阴极生成甲醇,阴极的电极反应式是
您最近一年使用:0次
2021-08-31更新
|
288次组卷
|
2卷引用:福建省泉州市2022届高三上学期(8月)毕业班质量监测(一)化学试题



