1 . 北京冬奥会火炬“飞扬”在研制的过程中,解决了火焰颜色与稳定性、高压储氢、氢能安全利用等多项技术难题。中国研究人员研制出一种新型复合光催化剂,利用太阳光在催化剂表面实现高效分解水来制备氢气,其主要过程如图所示。

已知:几种物质中化学键的键能如表所示。
(1)写出水蒸气光催化反应的热化学方程式_______ 。
(2)过程Ⅲ属于_______ 反应(填“吸热”或“放热”)。
(3)分解产生的 可以与
可以与 反应合成甲醇,制备甲醇的过程可能涉及的反应如下:
反应合成甲醇,制备甲醇的过程可能涉及的反应如下:
反应Ⅰ:
反应Ⅱ:
反应Ⅲ:
则:
①反应Ⅲ的
_______  。
。
②对于反应Ⅰ,不同温度对 的转化率及催化剂的催化效率影响如下图甲所示,下列有关说法不正确的是
的转化率及催化剂的催化效率影响如下图甲所示,下列有关说法不正确的是_______ 。
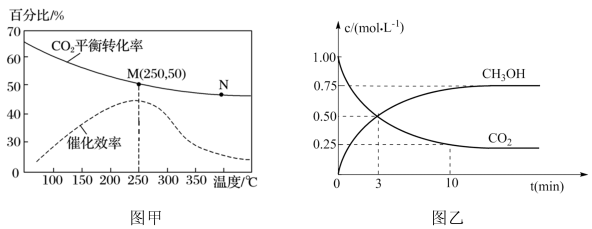
A.其他条件不变,若不使用催化剂,则 时
时 的平衡转化率可能位于N点
的平衡转化率可能位于N点
B.M点时对应平衡常数比N点时对应平衡常数大
C.温度低于 时,随温度升高甲醇的平衡产率增大
时,随温度升高甲醇的平衡产率增大
D.实际反应时既要考虑较高的催化效率,也要兼顾较高的 的平衡转化率
的平衡转化率
③对于反应Ⅰ,一定条件下在 的密闭容器,起始物
的密闭容器,起始物 时发生反应测得
时发生反应测得 和
和 的浓度随时间变化如上图乙所示。从
的浓度随时间变化如上图乙所示。从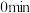 到
到 ,
,
_______  ;该条件下
;该条件下 的平衡转化率为
的平衡转化率为_______ 。该反应的化学平衡常数为_______ 。

已知:几种物质中化学键的键能如表所示。
| 化学键 |  键 键 |  键 键 |  键 键 |  键 键 |
键能 | 463 | 496 | 436 | 138 |
(2)过程Ⅲ属于
(3)分解产生的
 可以与
可以与 反应合成甲醇,制备甲醇的过程可能涉及的反应如下:
反应合成甲醇,制备甲醇的过程可能涉及的反应如下:反应Ⅰ:

反应Ⅱ:

反应Ⅲ:

则:
①反应Ⅲ的

 。
。②对于反应Ⅰ,不同温度对
 的转化率及催化剂的催化效率影响如下图甲所示,下列有关说法不正确的是
的转化率及催化剂的催化效率影响如下图甲所示,下列有关说法不正确的是
A.其他条件不变,若不使用催化剂,则
 时
时 的平衡转化率可能位于N点
的平衡转化率可能位于N点B.M点时对应平衡常数比N点时对应平衡常数大
C.温度低于
 时,随温度升高甲醇的平衡产率增大
时,随温度升高甲醇的平衡产率增大D.实际反应时既要考虑较高的催化效率,也要兼顾较高的
 的平衡转化率
的平衡转化率③对于反应Ⅰ,一定条件下在
 的密闭容器,起始物
的密闭容器,起始物 时发生反应测得
时发生反应测得 和
和 的浓度随时间变化如上图乙所示。从
的浓度随时间变化如上图乙所示。从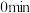 到
到 ,
,
 ;该条件下
;该条件下 的平衡转化率为
的平衡转化率为
您最近一年使用:0次
解题方法
2 . “十四五”规划明确了“碳达峰、碳中和”工作的定位。某科研机构想利用 和
和 合成燃料。已知:
合成燃料。已知:
①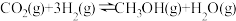

②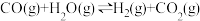

③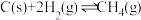

④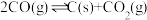

(1) 与
与 反应生成
反应生成 和
和 的热化学方程式为
的热化学方程式为___________ 。
(2)某温度下,向一恒容密闭容器中按照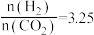 投料,在一定条件下发生反应:
投料,在一定条件下发生反应: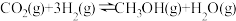 ,测得
,测得 和
和 的物质的量浓度随时间的变化如图所示。
的物质的量浓度随时间的变化如图所示。
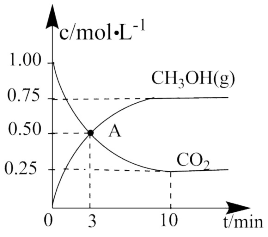
①反应达到A点时,v正___________ (填“>”、“<”或“=”)v逆;0~3min内,
___________  ,该温度下的平衡常数K=
,该温度下的平衡常数K=___________  。
。
②关于该反应,下列说法错误的是___________ (填标号)。
a.使用催化剂可以提高反应物的转化率
b.在原容器中再充入 ,可以提高
,可以提高 的转化率
的转化率
c.反应达到平衡时,每断裂3molC—H键的同时生成3molH—H键
d.反应达到平衡后,再按照原来的投料比加入反应物,再次达到平衡后, 的产率增大
的产率增大
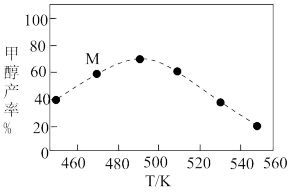
③将上述反应改为在恒压条件下进行,测得相同时间内、不同温度下甲醇的产率如图中虚线所示。温度为470K时,图中M点的浓度商Q___________ (填“>”、“<”或“=”)平衡常数K。490K之后,甲醇产率下降的原因是___________ 。
 和
和 合成燃料。已知:
合成燃料。已知:①
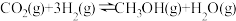

②
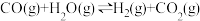

③
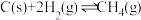

④
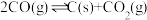

(1)
 与
与 反应生成
反应生成 和
和 的热化学方程式为
的热化学方程式为(2)某温度下,向一恒容密闭容器中按照
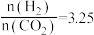 投料,在一定条件下发生反应:
投料,在一定条件下发生反应: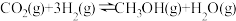 ,测得
,测得 和
和 的物质的量浓度随时间的变化如图所示。
的物质的量浓度随时间的变化如图所示。
①反应达到A点时,v正

 ,该温度下的平衡常数K=
,该温度下的平衡常数K= 。
。②关于该反应,下列说法错误的是
a.使用催化剂可以提高反应物的转化率
b.在原容器中再充入
 ,可以提高
,可以提高 的转化率
的转化率c.反应达到平衡时,每断裂3molC—H键的同时生成3molH—H键
d.反应达到平衡后,再按照原来的投料比加入反应物,再次达到平衡后,
 的产率增大
的产率增大③将上述反应改为在恒压条件下进行,测得相同时间内、不同温度下甲醇的产率如图中虚线所示。温度为470K时,图中M点的浓度商Q

您最近一年使用:0次
3 . 宇宙中随时伴随能量变化,研究化学反应能量变化意义重大。
(1)杭州亚运会首次使用废碳( )绿色循环再生技术合成的零碳甲醇(
)绿色循环再生技术合成的零碳甲醇( )燃料作为主火炬燃料,是对绿色亚运的美好诠释。
)燃料作为主火炬燃料,是对绿色亚运的美好诠释。
①下列有关零碳甲醇作主火炬燃料的优势说法正确的是___________ ;
A.环保,燃烧高效,可实现循环内零排放
B.安全,不易爆炸,储存运输安全便捷
C.可靠,持续燃烧,极端天气不易熄灭
D.经济,废碳再生,燃料成本低
E.可视,火焰亮丽稳定
②已知:反应Ⅰ:
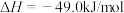
反应Ⅱ: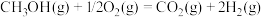
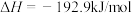
过程Ⅲ:
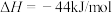
表示甲醇蒸汽燃烧热的热化学方程式为___________ 。
(2)取 的
的 溶液
溶液 与
与 硫酸溶液
硫酸溶液 置于如图所示的装置中进行中和反应反应热的测定实验。回答下列问题:
置于如图所示的装置中进行中和反应反应热的测定实验。回答下列问题:
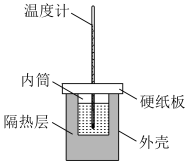
①从图中实验装置看,其中缺少的一种玻璃仪器是___________ ;
②四次实验数据如下,表中温差平均值为___________ ℃
若
 溶液和
溶液和 硫酸溶液的密度都是
硫酸溶液的密度都是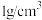 ,反应后生成的溶液比热容
,反应后生成的溶液比热容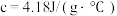 ,则中和反应反应热
,则中和反应反应热
___________ (结果保留小数点后1位)。
③实验中若分几次加入

 溶液,所测中和热
溶液,所测中和热
___________ (填“偏大”、“偏小”或“不变”)。
(3)在催化剂存在下,反应 可表示为如图所示:
可表示为如图所示:
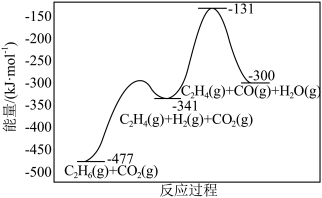
该反应的
___________  ,包含
,包含___________ 个基元反应。
(1)杭州亚运会首次使用废碳(
 )绿色循环再生技术合成的零碳甲醇(
)绿色循环再生技术合成的零碳甲醇( )燃料作为主火炬燃料,是对绿色亚运的美好诠释。
)燃料作为主火炬燃料,是对绿色亚运的美好诠释。①下列有关零碳甲醇作主火炬燃料的优势说法正确的是
A.环保,燃烧高效,可实现循环内零排放
B.安全,不易爆炸,储存运输安全便捷
C.可靠,持续燃烧,极端天气不易熄灭
D.经济,废碳再生,燃料成本低
E.可视,火焰亮丽稳定
②已知:反应Ⅰ:

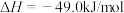
反应Ⅱ:
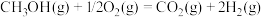
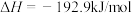
过程Ⅲ:

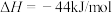
表示甲醇蒸汽燃烧热的热化学方程式为
(2)取
 的
的 溶液
溶液 与
与 硫酸溶液
硫酸溶液 置于如图所示的装置中进行中和反应反应热的测定实验。回答下列问题:
置于如图所示的装置中进行中和反应反应热的测定实验。回答下列问题:
①从图中实验装置看,其中缺少的一种玻璃仪器是
②四次实验数据如下,表中温差平均值为
| 实验次数 | 起始温度 /℃ /℃ | 终止温度 /℃ /℃ | 温差平均值/℃ | ||
| 硫酸溶液 |  溶液 溶液 | 反应前温度 | |||
| 1 | 26.2 | 26.6 | 26.4 | 29.9 | |
| 2 | 27.0 | 27.4 | 27.2 | 32.3 | |
| 3 | 25.9 | 25.9 | 25.9 | 29.3 | |
| 4 | 26.4 | 26.2 | 26.3 | 29.6 | |

 溶液和
溶液和 硫酸溶液的密度都是
硫酸溶液的密度都是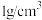 ,反应后生成的溶液比热容
,反应后生成的溶液比热容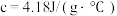 ,则中和反应反应热
,则中和反应反应热
③实验中若分几次加入


 溶液,所测中和热
溶液,所测中和热
(3)在催化剂存在下,反应
 可表示为如图所示:
可表示为如图所示:
该反应的

 ,包含
,包含
您最近一年使用:0次
4 . N2O是《联合国气候变化框架公约》所列六种温室气体之一。目前,直接催化分解法是消除N2O的主要方法,该过程中发生的反应如下:
i.2N2O(g) 2N2(g)+O2(g) △H1
2N2(g)+O2(g) △H1
ii.2N2O(g) N2(g)+2NO(g) △H2
N2(g)+2NO(g) △H2
iii.4N2O(g) 3N2(g)+2NO2(g) △H3
3N2(g)+2NO2(g) △H3
回答下列问题:
(1)根据盖斯定律,反应2NO(g)+O2(g) 2NO2(g)的△H=
2NO2(g)的△H=___ (写出代数式即可)。
(2)已知反应i在任意温度下均能自发进行,则反应i为___ (填“吸热”或“放热”)反应。
(3)反应i的势能曲线示意图如图(…表示吸附作用,A表示催化剂,TS表示过渡态分子):
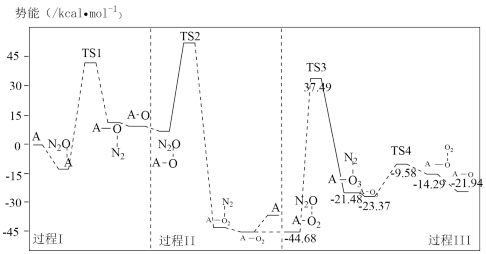
①过程Ⅲ中最大势能垒(活化能)为___ kcal·mol-1。
②下列有关反应i的说法不正确的是___ (填标号)。
A.过程Ⅰ中有极性键断裂
B.过程Ⅰ、Ⅱ、Ⅲ中都有N2生成
C.该反应中只有两种物质能够吸附N2O分子
D.过程Ⅱ中间体A—O2可释放O2也可吸附N2O分子
(4)模拟废气中N2O直接催化分解过程。
①515℃时,将模拟废气(N2O体积分数为40%)以6000m3·h-1的速度通过催化剂,测得N2O的转化率为40%,则平均反应速率v(N2O)为____ m3·h-1。欲提高N2O的转化率,可采取的措施为____ (任写一条)。
②T℃和P0kPa时,在恒压密闭容器中进行模拟实验。各组分的相关信息如表:
其中x=____ ,N2O的平衡转化率为____ (保留三位有效数字);该温度下,反应2N2O(g) 2N2(g)+O2(g)的压强平衡常数Kp=
2N2(g)+O2(g)的压强平衡常数Kp=___ kPa(以分压表示,分压=总压×物质的量分数)。
i.2N2O(g)
 2N2(g)+O2(g) △H1
2N2(g)+O2(g) △H1ii.2N2O(g)
 N2(g)+2NO(g) △H2
N2(g)+2NO(g) △H2iii.4N2O(g)
 3N2(g)+2NO2(g) △H3
3N2(g)+2NO2(g) △H3回答下列问题:
(1)根据盖斯定律,反应2NO(g)+O2(g)
 2NO2(g)的△H=
2NO2(g)的△H=(2)已知反应i在任意温度下均能自发进行,则反应i为
(3)反应i的势能曲线示意图如图(…表示吸附作用,A表示催化剂,TS表示过渡态分子):

①过程Ⅲ中最大势能垒(活化能)为
②下列有关反应i的说法不正确的是
A.过程Ⅰ中有极性键断裂
B.过程Ⅰ、Ⅱ、Ⅲ中都有N2生成
C.该反应中只有两种物质能够吸附N2O分子
D.过程Ⅱ中间体A—O2可释放O2也可吸附N2O分子
(4)模拟废气中N2O直接催化分解过程。
①515℃时,将模拟废气(N2O体积分数为40%)以6000m3·h-1的速度通过催化剂,测得N2O的转化率为40%,则平均反应速率v(N2O)为
| 物质 | N2 | N2O | O2 | CO2 | NO | NO2 |
| n(投料)/mol | 19 | 34 | 6.5 | 25 | 0 | 0 |
| n(平衡)/mol | 50 | x | 20 | 25 | 2 | 2 |
其中x=
 2N2(g)+O2(g)的压强平衡常数Kp=
2N2(g)+O2(g)的压强平衡常数Kp=
您最近一年使用:0次
2022-02-26更新
|
1310次组卷
|
6卷引用:湖北省十堰市郧阳中学、恩施高中、随州二中、襄阳三中2022-2023学年高二下学期5月联考化学试题
湖北省十堰市郧阳中学、恩施高中、随州二中、襄阳三中2022-2023学年高二下学期5月联考化学试题广东省深圳市普通高中2022届高三下学期第一次调研考试化学试题(已下线)【直击双一流】07-备战2022年高考化学名校进阶模拟卷(通用版)(已下线)专项16 化学反应原理综合题-备战2022年高考化学阶段性新题精选专项特训(全国卷)(3月期)湖南省常宁市第一中学2021-2022学年高三下学期期中考试化学试题(已下线)押江苏卷第18题 化学反应原理综合题 -备战2022年高考化学临考题号押题(江苏卷)
5 . 我国力争于2030年前做到碳达峰,2060年前实现碳中和。CH4与CO2重整是CO2利用的研究热点之一、该重整反应体系主要涉及以下反应:
a)

b)

c)

d)

e)

(1)已知相关物质的燃烧热(25℃、101 kPa):
则△H1=___________ 。
(2)上述反应体系在一定条件下建立平衡后,下列说法正确的有___________。
(3)一定条件下,CH4分解形成碳的反应历程如图所示。该历程分___________ 步进行,其中,第___________ 步的正反应活化能最大。

(4)900℃下,将CH4和CO2的混合气体(投料比1:1)按一定流速通过盛有炭催化剂的反应器,测得CH4的转化率受炭催化剂颗粒大小的影响如图所示。(注:目数越大,表示炭催化剂颗粒越小)

由图可知,75 min后CH4转化率与炭催化剂目数的关系为___________ ,原因是___________ 。
(5)CO2用途广泛,写出基于其物理性质的一种用途:___________ 。
a)


b)


c)


d)


e)


(1)已知相关物质的燃烧热(25℃、101 kPa):
| 物质 | CH4(g) | CO(g) | H2(g) |
燃烧热(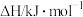 ) ) |  |  |  |
(2)上述反应体系在一定条件下建立平衡后,下列说法正确的有___________。
| A.移去部分C(s),反应c、d、e的平衡均向右移动 |
| B.增大CO2与CH4的浓度,反应a、b、c的正反应速率都增加 |
| C.加入反应a的催化剂,可提高CH4的平衡转化率 |
| D.降低反应温度,反应a~e的正、逆反应速率都减小 |

(4)900℃下,将CH4和CO2的混合气体(投料比1:1)按一定流速通过盛有炭催化剂的反应器,测得CH4的转化率受炭催化剂颗粒大小的影响如图所示。(注:目数越大,表示炭催化剂颗粒越小)

由图可知,75 min后CH4转化率与炭催化剂目数的关系为
(5)CO2用途广泛,写出基于其物理性质的一种用途:
您最近一年使用:0次
名校
6 . “氯碱工业”电解饱和食盐水为基础制取氯气等产品,氯气是实验室和工业上的常用气体。请回答:
(1)下列说法不正确的是___________。
(2)在一定温度下,氯气溶于水的过程及其平衡常数为:
 ;
;
 ,其中p为
,其中p为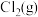 的平衡压强,
的平衡压强, 为Cl2在水溶液中的平衡浓度。
为Cl2在水溶液中的平衡浓度。
① 的焓变
的焓变
___________ 0。(填“>”、“=”或“<”)
②平衡常数K2的表达式为K2=___________ 。氯气在水中的溶解度(以物质的量浓度表示)为c,则c=___________ 。(用平衡压强p和上述平衡常数表示,忽略HClO的电离)
(3)工业上常采用“加碳氯化”的方法以高钛渣(主成分 )为原料生产
)为原料生产 ,相应化学方程式为:
,相应化学方程式为:
Ⅰ.
 ,
,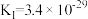
Ⅱ.
 ,
,
结合数据说明氯化过程中加碳的理由___________ 。
(4)在一定温度下,以 为催化剂,氯苯和
为催化剂,氯苯和 在
在 中发生平行反应,分别生成邻二氯苯和对二氯苯,两产物浓度之比与反应时间无关。反应物起始浓度均为0.5mol/L,反应30min测得氯苯15%转化为邻二氯苯,25%转化为对二氯苯。保持其他条件不变,若要提高产物中邻二氯苯的比例,可采用的最佳措施是
中发生平行反应,分别生成邻二氯苯和对二氯苯,两产物浓度之比与反应时间无关。反应物起始浓度均为0.5mol/L,反应30min测得氯苯15%转化为邻二氯苯,25%转化为对二氯苯。保持其他条件不变,若要提高产物中邻二氯苯的比例,可采用的最佳措施是___________ 。
(1)下列说法不正确的是___________。
| A.可采用碱石灰干燥氯气 |
| B.可通过排饱和食盐水法收集氯气 |
| C.常温下,可通过加压使氯气液化而储存于钢瓶中 |
| D.工业上,常用氢气和氯气反应生成的氯化氢溶于水制取盐酸 |

 ;
;
 ,其中p为
,其中p为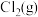 的平衡压强,
的平衡压强, 为Cl2在水溶液中的平衡浓度。
为Cl2在水溶液中的平衡浓度。①
 的焓变
的焓变
②平衡常数K2的表达式为K2=
(3)工业上常采用“加碳氯化”的方法以高钛渣(主成分
 )为原料生产
)为原料生产 ,相应化学方程式为:
,相应化学方程式为:Ⅰ.

 ,
,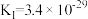
Ⅱ.

 ,
,
结合数据说明氯化过程中加碳的理由
(4)在一定温度下,以
 为催化剂,氯苯和
为催化剂,氯苯和 在
在 中发生平行反应,分别生成邻二氯苯和对二氯苯,两产物浓度之比与反应时间无关。反应物起始浓度均为0.5mol/L,反应30min测得氯苯15%转化为邻二氯苯,25%转化为对二氯苯。保持其他条件不变,若要提高产物中邻二氯苯的比例,可采用的最佳措施是
中发生平行反应,分别生成邻二氯苯和对二氯苯,两产物浓度之比与反应时间无关。反应物起始浓度均为0.5mol/L,反应30min测得氯苯15%转化为邻二氯苯,25%转化为对二氯苯。保持其他条件不变,若要提高产物中邻二氯苯的比例,可采用的最佳措施是
您最近一年使用:0次
名校
解题方法
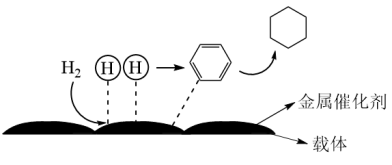
7 . 苯催化加氢制备环己烷是化工生产中的重要工艺,一定条件下,发生如下反应:
Ⅰ:主反应: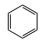 (g) + 3H2(g)⇌
(g) + 3H2(g)⇌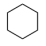 (g) ∆H1<0
(g) ∆H1<0
Ⅱ:副反应: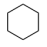 (g)⇌
(g)⇌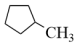 (g) ∆H2>0
(g) ∆H2>0
回答下列问题:
(1)已知:Ⅲ:2H2(g) + O2(g) = 2H2O(l) ∆H3
Ⅳ:2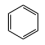 (g)+15O2(g)⇌12CO2(g)+6H2O(l) ∆H4
(g)+15O2(g)⇌12CO2(g)+6H2O(l) ∆H4
Ⅴ: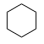 (g)+9O2(g)=6CO2(g)+6H2O(l) ∆H5
(g)+9O2(g)=6CO2(g)+6H2O(l) ∆H5
则∆H1=_______ (用∆H3、∆H4和∆H5表示)。
(2)有利于提高平衡体系中环己烷体积分数的措施有_______。
(3)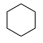 和
和 的燃烧热较大的是
的燃烧热较大的是_______ 。
(4)反应Ⅰ在管式反应器中进行,实际投料往往在n(H2):n(C6H6)=3:1的基础上适当增大H2用量,其目的是_______ 。
(5)氢原子和苯分子吸附在催化剂表面活性中心时,才能发生反应,机理如图。下列说法不正确的是_______
(6)当H2中混有微量H2S或CO等杂质时,会导致反应Ⅰ的产率降低,推测其可能原因为_______ 。
Ⅰ:主反应:
 (g) + 3H2(g)⇌
(g) + 3H2(g)⇌ (g) ∆H1<0
(g) ∆H1<0Ⅱ:副反应:
 (g)⇌
(g)⇌ (g) ∆H2>0
(g) ∆H2>0回答下列问题:
(1)已知:Ⅲ:2H2(g) + O2(g) = 2H2O(l) ∆H3
Ⅳ:2
 (g)+15O2(g)⇌12CO2(g)+6H2O(l) ∆H4
(g)+15O2(g)⇌12CO2(g)+6H2O(l) ∆H4Ⅴ:
 (g)+9O2(g)=6CO2(g)+6H2O(l) ∆H5
(g)+9O2(g)=6CO2(g)+6H2O(l) ∆H5则∆H1=
(2)有利于提高平衡体系中环己烷体积分数的措施有_______。
| A.适当升温 | B.适当降温 | C.适当加压 | D.使用高效催化剂 |
 和
和 的燃烧热较大的是
的燃烧热较大的是(4)反应Ⅰ在管式反应器中进行,实际投料往往在n(H2):n(C6H6)=3:1的基础上适当增大H2用量,其目的是
(5)氢原子和苯分子吸附在催化剂表面活性中心时,才能发生反应,机理如图。下列说法不正确的是_______

| A.此反应(苯催化加氢制备环己烷)的原子利用率为100% |
| B.反应过程中,有H—H、C=C键的断裂和C—H键的生成 |
| C.载体可以增大金属催化剂的表面积,提高催化效率 |
| D.该催化剂可有效提高反应物的平衡转化率 |
您最近一年使用:0次
2021-11-06更新
|
120次组卷
|
2卷引用:湖北省沙市中学2021-2022学年高二上学期期中考试化学试题
8 . 工业生产硫酸中,SO2的催化氧化是关键步骤,排放处理未达标的尾气会产生严重的空气污染。回答下列问题:
(1)SO2是形成酸雨的污染物之一,酸雨的pH范围是___________ 。
(2)已知:①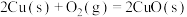
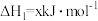
②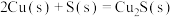
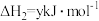
③
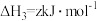
写出Cu2S和O2反应生成 和SO2的热化学方程式
和SO2的热化学方程式___________ 。
(3)硫酸工业中涉及反应: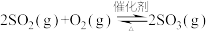
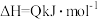 。一定条件下,在恒压密闭容器中,通入2 molSO2和1 mol O2发生上述反应,
。一定条件下,在恒压密闭容器中,通入2 molSO2和1 mol O2发生上述反应, 的平衡转化率和压强、温度的关系如图所示。a点时该反应的压强平衡常数Kp=
的平衡转化率和压强、温度的关系如图所示。a点时该反应的压强平衡常数Kp=___________ (保留三位有效数字,已知:分压=气体总压强×该气体的物质的量分数,用各气体物质的分压替代浓度计算的平衡常数叫压强平衡常数)。恒压条件下,关于该反应的下列说法中正确的是___________ 。
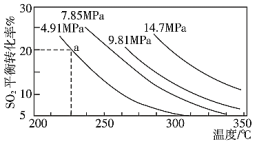
A.Q大于0
B.相同时间内生成0.2 mol SO2,同时消耗0.1 mol O2,反应达到平衡
C.相同温度下压强越大,SO2的转化率就越大,该反应的平衡常数就越大
D.反应达到平衡后,保持温度不变,再充入2 mol SO2和1 mol O2,SO2的平衡转化率不变
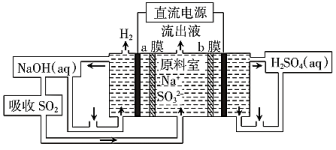
(4)用如图装置回收SO2,可制得硫酸,电极均为惰性电极,a、b膜分别为阳离子、阴离子交换膜,写出阴极的电极反应式___________ 。当阴极收集到标准状况下的H2 44.8 L时,理论上在阳极能得到___________ gH2SO4。
(1)SO2是形成酸雨的污染物之一,酸雨的pH范围是
(2)已知:①
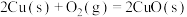
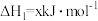
②
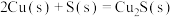
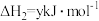
③

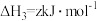
写出Cu2S和O2反应生成
 和SO2的热化学方程式
和SO2的热化学方程式(3)硫酸工业中涉及反应:
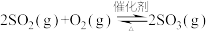
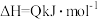 。一定条件下,在恒压密闭容器中,通入2 molSO2和1 mol O2发生上述反应,
。一定条件下,在恒压密闭容器中,通入2 molSO2和1 mol O2发生上述反应, 的平衡转化率和压强、温度的关系如图所示。a点时该反应的压强平衡常数Kp=
的平衡转化率和压强、温度的关系如图所示。a点时该反应的压强平衡常数Kp=
A.Q大于0
B.相同时间内生成0.2 mol SO2,同时消耗0.1 mol O2,反应达到平衡
C.相同温度下压强越大,SO2的转化率就越大,该反应的平衡常数就越大
D.反应达到平衡后,保持温度不变,再充入2 mol SO2和1 mol O2,SO2的平衡转化率不变
(4)用如图装置回收SO2,可制得硫酸,电极均为惰性电极,a、b膜分别为阳离子、阴离子交换膜,写出阴极的电极反应式

您最近一年使用:0次
9 . 二甲醚是一种清洁能源,用水煤气制取甲醚的原理如下:
I、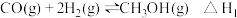
II、
(1)则 的
的
_____ (用 、
、 表示)
表示)
(2)300℃和500℃时,反应I的平衡常数分别为K1、K2,且K1>K2,则其正反应为______ 反应(填“吸热”或“放热”)。
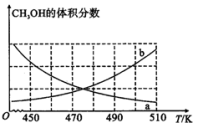
(3)在恒容密闭容器中发生反应I:
①下图能正确反映体系中甲醇体积分数随温度变化情况的曲线是___________ (填“a”或“b”)。
②下列说法能表明反应已达平衡状态的是___________ (填标号)。
A、容器中气体的压强不再变化
B、混合气体的密度不再变化
C、混合气体的平均相对分子质量不再变化
D、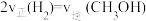
(4)500K时,在2L密闭容器中充入4molCO和8molH2,4min达到平衡,平衡时CO的转化率为80%,且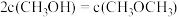 ,则:
,则:
①0~4min,反应I的v(H2)=___________ ,反应I的平衡常数K=___________ 。
②反应II中CH3OH的转化率α=___________ 。
I、
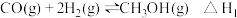
II、

(1)则
 的
的
 、
、 表示)
表示)(2)300℃和500℃时,反应I的平衡常数分别为K1、K2,且K1>K2,则其正反应为
(3)在恒容密闭容器中发生反应I:
①下图能正确反映体系中甲醇体积分数随温度变化情况的曲线是

②下列说法能表明反应已达平衡状态的是
A、容器中气体的压强不再变化
B、混合气体的密度不再变化
C、混合气体的平均相对分子质量不再变化
D、
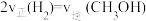
(4)500K时,在2L密闭容器中充入4molCO和8molH2,4min达到平衡,平衡时CO的转化率为80%,且
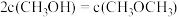 ,则:
,则:①0~4min,反应I的v(H2)=
②反应II中CH3OH的转化率α=
您最近一年使用:0次
2021·全国·模拟预测
10 . 我国力争于 2030 年前做到碳达峰,2060 年前实现碳中和。二氧化碳加氢制备甲醇既可以实现二氧化碳的转化利用,又可以有效缓解温室效应问题。
已知:反应 I:CO2(g)+H2(g)=CO(g)+H2O(g) ΔH1=akJ·mol-1
反应 II:CO(g)+2H2(g)=CH3OH(g) ΔH2=b kJ·mol-1
反应III:CO2(g)+3H2(g)=CH3OH(g)+H2O(g) ΔH3
(1)原料 CO2可通过捕获技术从空气或工业尾气中获取,下列物质能作为 CO2 捕获剂的是_______(填标号)。
(2)根据盖斯定律,反应 III 的ΔH3=_______ kJ·mol-1
(3)对于上述 CO2加氢合成 CH3OH 的体系,下列说法错误的是_______(填标号)。
(4)上述反应平衡常数的自然对数 ln Kp(Kp是以分压表示的平衡常数,分压=总压×物质的量分数)随温度的变化如图所示:
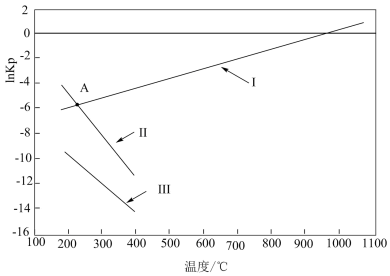
①反应I、II、III 中属于吸热反应的是_______ ,写出推理过程_______ 。
②若图中 A 点时发生反应 CH3OH(g)+CO2(g) ⇌2CO(g)+H2(g)+H2O(g),则lnKp=_______ (填数值)。
③若T0℃时,在密闭容器中加入 6 mol H2、4 molCO2只进行反应:CO2(g)+3H2(g)⇌CH3OH(g)+H2O(g),维持压强为 p0kPa不变,达到平衡时H2的转化率是50%,则该温度下反应的平衡常数Kp=_______ 。
已知:反应 I:CO2(g)+H2(g)=CO(g)+H2O(g) ΔH1=akJ·mol-1
反应 II:CO(g)+2H2(g)=CH3OH(g) ΔH2=b kJ·mol-1
反应III:CO2(g)+3H2(g)=CH3OH(g)+H2O(g) ΔH3
(1)原料 CO2可通过捕获技术从空气或工业尾气中获取,下列物质能作为 CO2 捕获剂的是_______(填标号)。
| A.NaOH 溶液 | B.浓氨水 | C.CH3CH2OH | D.NH4Cl 溶液 |
(3)对于上述 CO2加氢合成 CH3OH 的体系,下列说法错误的是_______(填标号)。
| A.增大 H2浓度有利于提高 CO2的转化率 |
| B.若气体的平均相对分子质量保持不变,说明反应体系已达平衡 |
| C.体系达平衡后,若压缩体积,则反应 I 平衡不移动,反应 III 平衡逆向移动 |
| D.选用合适的催化剂可以提高 CH3OH 在单位时间内的产量 |

①反应I、II、III 中属于吸热反应的是
②若图中 A 点时发生反应 CH3OH(g)+CO2(g) ⇌2CO(g)+H2(g)+H2O(g),则lnKp=
③若T0℃时,在密闭容器中加入 6 mol H2、4 molCO2只进行反应:CO2(g)+3H2(g)⇌CH3OH(g)+H2O(g),维持压强为 p0kPa不变,达到平衡时H2的转化率是50%,则该温度下反应的平衡常数Kp=
您最近一年使用:0次
2021-09-30更新
|
902次组卷
|
4卷引用:湖北省部分重点中学(武汉市,十堰市,襄阳市,恩施土家族苗族自治州)2022-2023学年高二下学期三月智学联合检测化学试题
湖北省部分重点中学(武汉市,十堰市,襄阳市,恩施土家族苗族自治州)2022-2023学年高二下学期三月智学联合检测化学试题(已下线)第8周 周测卷-备战2022年高考化学周测与晚练(新高考专用)2020年全国卷Ⅰ理综化学高考真题变式题广东省2022届高三上学期综合能力测试(一)化学试题



