2023·全国·模拟预测
解题方法
1 . 煤和石油等化石燃料燃烧产生的 是大气中氮氧化物的主要来源。选择性催化还原脱硝技术是控制尾部烟气中
是大气中氮氧化物的主要来源。选择性催化还原脱硝技术是控制尾部烟气中 排放的最成熟有效的技术之一
排放的最成熟有效的技术之一
Ⅰ.在相同时间内,三种催化剂下NO的转化率、 浓度随温度变化如图1所示。空速(规定的条件下,单位时间、单位体积催化剂处理的气体量)的大小直接决定了烟气在催化剂表面的停留时间和装置的烟气处理能力。催化剂能够适应较大的空速,就可以在保证足够高的脱硝效率的前提下提高催化剂处理烟气的能力。相同时间内,MnCeZr催化剂在不同空速下NO的转化率随温度的变化如图2所示。
浓度随温度变化如图1所示。空速(规定的条件下,单位时间、单位体积催化剂处理的气体量)的大小直接决定了烟气在催化剂表面的停留时间和装置的烟气处理能力。催化剂能够适应较大的空速,就可以在保证足够高的脱硝效率的前提下提高催化剂处理烟气的能力。相同时间内,MnCeZr催化剂在不同空速下NO的转化率随温度的变化如图2所示。
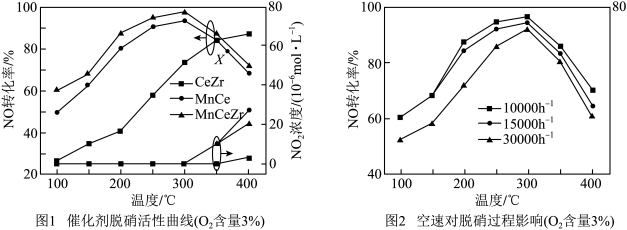
(1)根据图1和图2分析,选取工业脱硝的最佳反应条件为___________ 。350~400℃产生较多 的原因为
的原因为___________ 。
(2)通过改善催化剂的结构特性可以使脱硝效率得到提升。较低温度下,MnCeZr催化剂的脱硝效率远高于CeZr催化剂,说明主要是___________ (填元素符号)的存在改善了催化剂的低温活性。在MnCe催化剂催化下,X点的正反应速率___________ (填“>”“<”或“=”)逆反应速率,说明理由:___________ 。
Ⅱ.氧气的添加可以使较低温度下催化剂的脱硝效率迅速提高,氧气会与未反应的氨气反应。
i.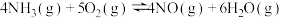

ii.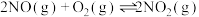
iii.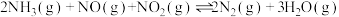
iv.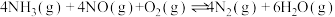
(3) =
=___________ (用 、
、 表示)。
表示)。
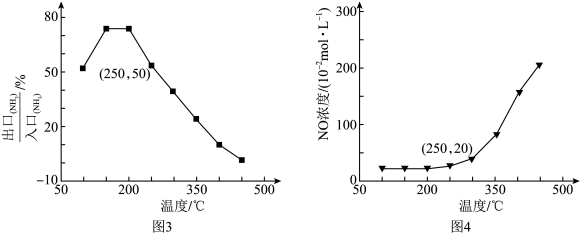
(4)已知反应i和反应iv为竞争反应,若只考虑这两个反应,相同时间内 的值随温度变化及出口NO浓度随温度变化分别如图3、图4所示。在容积为2L的恒容密闭容器中,
的值随温度变化及出口NO浓度随温度变化分别如图3、图4所示。在容积为2L的恒容密闭容器中, 、
、 均以4mol投料,250℃时反应已达平衡,则此时反应iv的平衡常数K=
均以4mol投料,250℃时反应已达平衡,则此时反应iv的平衡常数K=___________ (列出计算式)。
 是大气中氮氧化物的主要来源。选择性催化还原脱硝技术是控制尾部烟气中
是大气中氮氧化物的主要来源。选择性催化还原脱硝技术是控制尾部烟气中 排放的最成熟有效的技术之一
排放的最成熟有效的技术之一Ⅰ.在相同时间内,三种催化剂下NO的转化率、
 浓度随温度变化如图1所示。空速(规定的条件下,单位时间、单位体积催化剂处理的气体量)的大小直接决定了烟气在催化剂表面的停留时间和装置的烟气处理能力。催化剂能够适应较大的空速,就可以在保证足够高的脱硝效率的前提下提高催化剂处理烟气的能力。相同时间内,MnCeZr催化剂在不同空速下NO的转化率随温度的变化如图2所示。
浓度随温度变化如图1所示。空速(规定的条件下,单位时间、单位体积催化剂处理的气体量)的大小直接决定了烟气在催化剂表面的停留时间和装置的烟气处理能力。催化剂能够适应较大的空速,就可以在保证足够高的脱硝效率的前提下提高催化剂处理烟气的能力。相同时间内,MnCeZr催化剂在不同空速下NO的转化率随温度的变化如图2所示。
(1)根据图1和图2分析,选取工业脱硝的最佳反应条件为
 的原因为
的原因为(2)通过改善催化剂的结构特性可以使脱硝效率得到提升。较低温度下,MnCeZr催化剂的脱硝效率远高于CeZr催化剂,说明主要是
Ⅱ.氧气的添加可以使较低温度下催化剂的脱硝效率迅速提高,氧气会与未反应的氨气反应。
i.
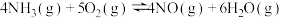

ii.
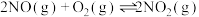
iii.
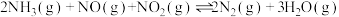
iv.
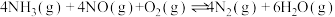
(3)
 =
= 、
、 表示)。
表示)。(4)已知反应i和反应iv为竞争反应,若只考虑这两个反应,相同时间内
 的值随温度变化及出口NO浓度随温度变化分别如图3、图4所示。在容积为2L的恒容密闭容器中,
的值随温度变化及出口NO浓度随温度变化分别如图3、图4所示。在容积为2L的恒容密闭容器中, 、
、 均以4mol投料,250℃时反应已达平衡,则此时反应iv的平衡常数K=
均以4mol投料,250℃时反应已达平衡,则此时反应iv的平衡常数K=
您最近一年使用:0次
解题方法
2 . 我国力争于2030年前做到碳达峰,2060年前实现碳中和。因此,研发二氧化碳利用技术,降低空气中二氧化碳含量成为研究热点。
I.CO2在Pb催化剂作用下,通过电催化还原为CO、HCOOH等物质被认为是一种具有前景的利用CO2的方式。
(1)Pb催化剂中引入Bi能够提高它的选择性。Bi的价电子排布式为6s26p3,其在元素周期表中的位置为___________ 。
(2)在Pb催化剂表面,CO2转化为CO和HCOOH是通过两种平行的反应途径进行的。CO2还原生成CO、HCOOH的关键中间体分别为*COOH、HCOO*。Pb催化剂催化CO2转化为CO和HCOOH的反应历程如图所示。(*表示吸附在催化剂表面)
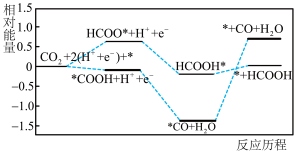
①写出CO2在酸性介质中电催化还原为HCOOH的电极反应式___________ 。
②产物的选择性是由催化剂对两种关键中间体的结合强度决定的。在Pb催化剂表面更利于生成___________
II.CH4与CO2重整是CO2再利用的研究热点之一,该重整反应体系主要涉及以下反应:
反应①:CH4(g)+CO2(g) 2CO(g)+2H2(g) ΔH1
2CO(g)+2H2(g) ΔH1
反应②:CO2(g)+H2(g) CO(g)+H2O(g) ΔH2=+41.2kJ·mol-1
CO(g)+H2O(g) ΔH2=+41.2kJ·mol-1
反应③:2CO(g) CO2(g)+C(s) ΔH3=-172.5kJ·mol-1
CO2(g)+C(s) ΔH3=-172.5kJ·mol-1
(3)已知25℃时,CH4、CO和H2的燃烧热分别为890 kJ·mol-1、283kJ·mol-1和285.8kJ·mol-1则ΔH1=___________ 。
(4)1.01×105 Pa下,将n(CO2):n(CH4)=1:1的混合气体置于密闭容器中,不同温度下重整体系中CH4和CO2的平衡转化率如图所示。
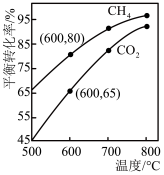
①800℃时CO2的平衡转化率远大于600℃时CO2的平衡转化率,其原因是___________ 。
②CH4的还原能力(R)可用于衡量CO2的转化效率,R=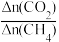 (平衡时CO2与CH4的物质的量变化量之比)。600℃时,R=
(平衡时CO2与CH4的物质的量变化量之比)。600℃时,R=___________ ;随温度的升高,R变化趋势为___________ (填“增大”、“减小”、“先减小后增大”)。
I.CO2在Pb催化剂作用下,通过电催化还原为CO、HCOOH等物质被认为是一种具有前景的利用CO2的方式。
(1)Pb催化剂中引入Bi能够提高它的选择性。Bi的价电子排布式为6s26p3,其在元素周期表中的位置为
(2)在Pb催化剂表面,CO2转化为CO和HCOOH是通过两种平行的反应途径进行的。CO2还原生成CO、HCOOH的关键中间体分别为*COOH、HCOO*。Pb催化剂催化CO2转化为CO和HCOOH的反应历程如图所示。(*表示吸附在催化剂表面)

①写出CO2在酸性介质中电催化还原为HCOOH的电极反应式
②产物的选择性是由催化剂对两种关键中间体的结合强度决定的。在Pb催化剂表面更利于生成
II.CH4与CO2重整是CO2再利用的研究热点之一,该重整反应体系主要涉及以下反应:
反应①:CH4(g)+CO2(g)
 2CO(g)+2H2(g) ΔH1
2CO(g)+2H2(g) ΔH1反应②:CO2(g)+H2(g)
 CO(g)+H2O(g) ΔH2=+41.2kJ·mol-1
CO(g)+H2O(g) ΔH2=+41.2kJ·mol-1反应③:2CO(g)
 CO2(g)+C(s) ΔH3=-172.5kJ·mol-1
CO2(g)+C(s) ΔH3=-172.5kJ·mol-1(3)已知25℃时,CH4、CO和H2的燃烧热分别为890 kJ·mol-1、283kJ·mol-1和285.8kJ·mol-1则ΔH1=
(4)1.01×105 Pa下,将n(CO2):n(CH4)=1:1的混合气体置于密闭容器中,不同温度下重整体系中CH4和CO2的平衡转化率如图所示。

①800℃时CO2的平衡转化率远大于600℃时CO2的平衡转化率,其原因是
②CH4的还原能力(R)可用于衡量CO2的转化效率,R=
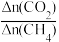 (平衡时CO2与CH4的物质的量变化量之比)。600℃时,R=
(平衡时CO2与CH4的物质的量变化量之比)。600℃时,R=
您最近一年使用:0次
2023-04-04更新
|
755次组卷
|
3卷引用:湖北省圆创2023届高三3月联合测评化学试题
名校
解题方法
3 . 汽车尾气中含有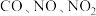 等大气污染物,可发生以下反应:
等大气污染物,可发生以下反应:
①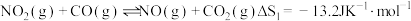
②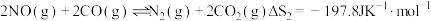
③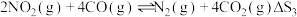
(1)已知 ,(忽略
,(忽略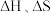 随温度的影响),则
随温度的影响),则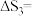
_________ 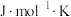 。
。
(2)反应①的平衡常数 的关系如图1:
的关系如图1:
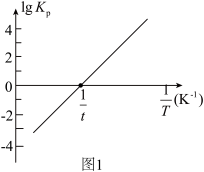
反应①为___________ (填“吸热”或“放热”)反应;温度为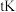 下,向恒容密闭容器中加入
下,向恒容密闭容器中加入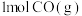 和
和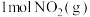 (若只发生反应①),测得起始压强为
(若只发生反应①),测得起始压强为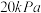 ,达到平衡时,
,达到平衡时, 的转化率为
的转化率为___________ ; 的分压为
的分压为___________  。
。
(3)向体积均为 的容器中加入
的容器中加入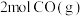 和
和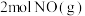 (若只发生反应②),其中甲为绝热恒容,乙为恒温恒容,两容器中压强随时间变化曲线如图2:
(若只发生反应②),其中甲为绝热恒容,乙为恒温恒容,两容器中压强随时间变化曲线如图2:
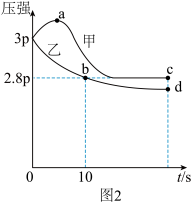
①甲容器中,开始压强增大的原因是___________
②c点的逆反应速率大于b点的逆反应速率的原因是___________
③c点对应的平衡常数___________ d点对应的平衡常数(填“大于”、“小于”或“等于”)。
 等大气污染物,可发生以下反应:
等大气污染物,可发生以下反应:①
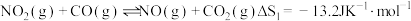
②
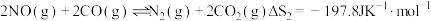
③
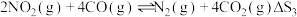
(1)已知
 ,(忽略
,(忽略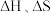 随温度的影响),则
随温度的影响),则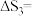
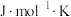 。
。(2)反应①的平衡常数
 的关系如图1:
的关系如图1:
反应①为
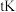 下,向恒容密闭容器中加入
下,向恒容密闭容器中加入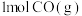 和
和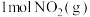 (若只发生反应①),测得起始压强为
(若只发生反应①),测得起始压强为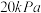 ,达到平衡时,
,达到平衡时, 的转化率为
的转化率为 的分压为
的分压为 。
。(3)向体积均为
 的容器中加入
的容器中加入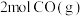 和
和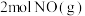 (若只发生反应②),其中甲为绝热恒容,乙为恒温恒容,两容器中压强随时间变化曲线如图2:
(若只发生反应②),其中甲为绝热恒容,乙为恒温恒容,两容器中压强随时间变化曲线如图2:
①甲容器中,开始压强增大的原因是
②c点的逆反应速率大于b点的逆反应速率的原因是
③c点对应的平衡常数
您最近一年使用:0次
2023-03-31更新
|
540次组卷
|
2卷引用:湖北省十一校2023届高三第二次联考化学试题
4 . 根据所学的化学反应原理知识回答下列问题。
(1)已知关于铁的氧化物存在下列三个热化学方程式:

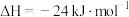 ①
①
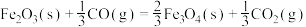
 ②
②

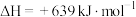 ③
③
则CO还原FeO的热化学方程式为 △H=
△H=_______ kJ∙mol−1。
(2)下表所列数据是反应
 在不同温度下的化学平衡常数(K)。
在不同温度下的化学平衡常数(K)。
①此反应_______ 自发(填“高温”、“低温”或“不能”)。
②某温度下,将2mol CO和6mol 充入2L的密闭容器中,充分反应后,达到平衡时测得
充入2L的密闭容器中,充分反应后,达到平衡时测得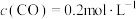 ,此时的温度是
,此时的温度是_______ 。
③要提高CO的转化率,可以采取的措施是_______ 。
A.升温 B.恒容充入CO C.恒容充入 D.恒压充入惰性气体 E.分离出甲醇
D.恒压充入惰性气体 E.分离出甲醇
(3)毒重石的主要成分为 (含
(含 、
、 、
、 等杂质),实验室利用毒重石制备
等杂质),实验室利用毒重石制备 的流程如图:
的流程如图:

已知: ,
,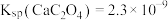 。
。
加入 调
调 可除去
可除去_______ (填离子符号),滤渣Ⅱ中含_______ (填化学式)。加入 时应避免过量,原因是
时应避免过量,原因是_______ 。
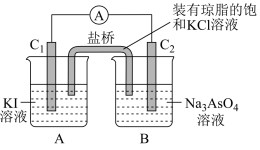
(4)已知 是可逆反应,设计如图装置(
是可逆反应,设计如图装置( 、
、 均为石墨电极)。开始时:
均为石墨电极)。开始时: 棒上电极反应为
棒上电极反应为_______ ,当电流表_______ 时,反应达到化学平衡状态。
(1)已知关于铁的氧化物存在下列三个热化学方程式:

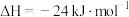 ①
①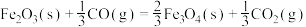
 ②
②
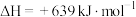 ③
③则CO还原FeO的热化学方程式为
 △H=
△H=(2)下表所列数据是反应

 在不同温度下的化学平衡常数(K)。
在不同温度下的化学平衡常数(K)。| 温度/℃ | 250 | 300 | 350 |
| 平衡常数(K) | 2.04 | 0.27 | 0.012 |
②某温度下,将2mol CO和6mol
 充入2L的密闭容器中,充分反应后,达到平衡时测得
充入2L的密闭容器中,充分反应后,达到平衡时测得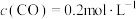 ,此时的温度是
,此时的温度是③要提高CO的转化率,可以采取的措施是
A.升温 B.恒容充入CO C.恒容充入
 D.恒压充入惰性气体 E.分离出甲醇
D.恒压充入惰性气体 E.分离出甲醇(3)毒重石的主要成分为
 (含
(含 、
、 、
、 等杂质),实验室利用毒重石制备
等杂质),实验室利用毒重石制备 的流程如图:
的流程如图:
已知:
 ,
,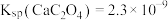 。
。 |  |  | |
| 开始沉淀时的pH | 11.9 | 9.1 | 1.9 |
| 完全沉淀时的pH | 13.9 | 11.1 | 3.2 |
 调
调 可除去
可除去 时应避免过量,原因是
时应避免过量,原因是(4)已知
 是可逆反应,设计如图装置(
是可逆反应,设计如图装置( 、
、 均为石墨电极)。开始时:
均为石墨电极)。开始时: 棒上电极反应为
棒上电极反应为
您最近一年使用:0次
名校
解题方法
5 . 甲烷除做燃料外,还可用于化工合成及其他应用。
(1) 可用于消除氮氧化物,反应原理如下:
可用于消除氮氧化物,反应原理如下:
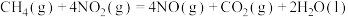
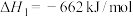
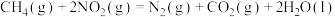
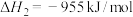


_______ kJ/mol
(2) 可用于生产甲醇,传统反应分两个阶段,原理为(ⅰ)
可用于生产甲醇,传统反应分两个阶段,原理为(ⅰ) ,(ⅱ)
,(ⅱ)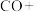
 ,过程中可能发生的副反应为
,过程中可能发生的副反应为_______ ;某条件下按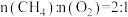 进行反应(ⅰ),各物质的量随时间变化如图,其中表示
进行反应(ⅰ),各物质的量随时间变化如图,其中表示 和CO的曲线分别为
和CO的曲线分别为_______ 。 ,(ⅱ)
,(ⅱ)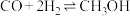 ;某温度下,向2L恒容密闭容器中充入3mol
;某温度下,向2L恒容密闭容器中充入3mol  和3mol
和3mol  发生反应,各物质的量变化如下表;
发生反应,各物质的量变化如下表;
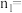
_______ mol,0~ 时刻用
时刻用 表示反应(ⅰ)的平均反应速率为
表示反应(ⅰ)的平均反应速率为_______ mol/(L·min)(用含 的式子表示),该温度下反应(ⅰ)的平衡常数为
的式子表示),该温度下反应(ⅰ)的平衡常数为_______ 。
(4)科学家研究发现在一种特殊催化剂作用下,水可促进 、
、 高选择性的直接合成
高选择性的直接合成 ,其中部分反应机理如图所示。
,其中部分反应机理如图所示。 在
在 氧化合成甲醇过程中的作用是
氧化合成甲醇过程中的作用是_______ ,决定反应进行的最大能垒(活化能)为_______ kJ/mol,该步骤的化学方程式为_______ ;在催化剂表面, 和
和 更容易被吸附的是
更容易被吸附的是_______ 。
(1)
 可用于消除氮氧化物,反应原理如下:
可用于消除氮氧化物,反应原理如下: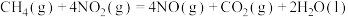
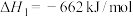
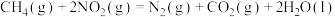
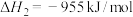


(2)
 可用于生产甲醇,传统反应分两个阶段,原理为(ⅰ)
可用于生产甲醇,传统反应分两个阶段,原理为(ⅰ) ,(ⅱ)
,(ⅱ)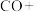
 ,过程中可能发生的副反应为
,过程中可能发生的副反应为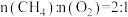 进行反应(ⅰ),各物质的量随时间变化如图,其中表示
进行反应(ⅰ),各物质的量随时间变化如图,其中表示 和CO的曲线分别为
和CO的曲线分别为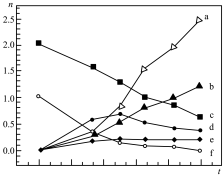
 ,(ⅱ)
,(ⅱ)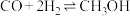 ;某温度下,向2L恒容密闭容器中充入3mol
;某温度下,向2L恒容密闭容器中充入3mol  和3mol
和3mol  发生反应,各物质的量变化如下表;
发生反应,各物质的量变化如下表;t/min n/mol | 0 |  |  |  | 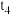 |
 | 3 | 2 | 1.5 | 0.5 | |
 | 3 | 2 | 1.5 | 0.5 | |
| CO | 0 | 3 | |||
 | 0 | 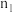 | 0.5 | 1 | |
 | 0 | 0.75 | 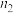 | 2 |
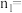
 时刻用
时刻用 表示反应(ⅰ)的平均反应速率为
表示反应(ⅰ)的平均反应速率为 的式子表示),该温度下反应(ⅰ)的平衡常数为
的式子表示),该温度下反应(ⅰ)的平衡常数为(4)科学家研究发现在一种特殊催化剂作用下,水可促进
 、
、 高选择性的直接合成
高选择性的直接合成 ,其中部分反应机理如图所示。
,其中部分反应机理如图所示。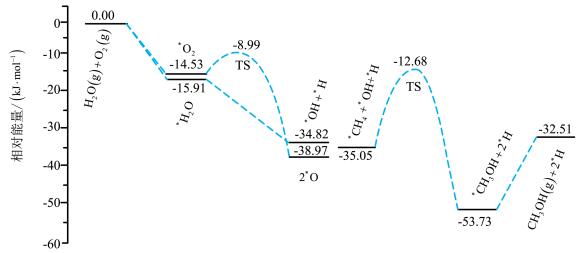
 在
在 氧化合成甲醇过程中的作用是
氧化合成甲醇过程中的作用是 和
和 更容易被吸附的是
更容易被吸附的是
您最近一年使用:0次
2023-02-24更新
|
477次组卷
|
4卷引用:湖北省华中师范大学第一附属中学等高考联盟2023届高三下学期2月联考化学试题
湖北省华中师范大学第一附属中学等高考联盟2023届高三下学期2月联考化学试题(已下线)预测卷05-【大题精做】冲刺2023年高考化学大题突破+限时集训(新高考专用)(已下线)化学反应速率和化学平衡陕西省安康市高新中学2023-2024学年高三下学期2月月考理综试题-高中化学
名校
6 . I.中国科学家首次实现了二氧化碳到淀粉的全合成,相关成果由国际知名学术期刊《科学》在线发表。 的捕集、利用与封存是科学家研究的重要课题,利用
的捕集、利用与封存是科学家研究的重要课题,利用 与
与 制备“合成气”
制备“合成气” ,合成气可直接制备甲醇,反应原理为:
,合成气可直接制备甲醇,反应原理为: 。
。
(1)若要该反应自发进行,_______ (填“高温”或“低温”)更有利。
(2)在恒温,恒容密闭容器中,对于合成气合成甲醇的反应,下列说法中能说明该反应达到化学平衡状态的是_______(填字母序号)。
(3)工业上也可以用电解法捕获 在酸性水溶液中用惰性电极电解制得乙烯,其原理如图所示,则b电极上的电极反应为
在酸性水溶液中用惰性电极电解制得乙烯,其原理如图所示,则b电极上的电极反应为_______ 。 转化为
转化为 是降碳并生产化工原料的常用方法,有关反应如下:
是降碳并生产化工原料的常用方法,有关反应如下:
①
②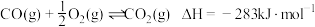
③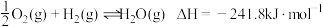
则反应: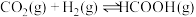 中
中
_______ 
II.我国学者结合实验与计算机模拟结果,研究了 的反应历程。在催化剂作用下,此反应为
的反应历程。在催化剂作用下,此反应为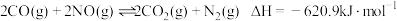 。可有效降低汽车尾气污染物排放。
。可有效降低汽车尾气污染物排放。
(5)探究温度、压强( ,
, )对反应
)对反应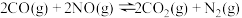 的影响,如图所示,表示
的影响,如图所示,表示 的是
的是_______ (填标号)。 的恒容密闭容器中充入
的恒容密闭容器中充入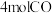 和
和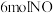 ,发生上述反应,当反应达到平衡时容器内压强变为起始时的
,发生上述反应,当反应达到平衡时容器内压强变为起始时的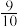 ,此温度下该反应的平衡常数
,此温度下该反应的平衡常数
_______  。
。
(7)若在相同时间内测得 的转化率随温度的变化曲线如图,
的转化率随温度的变化曲线如图, 的转化率在
的转化率在 之间下降由缓到急的原因是
之间下降由缓到急的原因是_______ 。
 的捕集、利用与封存是科学家研究的重要课题,利用
的捕集、利用与封存是科学家研究的重要课题,利用 与
与 制备“合成气”
制备“合成气” ,合成气可直接制备甲醇,反应原理为:
,合成气可直接制备甲醇,反应原理为: 。
。(1)若要该反应自发进行,
(2)在恒温,恒容密闭容器中,对于合成气合成甲醇的反应,下列说法中能说明该反应达到化学平衡状态的是_______(填字母序号)。
| A.混合气体的平均相对分子质量不再变化 | B.混合气体的密度不再变化 |
C. 的百分含量不再变化 的百分含量不再变化 | D.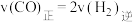 |
(3)工业上也可以用电解法捕获
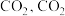 在酸性水溶液中用惰性电极电解制得乙烯,其原理如图所示,则b电极上的电极反应为
在酸性水溶液中用惰性电极电解制得乙烯,其原理如图所示,则b电极上的电极反应为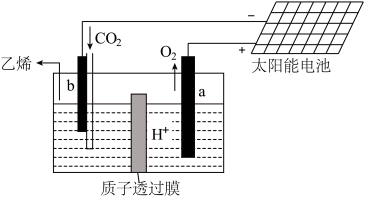
 转化为
转化为 是降碳并生产化工原料的常用方法,有关反应如下:
是降碳并生产化工原料的常用方法,有关反应如下:①

②
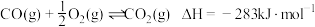
③
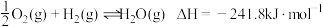
则反应:
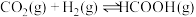 中
中

II.我国学者结合实验与计算机模拟结果,研究了
 的反应历程。在催化剂作用下,此反应为
的反应历程。在催化剂作用下,此反应为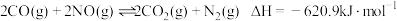 。可有效降低汽车尾气污染物排放。
。可有效降低汽车尾气污染物排放。(5)探究温度、压强(
 ,
, )对反应
)对反应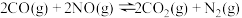 的影响,如图所示,表示
的影响,如图所示,表示 的是
的是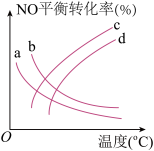
 的恒容密闭容器中充入
的恒容密闭容器中充入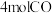 和
和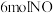 ,发生上述反应,当反应达到平衡时容器内压强变为起始时的
,发生上述反应,当反应达到平衡时容器内压强变为起始时的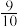 ,此温度下该反应的平衡常数
,此温度下该反应的平衡常数
 。
。(7)若在相同时间内测得
 的转化率随温度的变化曲线如图,
的转化率随温度的变化曲线如图, 的转化率在
的转化率在 之间下降由缓到急的原因是
之间下降由缓到急的原因是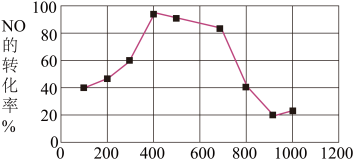
您最近一年使用:0次
名校
解题方法
7 .  的排放是形成酸雨的重要原因之一,工业上可采用多种方法减少
的排放是形成酸雨的重要原因之一,工业上可采用多种方法减少 的排放。回答下列问题:
的排放。回答下列问题:
(1) 还原法:
还原法:
已知: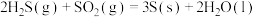
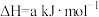 ;
; 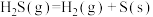
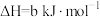 。
。
则 和
和 反应生成
反应生成 和
和 的热化学方程式为
的热化学方程式为_______ 。
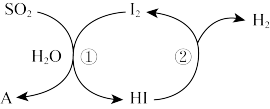
(2)碘循环法的循环过程如图所示,反应①的化学方程式为_______ ,在整个循环系统中做催化剂的物质是_______ (填化学式)。
(3)钠碱循环法:用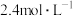 的
的 溶液吸收尾气中的
溶液吸收尾气中的 。
。
①上述 溶液中:
溶液中: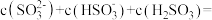
_______  ;
;
_______ 。
②室温下,当溶液的pH约为6时, 溶液吸收
溶液吸收 能力显著下降,此时溶液中
能力显著下降,此时溶液中 的浓度是
的浓度是 ,则此时溶液中各离子浓度由大到小的顺序为
,则此时溶液中各离子浓度由大到小的顺序为_______ 。
(4)氨石灰水法:
第一步:用过量的浓氨水吸收 ,并在空气中氧化;
,并在空气中氧化;
第二步:加入澄清石灰水。
已知:室温下,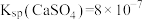 ,
,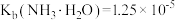 ,则室温下,第二步反应:
,则室温下,第二步反应: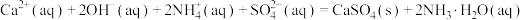 的平衡常数
的平衡常数
_______ 。
 的排放是形成酸雨的重要原因之一,工业上可采用多种方法减少
的排放是形成酸雨的重要原因之一,工业上可采用多种方法减少 的排放。回答下列问题:
的排放。回答下列问题:(1)
 还原法:
还原法:已知:
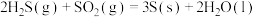
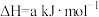 ;
; 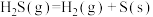
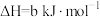 。
。则
 和
和 反应生成
反应生成 和
和 的热化学方程式为
的热化学方程式为(2)碘循环法的循环过程如图所示,反应①的化学方程式为

(3)钠碱循环法:用
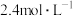 的
的 溶液吸收尾气中的
溶液吸收尾气中的 。
。①上述
 溶液中:
溶液中: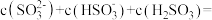
 ;
;
②室温下,当溶液的pH约为6时,
 溶液吸收
溶液吸收 能力显著下降,此时溶液中
能力显著下降,此时溶液中 的浓度是
的浓度是 ,则此时溶液中各离子浓度由大到小的顺序为
,则此时溶液中各离子浓度由大到小的顺序为(4)氨石灰水法:
第一步:用过量的浓氨水吸收
 ,并在空气中氧化;
,并在空气中氧化;第二步:加入澄清石灰水。
已知:室温下,
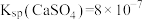 ,
,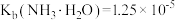 ,则室温下,第二步反应:
,则室温下,第二步反应: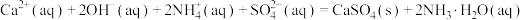 的平衡常数
的平衡常数
您最近一年使用:0次
2023-01-15更新
|
141次组卷
|
4卷引用:湖北省恩施土家族苗族自治州巴东县2022-2023学年高二下学期6月月考化学试题
解题方法
8 .  、
、 是大气污染物,
是大气污染物, 在空气中易转化成
在空气中易转化成 。化学方程式为
。化学方程式为

(I) 和
和 反应历程有两步,如图1所示。
反应历程有两步,如图1所示。
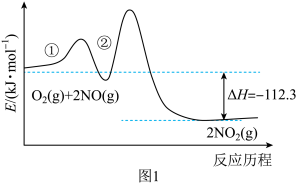
①

②

(1)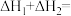
_______  。
。
(2)化学反应速率较大的基元反应是_______ (填“①”或“②”)。
(3)在密闭容器中投入 和
和 发生上述反应,达到平衡后,仅改变下列一个条件,
发生上述反应,达到平衡后,仅改变下列一个条件, 的平衡转化率和反应速率都增大的是_______(填字母)。
的平衡转化率和反应速率都增大的是_______(填字母)。
(II)在体积相同的甲、乙密闭容器中都充入 和
和 ,分别在“恒温恒容”和“绝热恒容”条件下发生上述反应,测得混合气体总压强与时间变化关系如图2所示。
,分别在“恒温恒容”和“绝热恒容”条件下发生上述反应,测得混合气体总压强与时间变化关系如图2所示。
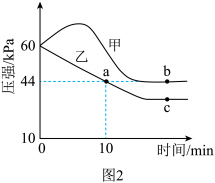
(4)在绝热恒容条件下达到平衡的容器是_______ (填“甲”或“乙”)。
(5)下列情况表明达到c点的反应状态的是_______。
(6)比较反应速率:b_______ c(填“>”“<”或“=”,下同)。比较 :a
:a_______ b。a点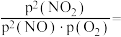
_______  。
。
(7)乙容器中,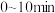 内
内 平均分压变化率为
平均分压变化率为_______ 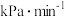 。
。
 、
、 是大气污染物,
是大气污染物, 在空气中易转化成
在空气中易转化成 。化学方程式为
。化学方程式为

(I)
 和
和 反应历程有两步,如图1所示。
反应历程有两步,如图1所示。
①


②


(1)
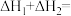
 。
。(2)化学反应速率较大的基元反应是
(3)在密闭容器中投入
 和
和 发生上述反应,达到平衡后,仅改变下列一个条件,
发生上述反应,达到平衡后,仅改变下列一个条件, 的平衡转化率和反应速率都增大的是_______(填字母)。
的平衡转化率和反应速率都增大的是_______(填字母)。| A.加入催化剂 | B.增大压强 | C.增大 浓度 浓度 | D.升高温度 |
(II)在体积相同的甲、乙密闭容器中都充入
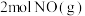 和
和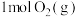 ,分别在“恒温恒容”和“绝热恒容”条件下发生上述反应,测得混合气体总压强与时间变化关系如图2所示。
,分别在“恒温恒容”和“绝热恒容”条件下发生上述反应,测得混合气体总压强与时间变化关系如图2所示。
(4)在绝热恒容条件下达到平衡的容器是
(5)下列情况表明达到c点的反应状态的是_______。
| A.混合气体密度不再变化 | B.气体总压强不再变化 |
| C.气体平均摩尔质量不再变化 | D. 消耗速率等于 消耗速率等于 生成速率 生成速率 |
 :a
:a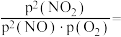
 。
。(7)乙容器中,
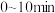 内
内 平均分压变化率为
平均分压变化率为 。
。
您最近一年使用:0次
解题方法
9 . 我国政府承诺要在2030年前实现碳达峰, 相关转化的研究对解决环境、能源问题意义重大。回答下列问题:
相关转化的研究对解决环境、能源问题意义重大。回答下列问题:
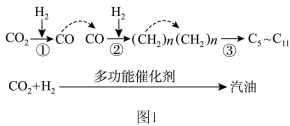
(1) 催化加氢制取汽油时,
催化加氢制取汽油时, 的转化过程如图1:
的转化过程如图1:
下列对该反应过程的说法正确的是_______ (填标号)。
A.整个反应过程中,有非极性键和极性键的断裂和形成
B. 中C原子的杂化类型为sp
中C原子的杂化类型为sp
C.汽油为纯净物
(2)已知 甲烷化技术的反应原理为
甲烷化技术的反应原理为
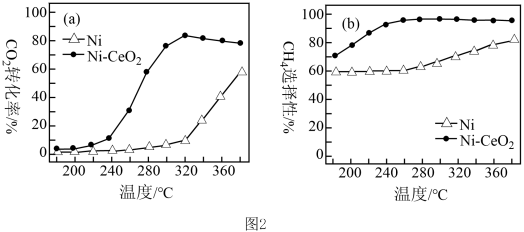
 ,该技术的核心是催化剂的选择。其他条件均相同,在两种不同催化剂条件下反应相同时间,测得
,该技术的核心是催化剂的选择。其他条件均相同,在两种不同催化剂条件下反应相同时间,测得 转化率和
转化率和 选择性随温度变化的曲线如图2所示。
选择性随温度变化的曲线如图2所示。
①四羰基镍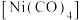 是镍的一种配合物,该配合物中中心原子的配位数为
是镍的一种配合物,该配合物中中心原子的配位数为_______ 。
②以Ni为催化剂,高于320℃后,单位时间内 转化率上升的原因是
转化率上升的原因是_______ ;工业上应选择的催化剂是_______ 。
(3)以 、
、 为原料合成
为原料合成 涉及的主要反应如下:
涉及的主要反应如下:
Ⅰ.

Ⅱ.

①反应

_______ 。(用含 和
和 的代数式表示)
的代数式表示)
②反应Ⅰ、Ⅱ的 (K代表化学平衡常数)随
(K代表化学平衡常数)随 (温度的倒数)的变化如图3所示。据图判断,升高温度时,体系中
(温度的倒数)的变化如图3所示。据图判断,升高温度时,体系中 的含量将
的含量将_______ (填“增大”、“减小”或“不变”,下同),CO的含量将_______ 。
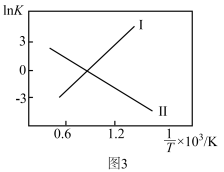
③某温度下往恒容密闭容器中充入1 mol 和3 mol
和3 mol  ,恒温条件下仅发生反应Ⅰ,平衡时混合气体的总压(此时总压为p)为起始总压的
,恒温条件下仅发生反应Ⅰ,平衡时混合气体的总压(此时总压为p)为起始总压的 ,该反应的压强平衡常数
,该反应的压强平衡常数
_______ (用平衡分压代替平衡浓度,分压=总压 物质的量分数)。
物质的量分数)。
 相关转化的研究对解决环境、能源问题意义重大。回答下列问题:
相关转化的研究对解决环境、能源问题意义重大。回答下列问题:(1)
 催化加氢制取汽油时,
催化加氢制取汽油时, 的转化过程如图1:
的转化过程如图1:
下列对该反应过程的说法正确的是
A.整个反应过程中,有非极性键和极性键的断裂和形成
B.
 中C原子的杂化类型为sp
中C原子的杂化类型为spC.汽油为纯净物
(2)已知
 甲烷化技术的反应原理为
甲烷化技术的反应原理为
 ,该技术的核心是催化剂的选择。其他条件均相同,在两种不同催化剂条件下反应相同时间,测得
,该技术的核心是催化剂的选择。其他条件均相同,在两种不同催化剂条件下反应相同时间,测得 转化率和
转化率和 选择性随温度变化的曲线如图2所示。
选择性随温度变化的曲线如图2所示。
①四羰基镍
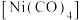 是镍的一种配合物,该配合物中中心原子的配位数为
是镍的一种配合物,该配合物中中心原子的配位数为②以Ni为催化剂,高于320℃后,单位时间内
 转化率上升的原因是
转化率上升的原因是(3)以
 、
、 为原料合成
为原料合成 涉及的主要反应如下:
涉及的主要反应如下:Ⅰ.


Ⅱ.


①反应


 和
和 的代数式表示)
的代数式表示)②反应Ⅰ、Ⅱ的
 (K代表化学平衡常数)随
(K代表化学平衡常数)随 (温度的倒数)的变化如图3所示。据图判断,升高温度时,体系中
(温度的倒数)的变化如图3所示。据图判断,升高温度时,体系中 的含量将
的含量将
③某温度下往恒容密闭容器中充入1 mol
 和3 mol
和3 mol  ,恒温条件下仅发生反应Ⅰ,平衡时混合气体的总压(此时总压为p)为起始总压的
,恒温条件下仅发生反应Ⅰ,平衡时混合气体的总压(此时总压为p)为起始总压的 ,该反应的压强平衡常数
,该反应的压强平衡常数
 物质的量分数)。
物质的量分数)。
您最近一年使用:0次
2023-01-02更新
|
368次组卷
|
3卷引用:湖北省十堰市2023届高三元月调研考试化学试题
10 . 我国在南海北部神狐海域进行的可燃冰(甲烷的水合物)试采获得成功。甲烷是一种重要的化工原料。甲烷重整是提高甲烷利用率的重要方式。
回答下列问题:
(1)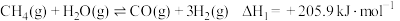 ①
①
 ②
②
写出 与
与 反应生成CO和
反应生成CO和 的热化学方程式:
的热化学方程式:_______ 。
(2)高温下,在1L密闭容器中通入1mol甲烷,发生如下反应: 。反应在初期阶段的速率方程为
。反应在初期阶段的速率方程为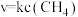 ,其中
,其中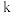 为反应速率常数。
为反应速率常数。
①设反应开始时的反应速率为 ,甲烷的转化率为
,甲烷的转化率为 时的反应速率为
时的反应速率为 ,则
,则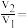
_______ 。
②对于处于初期阶段的该反应,下列说法正确的是_______ (填字母)。
A.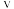 与甲烷浓度成正比
与甲烷浓度成正比
B.压强不变时,反应到达平衡状态
C.乙烷的生成速率逐渐增大
D.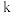 与温度无关
与温度无关
③平衡时,再通入1 mol甲烷,则反应的平衡常数K_______ (填“增大”“减小”或“不变”,下同),甲烷的转化率
_______ 。
(3) 和
和 都是比较稳定的分子,科学家利用电化学装置实现两种分子的耦合转化,其原理如图所示:
都是比较稳定的分子,科学家利用电化学装置实现两种分子的耦合转化,其原理如图所示:
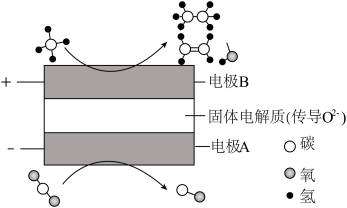
当在某电极上生成的两种有机物物质的量之比为1:1时,该电极上的电极反应式为_______ 。 和
和 的物质的量比为
的物质的量比为_______ 。
(4)我国科学家对甲烷和水蒸气催化重整反应机理也进行了广泛研究,通常认为该反应分两步进行。第一步: 催化裂解生成
催化裂解生成 和碳(或碳氢物种),其中碳(或碳氢物种)吸附在催化剂上,如
和碳(或碳氢物种),其中碳(或碳氢物种)吸附在催化剂上,如 ;第二步:碳(或碳氢物种)和
;第二步:碳(或碳氢物种)和 反应生成
反应生成 和
和 ,如
,如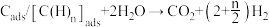 ,反应过程和能量变化残图如下:
,反应过程和能量变化残图如下:
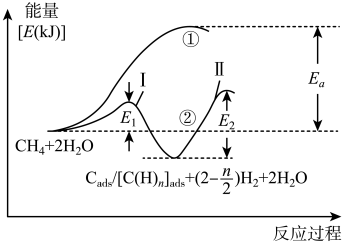
判断_______ (填序号)过程加入催化剂,原因是_______ 。控制整个过程②反应速率的是第Ⅱ步,其原因为_______ 。
回答下列问题:
(1)
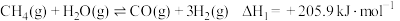 ①
① ②
②写出
 与
与 反应生成CO和
反应生成CO和 的热化学方程式:
的热化学方程式:(2)高温下,在1L密闭容器中通入1mol甲烷,发生如下反应:
 。反应在初期阶段的速率方程为
。反应在初期阶段的速率方程为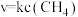 ,其中
,其中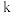 为反应速率常数。
为反应速率常数。①设反应开始时的反应速率为
 ,甲烷的转化率为
,甲烷的转化率为 时的反应速率为
时的反应速率为 ,则
,则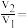
②对于处于初期阶段的该反应,下列说法正确的是
A.
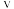 与甲烷浓度成正比
与甲烷浓度成正比B.压强不变时,反应到达平衡状态
C.乙烷的生成速率逐渐增大
D.
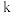 与温度无关
与温度无关③平衡时,再通入1 mol甲烷,则反应的平衡常数K

(3)
 和
和 都是比较稳定的分子,科学家利用电化学装置实现两种分子的耦合转化,其原理如图所示:
都是比较稳定的分子,科学家利用电化学装置实现两种分子的耦合转化,其原理如图所示:
当在某电极上生成的两种有机物物质的量之比为1:1时,该电极上的电极反应式为
 和
和 的物质的量比为
的物质的量比为(4)我国科学家对甲烷和水蒸气催化重整反应机理也进行了广泛研究,通常认为该反应分两步进行。第一步:
 催化裂解生成
催化裂解生成 和碳(或碳氢物种),其中碳(或碳氢物种)吸附在催化剂上,如
和碳(或碳氢物种),其中碳(或碳氢物种)吸附在催化剂上,如 ;第二步:碳(或碳氢物种)和
;第二步:碳(或碳氢物种)和 反应生成
反应生成 和
和 ,如
,如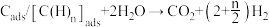 ,反应过程和能量变化残图如下:
,反应过程和能量变化残图如下:
判断
您最近一年使用:0次
2022-12-20更新
|
366次组卷
|
2卷引用:湖北省蕲春县实验高级中学2022届高三第一次模拟训练化学试题



