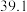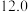名校
1 . 近年来我国大力加强温室气体 催化氢化合成甲醇技术的工业化量产研究,实现可持续发展。回答下列问题:
催化氢化合成甲醇技术的工业化量产研究,实现可持续发展。回答下列问题:
(1)已知:

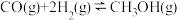
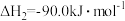
写出 催化氢化合成甲醇的热化学方程式
催化氢化合成甲醇的热化学方程式_____ 。
(2)为提高 的产率,理论上应采用的条件是
的产率,理论上应采用的条件是______ (填序号)。
a.高温高压 b.低温低压 c.高温低压 d.低温高压
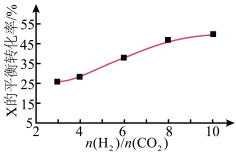
(3)250℃时,在恒容密闭容器中由 催化氢化合成
催化氢化合成 ,如图为不同投料比
,如图为不同投料比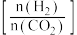 时某反应物X的平衡转化率的变化曲线。
时某反应物X的平衡转化率的变化曲线。
反应物X是___ (填“ ”或“
”或“ ”)。
”)。
(4)250℃时,在体积为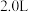 的恒容密闭容器中加入
的恒容密闭容器中加入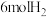 、
、 和催化剂,10min时反应达到平衡,测得
和催化剂,10min时反应达到平衡,测得 。
。
①前10min内 的平均反应速率
的平均反应速率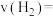
____  。
。
②化学平衡常数
________ 。
③催化剂和反应条件与反应物的转化率和产物的选择性高度相关。控制相同投料比和相同反应时间,得到如下四组实验数据:
根据上表所给数据,用 生产甲醇的最优条件为
生产甲醇的最优条件为___ (填实验编号)。
 催化氢化合成甲醇技术的工业化量产研究,实现可持续发展。回答下列问题:
催化氢化合成甲醇技术的工业化量产研究,实现可持续发展。回答下列问题:(1)已知:


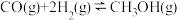
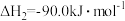
写出
 催化氢化合成甲醇的热化学方程式
催化氢化合成甲醇的热化学方程式(2)为提高
 的产率,理论上应采用的条件是
的产率,理论上应采用的条件是a.高温高压 b.低温低压 c.高温低压 d.低温高压
(3)250℃时,在恒容密闭容器中由
 催化氢化合成
催化氢化合成 ,如图为不同投料比
,如图为不同投料比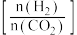 时某反应物X的平衡转化率的变化曲线。
时某反应物X的平衡转化率的变化曲线。
反应物X是
 ”或“
”或“ ”)。
”)。(4)250℃时,在体积为
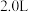 的恒容密闭容器中加入
的恒容密闭容器中加入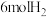 、
、 和催化剂,10min时反应达到平衡,测得
和催化剂,10min时反应达到平衡,测得 。
。①前10min内
 的平均反应速率
的平均反应速率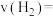
 。
。②化学平衡常数

③催化剂和反应条件与反应物的转化率和产物的选择性高度相关。控制相同投料比和相同反应时间,得到如下四组实验数据:
实验编号 | 温度/K | 催化剂 |
| 甲醇的选择性/% |
A | 543 |
|
|
|
B | 543 |
|
|
|
C | 553 |
|
|
|
D | 553 |
|
|
|
根据上表所给数据,用
 生产甲醇的最优条件为
生产甲醇的最优条件为
您最近一年使用:0次
2020-10-10更新
|
340次组卷
|
8卷引用:鲁科版(2019)高二选择性必修第一册第2章 化学反应的方向、限度与速率 第4节 化学反应条件的优化——工业合成氨 高效手册
鲁科版(2019)高二选择性必修第一册第2章 化学反应的方向、限度与速率 第4节 化学反应条件的优化——工业合成氨 高效手册人教版(2019)高二化学选择性必修1第二章 化学反应速率与化学平衡 第四节 化学反应的调控四川省成都新津为明学校2020-2021学年高二上学期期中测试化学试题甘肃省武威市民勤县第一中学2020-2021学年高二上学期12月月考化学试题(理科)湖北省沙市中学2022-2023学年高二上学期第二次月考化学试题广东省揭阳华侨高级中学2021-2022学年高二上学期期中考试化学试题广东省江门市新会区陈经纶中学2022-2023学年高二上学期第5段月考化学试题(已下线)化学反应速率与化学平衡——课时7化学反应的调控
解题方法
2 . 氮氧化物(NOx)是严重的大气污染物,能引起雾霾、光化学烟雾、酸雨等环境问题。回答下列问题:
(1)氧化还原法消除NOx的转化如下:
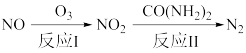
已知:NO(g)+O3(g)=NO2(g)+O2(g)△H=-201kJ·mol-1
2NO(g)+O2(g)=2NO2(g)△H=-116kJ·mol-1
反应I只有一种生成物,则反应I的热化学方程式为_______________ 。
(2)柴油机氮氧化物(NOx)处理技术是一种系统简单,占用空间较小的柴油车尾气处理技术,氮氧化物主要在催化转化装置中被处理。柴油发动机工作时在稀燃(O2充足、柴油较少)和富燃(O2不足、柴油较多)条件下交替进行,催化转化装置中的物质变化如图所示。
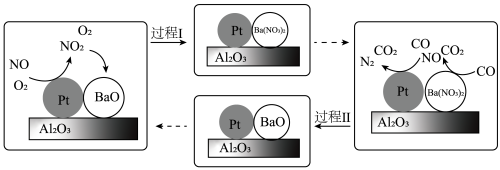
①BaO吸收NO2的化学方程式是______________ 。
②研究CO2对BaO吸收氮氧化物的影响,一定温度下,测得气体中CO2的体积分数与氮氧化物吸收率的关系如图所示。

下列相关分析中正确的是_______________ 。
A.一定范围内,氮氧化物吸收率随CO2体积分数的增大而下降,原因可能是BaO与CO2反应生成BaCO3,覆盖在BaO表面
B.当CO2体积分数达到10%~20%时,氮氧化物吸收率依然较高,其原因可能是BaCO3在一定程度上也能吸收NOx
C.若柴油中硫含量较高,在稀燃过程中,柴油中的硫氧化为SO2,2BaO+2SO2+O2=2BaSO4,BaO吸收氮氧化物的能力会下降至较低水平
D.以上分析均不对
(3)用食盐水作电解液电解烟气脱氮的原理如图所示,NO被阳极产生的氧化性物质氧化为 ,尾气经氢氧化钠溶液吸收后排入空气。电流密度和溶液pH对烟气脱氮的影响如图所示。
,尾气经氢氧化钠溶液吸收后排入空气。电流密度和溶液pH对烟气脱氮的影响如图所示。
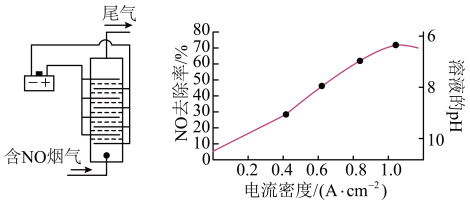
①NO被阳极产生的氧化性物质氧化为 反应的离子方程式为
反应的离子方程式为_______________ 。
②溶液的pH对NO去除率影响的原因是_______________ 。
(1)氧化还原法消除NOx的转化如下:
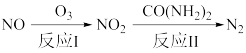
已知:NO(g)+O3(g)=NO2(g)+O2(g)△H=-201kJ·mol-1
2NO(g)+O2(g)=2NO2(g)△H=-116kJ·mol-1
反应I只有一种生成物,则反应I的热化学方程式为
(2)柴油机氮氧化物(NOx)处理技术是一种系统简单,占用空间较小的柴油车尾气处理技术,氮氧化物主要在催化转化装置中被处理。柴油发动机工作时在稀燃(O2充足、柴油较少)和富燃(O2不足、柴油较多)条件下交替进行,催化转化装置中的物质变化如图所示。

①BaO吸收NO2的化学方程式是
②研究CO2对BaO吸收氮氧化物的影响,一定温度下,测得气体中CO2的体积分数与氮氧化物吸收率的关系如图所示。

下列相关分析中正确的是
A.一定范围内,氮氧化物吸收率随CO2体积分数的增大而下降,原因可能是BaO与CO2反应生成BaCO3,覆盖在BaO表面
B.当CO2体积分数达到10%~20%时,氮氧化物吸收率依然较高,其原因可能是BaCO3在一定程度上也能吸收NOx
C.若柴油中硫含量较高,在稀燃过程中,柴油中的硫氧化为SO2,2BaO+2SO2+O2=2BaSO4,BaO吸收氮氧化物的能力会下降至较低水平
D.以上分析均不对
(3)用食盐水作电解液电解烟气脱氮的原理如图所示,NO被阳极产生的氧化性物质氧化为
 ,尾气经氢氧化钠溶液吸收后排入空气。电流密度和溶液pH对烟气脱氮的影响如图所示。
,尾气经氢氧化钠溶液吸收后排入空气。电流密度和溶液pH对烟气脱氮的影响如图所示。
①NO被阳极产生的氧化性物质氧化为
 反应的离子方程式为
反应的离子方程式为②溶液的pH对NO去除率影响的原因是
您最近一年使用:0次
2020-09-25更新
|
442次组卷
|
2卷引用:湖北省黄冈市2021届高三9月质量检测化学试题
3 . 碳的化合物在生产、生活中有着重要的作用。
(1)已知:2CO(g)+O2(g) 2CO2(g)△H1=-566kJ·molˉ1
2CO2(g)△H1=-566kJ·molˉ1
H2O(g)+CO(g) H2(g)+CO2(g)△H2=-41kJ·molˉ1
H2(g)+CO2(g)△H2=-41kJ·molˉ1
CO(g)+2H2(g) CH3OH(g)△H3=-107kJ.molˉ1
CH3OH(g)△H3=-107kJ.molˉ1
则2CH3OH(g)+3O2(g) 2CO2(g)+4H2O(g)△H=
2CO2(g)+4H2O(g)△H=___ kJ·molˉ1
(2)T℃时,向容积为2L的恒容密闭容器中通入4.0molCO2和6.8molH2,发生反应:CO2(g)+3H2(g) CH3OH(g)+H2O(g)△H=-50kJ·molˉ1。5分钟时反应达到平衡,CO2的转化率为50%,回答下列问题:
CH3OH(g)+H2O(g)△H=-50kJ·molˉ1。5分钟时反应达到平衡,CO2的转化率为50%,回答下列问题:
①在0~5min内容器中v(CH3OH)=___ ;
②反应过程中,下列各项指标能表明A容器中反应的v正>v逆的是___ (填标号)
a.体系内的压强增大
b.气体的平均相对分子质量增大
c.H2O(g)的物质的量增加
d.v正(CO2)=v逆(H2)
(3)T℃时,通入2.0molCO和6.0molH2于恒压密闭容器中,起始容积为2L,发生反应:CO(g)+2H2(g) CH3OH(g)。5分钟时反应达到平衡,CO的转化率为50%,回答下列问题:
CH3OH(g)。5分钟时反应达到平衡,CO的转化率为50%,回答下列问题:
①该温度下上述反应的平衡常数K=___ (保留两位有效数字);
②若达平衡后,再将CO、H2、CH3OH各充入1.0mol,平衡向___ (填“正反应方向”、“逆反应方向”或“不”)移动。
(1)已知:2CO(g)+O2(g)
 2CO2(g)△H1=-566kJ·molˉ1
2CO2(g)△H1=-566kJ·molˉ1H2O(g)+CO(g)
 H2(g)+CO2(g)△H2=-41kJ·molˉ1
H2(g)+CO2(g)△H2=-41kJ·molˉ1CO(g)+2H2(g)
 CH3OH(g)△H3=-107kJ.molˉ1
CH3OH(g)△H3=-107kJ.molˉ1则2CH3OH(g)+3O2(g)
 2CO2(g)+4H2O(g)△H=
2CO2(g)+4H2O(g)△H=(2)T℃时,向容积为2L的恒容密闭容器中通入4.0molCO2和6.8molH2,发生反应:CO2(g)+3H2(g)
 CH3OH(g)+H2O(g)△H=-50kJ·molˉ1。5分钟时反应达到平衡,CO2的转化率为50%,回答下列问题:
CH3OH(g)+H2O(g)△H=-50kJ·molˉ1。5分钟时反应达到平衡,CO2的转化率为50%,回答下列问题:①在0~5min内容器中v(CH3OH)=
②反应过程中,下列各项指标能表明A容器中反应的v正>v逆的是
a.体系内的压强增大
b.气体的平均相对分子质量增大
c.H2O(g)的物质的量增加
d.v正(CO2)=v逆(H2)
(3)T℃时,通入2.0molCO和6.0molH2于恒压密闭容器中,起始容积为2L,发生反应:CO(g)+2H2(g)
 CH3OH(g)。5分钟时反应达到平衡,CO的转化率为50%,回答下列问题:
CH3OH(g)。5分钟时反应达到平衡,CO的转化率为50%,回答下列问题:①该温度下上述反应的平衡常数K=
②若达平衡后,再将CO、H2、CH3OH各充入1.0mol,平衡向
您最近一年使用:0次
2020-09-24更新
|
342次组卷
|
3卷引用:湖北省部分重点中学(郧阳中学、恩施高中、随州二中、沙市中学)2020-2021学年高二上学期联考化学试题
解题方法
4 . 0世纪30年代,Eyring和Pelzer在碰撞理论的基础上提出化学反应的过渡态理论:化学反应并不是通过简单的碰撞就能完成的,而是在反应物到生成物的过程中经过一个高能量过渡态。分析图中信息,回答下列问题:
(1)①如图是NO2和CO反应生成CO2和NO过程中能量变化示意图,请写出NO2和CO反应的热化学方程式:________________________________________________________________________________________ 。②若在反应体系中加入催化剂,E1、E2的变化分别是:E1_________ 、E2________ (填“增大”、“减小”或“不变”)。

(2)下图是红磷P(s)和Cl2(g)发生反应生成PCl3(g)和PCl5(g)的反应过程与能量关系图(图中的△H表示生成1mol产物的数据)。根据图回答下列问题:

①PCl3(g)分解生成P(s)和Cl2(g)的热化学方程式____________________________________________________________________ 。
②P(s)和Cl2(g)分两步反应生成1molPCl5(g)的反应热△H3与P(s)和Cl2(g)仅一步反应生成1molPCl5(g)的反应热△H4关系是:△H3______ △H4(填“>”、“<”或“=”),原因是_________________________ 。
(1)①如图是NO2和CO反应生成CO2和NO过程中能量变化示意图,请写出NO2和CO反应的热化学方程式:

(2)下图是红磷P(s)和Cl2(g)发生反应生成PCl3(g)和PCl5(g)的反应过程与能量关系图(图中的△H表示生成1mol产物的数据)。根据图回答下列问题:

①PCl3(g)分解生成P(s)和Cl2(g)的热化学方程式
②P(s)和Cl2(g)分两步反应生成1molPCl5(g)的反应热△H3与P(s)和Cl2(g)仅一步反应生成1molPCl5(g)的反应热△H4关系是:△H3
您最近一年使用:0次
2020-09-15更新
|
155次组卷
|
3卷引用:湖北省新高考联考协作体2020-2021学年高二上学期开学联考化学试题
名校
解题方法
5 . 甲醇既是重要的化工原料,可用于制备甲醛、醋酸等产品,又可作为清洁燃料。利用CO2与H2合成甲醇涉及的主要反应如下:
Ⅰ.CO2(g)+3H2(g)⇌CH3OH(g)+H2O(g) △H1
Ⅱ.CO2(g)+H2(g)⇌CO(g)+H2O(g) △H2=41kJ•mol−1
回答下列问题:
(1)已知CO(g)+2H2(g)⇌CH3OH(g) △H3 = −99 kJ•mol−1,则△H1=______ kJ•mol−1
(2)向刚性容器中充入一定量的CO2和H2,在不同催化剂(Cat.1,Cat.2)下反应相同时间,CO2的转化率和甲醇的选择性[甲醇的选择性= ×100%]随温度的变化如图所示:
×100%]随温度的变化如图所示:
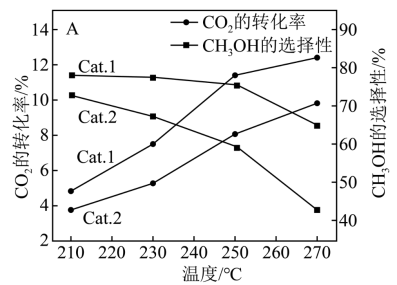
①由上图可知,催化效果Cat.1____ Cat.2(填“>”“<”或“=”)。
②在210~270℃间,CH3OH的选择性随温度的升高而下降,请写出一条可能原因_____________ 。
(3)一定条件下,向刚性容器中充入物质的量之比为1:3的CO2和H2发生上述反应。
①有利于提高甲醇平衡产率的条件是________ (填标号)。
A.高温高压 B.低温高压 C.高温低压 D.低温低压
②达到平衡时CO2的转化率为20%,CH3OH的选择性为75%,则 (H2)=
(H2)=________ ;反应Ⅱ的压强平衡常数Kp=________________ 。
Ⅰ.CO2(g)+3H2(g)⇌CH3OH(g)+H2O(g) △H1
Ⅱ.CO2(g)+H2(g)⇌CO(g)+H2O(g) △H2=41kJ•mol−1
回答下列问题:
(1)已知CO(g)+2H2(g)⇌CH3OH(g) △H3 = −99 kJ•mol−1,则△H1=
(2)向刚性容器中充入一定量的CO2和H2,在不同催化剂(Cat.1,Cat.2)下反应相同时间,CO2的转化率和甲醇的选择性[甲醇的选择性=
 ×100%]随温度的变化如图所示:
×100%]随温度的变化如图所示:
①由上图可知,催化效果Cat.1
②在210~270℃间,CH3OH的选择性随温度的升高而下降,请写出一条可能原因
(3)一定条件下,向刚性容器中充入物质的量之比为1:3的CO2和H2发生上述反应。
①有利于提高甲醇平衡产率的条件是
A.高温高压 B.低温高压 C.高温低压 D.低温低压
②达到平衡时CO2的转化率为20%,CH3OH的选择性为75%,则
 (H2)=
(H2)=
您最近一年使用:0次
2020-09-11更新
|
289次组卷
|
6卷引用:湖北省武汉市部分学校2021届高三起点质量检测化学试题
湖北省武汉市部分学校2021届高三起点质量检测化学试题湖北省公安县第三中学2020-2021学年高三上学期11月月考化学试题湖南省长沙市炎德英才2020-2021高二上学期第三次月考联考化学试题(已下线)2020年天津卷化学高考真题变式题13-16(已下线)专题2.2.3 影响化学平衡的因素(备作业)-【上好课】2021-2022学年高二化学同步备课系列(人教版2019选择性必修1)广东省广州市玉岩中学2022-2023学年高二上学期10月月考化学试题
名校
解题方法
6 . (1)已知葡萄糖(C6H12O6)的燃烧热是2804 kJ/mol,写出葡萄糖的燃烧热的热化学方程式:____________ ,当它在人体内氧化生成1 g水时放出的热量约为____________ 。
(2)已知:HCN(aq)与 NaOH(aq)反应生成1mol液态水的△H =-12. 1 kJ/mol, HCl(aq) 与NaOH(aq)反应生成l mol液态水的△H = -55.6 kJ/mol,则HCN在水溶液中电离的热化学方程式为:_____________ 。
(3) 2 L 0.5 mol/LH2SO4溶液与足量Ba(OH)2稀溶液反应放出a kJ热量,2 L 0.5 mol/L HCl溶液与足量NaOH稀溶液充分反应放出b kJ热量,则500 mL0.4 mol/LBaCl2溶液与足量稀硫酸反应放出的热量为_________ 。
(4) 2015年冬季,雾霾天气严重影响了我国北方地区。国内电力行业和供暖部门引进先进脱硫工艺以减少污染。目前脱硫工艺涉及的主要反应有:①H2S(g)+ O2(g)=SO2(g)+H2O(g) △H1
O2(g)=SO2(g)+H2O(g) △H1
②S(g)+ O2(g)=SO2(g) △H2
③S(g)+ H2(g)=H2S(g) △H3
则“2H2(g)+O2(g)=2H2O(g) △H4”中△H4=_______________ 。
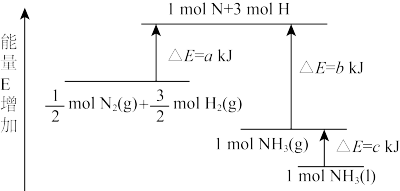
(5) N2和H2合成NH3的能量变化如图所示,写出生成液氨的热化学方程式是____________ 。
(2)已知:HCN(aq)与 NaOH(aq)反应生成1mol液态水的△H =-12. 1 kJ/mol, HCl(aq) 与NaOH(aq)反应生成l mol液态水的△H = -55.6 kJ/mol,则HCN在水溶液中电离的热化学方程式为:
(3) 2 L 0.5 mol/LH2SO4溶液与足量Ba(OH)2稀溶液反应放出a kJ热量,2 L 0.5 mol/L HCl溶液与足量NaOH稀溶液充分反应放出b kJ热量,则500 mL0.4 mol/LBaCl2溶液与足量稀硫酸反应放出的热量为
(4) 2015年冬季,雾霾天气严重影响了我国北方地区。国内电力行业和供暖部门引进先进脱硫工艺以减少污染。目前脱硫工艺涉及的主要反应有:①H2S(g)+
 O2(g)=SO2(g)+H2O(g) △H1
O2(g)=SO2(g)+H2O(g) △H1②S(g)+ O2(g)=SO2(g) △H2
③S(g)+ H2(g)=H2S(g) △H3
则“2H2(g)+O2(g)=2H2O(g) △H4”中△H4=
(5) N2和H2合成NH3的能量变化如图所示,写出生成液氨的热化学方程式是

您最近一年使用:0次
2020-08-30更新
|
117次组卷
|
3卷引用:湖北省武汉市第三中学2019-2020学年高一下学期期中考试化学试题
湖北省武汉市第三中学2019-2020学年高一下学期期中考试化学试题河南省驻马店市正阳县高级中学2020-2021学年高二上学期第一次月考化学试题(已下线)专题1 综合评价(1)-【上好课】2021-2022学年高二化学同步备课系列(苏教版2019选择性必修1)
7 . 如图所示的氮循环是生态系统物质循环的重要组成部分,人类活动加剧了氮循环中的物质转化。
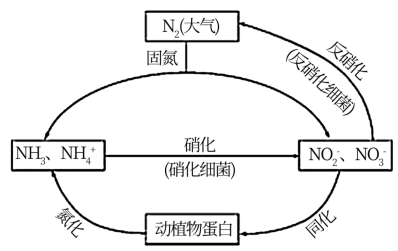
(1)结合上图判断下列说法正确的是____________ (填字母序号)。
A 固氮过程中,N2只作氧化剂
B 在硝化细菌作用下发生的硝化过程需要有氧化剂参与
C 反硝化过程有助于弥补人工固氮对氮循环造成的影响
D 同化、氨化过程中,氮元素均从无机物转移至有机物
(2)硝化过程中,NH3转化成HNO2的化学方程式为____________ 。
(3)反硝化过程中,CH3OH可作为反应的还原剂,请将该反应的离子方程式补充完整:
5CH3OH+6NO

____ N2↑+4HCO +
+_____ +______ 。
(4)利用下表数据进行估算,写出工业合成氨反应的热化学方程式:____________
(5)已知,氨气易液化,可做制冷剂,试比较NH3的沸点______ (选填“高于”或“低于”)PH3,原因是_______________________ 。
(6)已知:①4NH3(g)+5O2(g)=4NO(g)+6H2O(g) △H1= -a kJ/mol
②4NH3(g)+3O2(g)=2N2(g)+6H2O(g) △H2= -bkJ/mol;
③H2(g)+ O2(g)=H2O(g) △H3= -c kJ/mol
O2(g)=H2O(g) △H3= -c kJ/mol
④H2(g)+ O2(g)=H2O(l) △H4= -d kJ/mol
O2(g)=H2O(l) △H4= -d kJ/mol
有关下列叙述不正确的是_____________ 。
a.由上述热化学方程式可知△H3<△H4
b.H2的燃烧热为d kJ/mol
c.4NH3(g)+4O2(g)=2NO(g)+N2(g)+6H2O(g) △H=(-a-b) kJ/mol
d.4NH3(g) 2N2(g)+6H2(g) △H =(6d-b)kJ/mol
2N2(g)+6H2(g) △H =(6d-b)kJ/mol

(1)结合上图判断下列说法正确的是
A 固氮过程中,N2只作氧化剂
B 在硝化细菌作用下发生的硝化过程需要有氧化剂参与
C 反硝化过程有助于弥补人工固氮对氮循环造成的影响
D 同化、氨化过程中,氮元素均从无机物转移至有机物
(2)硝化过程中,NH3转化成HNO2的化学方程式为
(3)反硝化过程中,CH3OH可作为反应的还原剂,请将该反应的离子方程式补充完整:
5CH3OH+6NO


 +
+(4)利用下表数据进行估算,写出工业合成氨反应的热化学方程式:
| 共价键 | N≡N | H-H | N-H |
| 断开1 mol共价键所需能量(kJ) | 946 | 436 | 391 |
(6)已知:①4NH3(g)+5O2(g)=4NO(g)+6H2O(g) △H1= -a kJ/mol
②4NH3(g)+3O2(g)=2N2(g)+6H2O(g) △H2= -bkJ/mol;
③H2(g)+
 O2(g)=H2O(g) △H3= -c kJ/mol
O2(g)=H2O(g) △H3= -c kJ/mol④H2(g)+
 O2(g)=H2O(l) △H4= -d kJ/mol
O2(g)=H2O(l) △H4= -d kJ/mol有关下列叙述不正确的是
a.由上述热化学方程式可知△H3<△H4
b.H2的燃烧热为d kJ/mol
c.4NH3(g)+4O2(g)=2NO(g)+N2(g)+6H2O(g) △H=(-a-b) kJ/mol
d.4NH3(g)
 2N2(g)+6H2(g) △H =(6d-b)kJ/mol
2N2(g)+6H2(g) △H =(6d-b)kJ/mol
您最近一年使用:0次
8 . 氧化亚氮(N2O)是一种强温室气体,且易转换成颗粒污染物。研究氧化亚氮分解对环境保护有重要意义。
(1)污水生物脱氮过程中,在微生物催化下,硝酸铵可分解为N2O和另一种产物,该反应的化学方程式为___________ 。
(2)已知反应 2N2O(g) 2N2(g)+O2(g) ΔH=-163 kJ·mol -1 ,1 mol N2(g)、1 mol O2(g)分子中化学键断裂时分别需要吸收 945 kJ、498 kJ 的能量,则 1 mol N2O(g)分子中化学键断裂时需要吸收的能量为
2N2(g)+O2(g) ΔH=-163 kJ·mol -1 ,1 mol N2(g)、1 mol O2(g)分子中化学键断裂时分别需要吸收 945 kJ、498 kJ 的能量,则 1 mol N2O(g)分子中化学键断裂时需要吸收的能量为_____ kJ。
(3)在一定温度下的恒容容器中,反应2N2O(g) 2N2(g)+O2(g)的部分实验数据如下:
2N2(g)+O2(g)的部分实验数据如下:
①在0~20min 时段,反应速率 v(O2)为_____ mol·L -1 ·min -1。
②若N2O起始浓度c0为 0.150 mol·L -1 ,则反应至30 min时N2O的转化率α=______ 。比较不同起始浓度时N2O的分解速率:v(c0 =0.150 mol·L -1 )______ v(c0=0.100 mol·L -1)(填“>”“=”或“<”)。
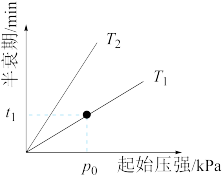
③不同温度(T)下,N2O分解半衰期随起始压强的变化关系如图所示(图中半衰期指任一浓度N2O消耗一半时所需的相应时间),则 T2_______ T1(填“>”“=”或“<”)。当温度为 T 1 、起始压强为p0,反应至 t 1 min 时,体系压强 p=______ (用p0表示)。
(4)碘蒸气的存在能大幅度提高N2O的分解速率,反应历程为:
第一步 I2(g) 2I(g) (快反应)
2I(g) (快反应)
第二步 I(g)+N2O(g) N2(g)+IO(g) (慢反应)
N2(g)+IO(g) (慢反应)
第三步 IO(g)+N2O(g) N2(g)+O2(g)+I(g) (快反应)
N2(g)+O2(g)+I(g) (快反应)
实验表明,含碘时N2O分解速率方程 v=k·c(N2O)·[c(I2)]0.5(k 为速率常数)。下列表述正确的是__________ (填标号)。
a.N2O分解反应中,k(含碘)<k(无碘)
b.第一步对总反应速率起决定作用
c.第二步活化能比第三步大
d.I2浓度与 N2O分解速率无关
(1)污水生物脱氮过程中,在微生物催化下,硝酸铵可分解为N2O和另一种产物,该反应的化学方程式为
(2)已知反应 2N2O(g)
 2N2(g)+O2(g) ΔH=-163 kJ·mol -1 ,1 mol N2(g)、1 mol O2(g)分子中化学键断裂时分别需要吸收 945 kJ、498 kJ 的能量,则 1 mol N2O(g)分子中化学键断裂时需要吸收的能量为
2N2(g)+O2(g) ΔH=-163 kJ·mol -1 ,1 mol N2(g)、1 mol O2(g)分子中化学键断裂时分别需要吸收 945 kJ、498 kJ 的能量,则 1 mol N2O(g)分子中化学键断裂时需要吸收的能量为(3)在一定温度下的恒容容器中,反应2N2O(g)
 2N2(g)+O2(g)的部分实验数据如下:
2N2(g)+O2(g)的部分实验数据如下:| 反应时间/min | 0 | 10 | 20 | 30 | 40 | 50 | 60 | 70 | 80 | 90 | 100 |
| c(N2O)/mol/L | 0.100 | 0.090 | 0.080 | 0.070 | 0.060 | 0.050 | 0.040 | 0.030 | 0.020 | 0.010 | 0.010 |
②若N2O起始浓度c0为 0.150 mol·L -1 ,则反应至30 min时N2O的转化率α=
③不同温度(T)下,N2O分解半衰期随起始压强的变化关系如图所示(图中半衰期指任一浓度N2O消耗一半时所需的相应时间),则 T2

(4)碘蒸气的存在能大幅度提高N2O的分解速率,反应历程为:
第一步 I2(g)
 2I(g) (快反应)
2I(g) (快反应)第二步 I(g)+N2O(g)
 N2(g)+IO(g) (慢反应)
N2(g)+IO(g) (慢反应)第三步 IO(g)+N2O(g)
 N2(g)+O2(g)+I(g) (快反应)
N2(g)+O2(g)+I(g) (快反应)实验表明,含碘时N2O分解速率方程 v=k·c(N2O)·[c(I2)]0.5(k 为速率常数)。下列表述正确的是
a.N2O分解反应中,k(含碘)<k(无碘)
b.第一步对总反应速率起决定作用
c.第二步活化能比第三步大
d.I2浓度与 N2O分解速率无关
您最近一年使用:0次
2020-08-30更新
|
642次组卷
|
4卷引用:湖北省武汉市第三中学2019-2020学年高一5月月考化学试题
湖北省武汉市第三中学2019-2020学年高一5月月考化学试题山东省济南市外国语学校2021届高三下学期3月月考化学试题(已下线)02 化学反应原理综合题型集训之速率常数、快慢反应(解析)-备战2023年高考化学大题逐空突破系列(全国通用)(已下线)题型二 反应速率及速率常数的计算-备战2024年高考化学答题技巧与模板构建
名校
解题方法
9 . 砷(As)的原子结构如图所示: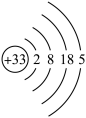 ,砷可以形成 As2O3、As2O5、H3AsO3、H3AsO4等化合物,它们有着广泛的用途。回答下列问题:
,砷可以形成 As2O3、As2O5、H3AsO3、H3AsO4等化合物,它们有着广泛的用途。回答下列问题:
(1)写出砷在元素周期表中的位置__________________ 。
(2)工业上常将含砷废渣(主要成分为As2S3)制成浆状,通入O2氧化,生成H3AsO4和单质硫。写出发生反应的化学方程式:____________ 。该反应需要在加压下进行,原因是___________ 。
(3) 已知:①As(s)+ H2(g)+2O2(g)=H3AsO4(s) ΔH1;
H2(g)+2O2(g)=H3AsO4(s) ΔH1;
②H2(g)+ O2(g)=H2O(l) ΔH2;
O2(g)=H2O(l) ΔH2;
③2As(s)+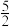 O2(g)=As2O5(s) ΔH3;
O2(g)=As2O5(s) ΔH3;
则反应As2O5(s)+3H2O(l)=2H3AsO4(s) 的ΔH =_________ 。(用ΔH1、ΔH2、ΔH3表示)
(4)298 K时,将20 mL 3x mol·L -1 Na3AsO3、20 mL 3x mol·L-1 I2和 20 mL NaOH溶液混合,发生反应:AsO33−(aq)+I2(aq)+2OH-(aq) AsO
AsO (aq)+2I-(aq)+H2O(l)。溶液中c(AsO
(aq)+2I-(aq)+H2O(l)。溶液中c(AsO )与反应时间的关系如图所示。
)与反应时间的关系如图所示。
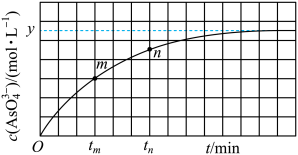
①下列可判断反应达到平衡的是_________ (填字母)。
a.溶液的 pH 不再变化
b. v(I-)=2v(AsO )
)
c. c(I-)=y mol·L-1
d. 不再变化
不再变化
② tm时, v逆_________ v正(填“大于”“小于”或“等于”)。
③ tn 时 v逆________ tm时v逆(填“大于”“小于”或“等于”,理由是_______________ 。
④若平衡时溶液的 pH=13,则该反应的平衡常数K为_______________ 。(用含x,y的代数式表示)
 ,砷可以形成 As2O3、As2O5、H3AsO3、H3AsO4等化合物,它们有着广泛的用途。回答下列问题:
,砷可以形成 As2O3、As2O5、H3AsO3、H3AsO4等化合物,它们有着广泛的用途。回答下列问题:(1)写出砷在元素周期表中的位置
(2)工业上常将含砷废渣(主要成分为As2S3)制成浆状,通入O2氧化,生成H3AsO4和单质硫。写出发生反应的化学方程式:
(3) 已知:①As(s)+
 H2(g)+2O2(g)=H3AsO4(s) ΔH1;
H2(g)+2O2(g)=H3AsO4(s) ΔH1;②H2(g)+
 O2(g)=H2O(l) ΔH2;
O2(g)=H2O(l) ΔH2;③2As(s)+
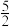 O2(g)=As2O5(s) ΔH3;
O2(g)=As2O5(s) ΔH3;则反应As2O5(s)+3H2O(l)=2H3AsO4(s) 的ΔH =
(4)298 K时,将20 mL 3x mol·L -1 Na3AsO3、20 mL 3x mol·L-1 I2和 20 mL NaOH溶液混合,发生反应:AsO33−(aq)+I2(aq)+2OH-(aq)
 AsO
AsO (aq)+2I-(aq)+H2O(l)。溶液中c(AsO
(aq)+2I-(aq)+H2O(l)。溶液中c(AsO )与反应时间的关系如图所示。
)与反应时间的关系如图所示。
①下列可判断反应达到平衡的是
a.溶液的 pH 不再变化
b. v(I-)=2v(AsO
 )
) c. c(I-)=y mol·L-1
d.
 不再变化
不再变化② tm时, v逆
③ tn 时 v逆
④若平衡时溶液的 pH=13,则该反应的平衡常数K为
您最近一年使用:0次
10 . 氢是人们公认的清洁能源,作为低碳和零碳能源正在脱颖而出,氢的获得及以氢为原料的工业生产工艺成为科技工作者研究的重要课题。
(1)工业生产中可利用H2还原CO2制备清洁能源甲醇。
①已知 CO(g)和H2(g)的燃烧热(ΔH)分别为-283.0 kJ·mol -1、-285.8 kJ·mol -1。CO与H2合成甲醇的能量变化如图甲所示。则用 CO2和H2(g)制备甲醇的热化学方程式为_____ 。

②将一定量的 CO2和H2充入到某恒容密闭容器中,测得在不同催化剂作用下,相同时间内CO2的转化率与温度的变化如图乙所示:
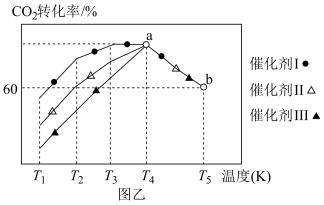
催化效果最好的是催化剂____________ (选填“Ⅰ”“Ⅱ”或“Ⅲ”),该反应在a点达到平衡状态,a点的转化率比b点的高,其原因是_____________ 。
(2) 利用CO和水蒸气可生产H2,反应的化学方程式:CO(g)+H2O(g) CO2(g)+H2(g)。将不同量的 CO(g)和H2O(g)分别通入到体积为2 L 的恒容密闭容器中进行反应,得到三组数据如下表所示:
CO2(g)+H2(g)。将不同量的 CO(g)和H2O(g)分别通入到体积为2 L 的恒容密闭容器中进行反应,得到三组数据如下表所示:
①该反应的ΔH_______ 0(选填“>”或“<”)。
②900℃时,达到平衡时c(CO)=_______ ,达到平衡时的反应速率v(H2O)=____ (保留2位小数)。
(3) 利用废弃的H2S的热分解可生产H2:
2H2S(g) 2H2(g)+S2(g)。现将0.20 mol H2S(g)通入到某恒压(压强 p=aMPa)密闭容器中,在不同温度下测得H2S的平衡转化率如下图所示:
2H2(g)+S2(g)。现将0.20 mol H2S(g)通入到某恒压(压强 p=aMPa)密闭容器中,在不同温度下测得H2S的平衡转化率如下图所示:

已知:对于气相反应,用某组分(B)的平衡分压(pB)代替物质的量浓度(cB)也可表示平衡常数。温度为T 6℃时,该反应的平衡常数Kp =_______ (用a的代数式表示)。
(1)工业生产中可利用H2还原CO2制备清洁能源甲醇。
①已知 CO(g)和H2(g)的燃烧热(ΔH)分别为-283.0 kJ·mol -1、-285.8 kJ·mol -1。CO与H2合成甲醇的能量变化如图甲所示。则用 CO2和H2(g)制备甲醇的热化学方程式为

②将一定量的 CO2和H2充入到某恒容密闭容器中,测得在不同催化剂作用下,相同时间内CO2的转化率与温度的变化如图乙所示:

催化效果最好的是催化剂
(2) 利用CO和水蒸气可生产H2,反应的化学方程式:CO(g)+H2O(g)
 CO2(g)+H2(g)。将不同量的 CO(g)和H2O(g)分别通入到体积为2 L 的恒容密闭容器中进行反应,得到三组数据如下表所示:
CO2(g)+H2(g)。将不同量的 CO(g)和H2O(g)分别通入到体积为2 L 的恒容密闭容器中进行反应,得到三组数据如下表所示:| 温度/℃ | 起始量 | 达到平衡 | |||
| CO/mol | H2O/mol | H2/mol | CO转化率 | 时间/min | |
| 650 | 4 | 2 | 1.6 | 6 | |
| 900 | 3 | 2 |  | 3 | |
②900℃时,达到平衡时c(CO)=
(3) 利用废弃的H2S的热分解可生产H2:
2H2S(g)
 2H2(g)+S2(g)。现将0.20 mol H2S(g)通入到某恒压(压强 p=aMPa)密闭容器中,在不同温度下测得H2S的平衡转化率如下图所示:
2H2(g)+S2(g)。现将0.20 mol H2S(g)通入到某恒压(压强 p=aMPa)密闭容器中,在不同温度下测得H2S的平衡转化率如下图所示:
已知:对于气相反应,用某组分(B)的平衡分压(pB)代替物质的量浓度(cB)也可表示平衡常数。温度为T 6℃时,该反应的平衡常数Kp =
您最近一年使用:0次

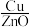 纳米棒
纳米棒