名校
解题方法
1 . TiO2和TiCl4均为重要的化工原料,已知:
Ⅰ.TiCl4(g)+O2(g) TiO2(s)+2Cl2(g) ΔH=-175.4kJ/mol
TiO2(s)+2Cl2(g) ΔH=-175.4kJ/mol
Ⅱ.2C(s)+O2(g) 2CO(g) ΔH=-220.9kJ/mol
2CO(g) ΔH=-220.9kJ/mol
请回答下列问题:
(1)TiCl4(g)+2CO(g) TiO2(s)+2C(s)+2Cl2(g)的ΔH=
TiO2(s)+2C(s)+2Cl2(g)的ΔH=___ kJ/mol。
(2)t℃时,向10L恒容密闭容器中充入1molTiCl4和2molO2,发生反应I,4min达到平衡时测得TiO2的物质的量为0.2mol。
①反应0~4min末的平均速率v(Cl2)=_ ,该温度下K=_ (用分数表示),O2的平衡转化率=__ 。
②下列措施,既能加快正反应速率,又能增大O2的平衡转化率的是_ 。
A.缩小容器的体积
B.加入催化剂
C.分离出部分TiO2
D.增加O2的浓度
E.减低温度
F.以上方法均不可以
③t℃时,向10L恒容密闭容器中充入3molTiCl4和一定量的O2,发生反应I,两种气体的平衡转化率(a%)与起始的物质的量之比(TiCl4/O2)的关系如图1所示:能表示O2的平衡转化率的曲线为___ (填“L1”或“L2”),M点的坐标为___ (用整数或分数表示)。

(3)CO是有毒气体,测定空气中CO含量常用的方法之一是电化学气敏传感器法。其中CO传感器的工作原理如图2所示,则工作电极的反应式为___ ;为减少对环境造成的影响,用CO和H2可以制备甲醇(CH3OH),以甲醇为燃料,氧气为氧化剂,KOH溶液为电解质溶液,可制成燃料电池(电极材料为惰性电极)若电解质溶液中KOH的物质的量为0.8mol,当有0.5mol甲醇参与反应时,电解质溶液中溶质的主要成分是___ (写化学式)。

Ⅰ.TiCl4(g)+O2(g)
 TiO2(s)+2Cl2(g) ΔH=-175.4kJ/mol
TiO2(s)+2Cl2(g) ΔH=-175.4kJ/molⅡ.2C(s)+O2(g)
 2CO(g) ΔH=-220.9kJ/mol
2CO(g) ΔH=-220.9kJ/mol请回答下列问题:
(1)TiCl4(g)+2CO(g)
 TiO2(s)+2C(s)+2Cl2(g)的ΔH=
TiO2(s)+2C(s)+2Cl2(g)的ΔH=(2)t℃时,向10L恒容密闭容器中充入1molTiCl4和2molO2,发生反应I,4min达到平衡时测得TiO2的物质的量为0.2mol。
①反应0~4min末的平均速率v(Cl2)=
②下列措施,既能加快正反应速率,又能增大O2的平衡转化率的是
A.缩小容器的体积
B.加入催化剂
C.分离出部分TiO2
D.增加O2的浓度
E.减低温度
F.以上方法均不可以
③t℃时,向10L恒容密闭容器中充入3molTiCl4和一定量的O2,发生反应I,两种气体的平衡转化率(a%)与起始的物质的量之比(TiCl4/O2)的关系如图1所示:能表示O2的平衡转化率的曲线为

(3)CO是有毒气体,测定空气中CO含量常用的方法之一是电化学气敏传感器法。其中CO传感器的工作原理如图2所示,则工作电极的反应式为

您最近一年使用:0次
2020-04-13更新
|
193次组卷
|
2卷引用:宁夏回族自治区银川一中2020届高三第二次模拟考试理综化学试题
2 . 氯气是现代工业的重要原料,将氯化氢转化为氯气的技术成为科学研究的热车点,回答下列问题:
(1)Deacon发明的直接氧化法为:4HCl(g)+O2(g)=2Cl2(g)+2H2O(g)。可按下列催化过程进行:
Ⅰ.CuCl2(s)=CuCl(s)+ Cl2(g) ΔH1=+83kJ·mol-1
Cl2(g) ΔH1=+83kJ·mol-1
Ⅱ.CuCl(s)+ O2(g)=CuO(s)+
O2(g)=CuO(s)+ Cl2(g) ΔH2=-20kJ·mol-1
Cl2(g) ΔH2=-20kJ·mol-1
Ⅲ.4HCl(g)+O2(g)=2Cl2(g)+2H2O(g) ΔH3
反应Ⅰ能自发进行的条件是___ 。利用ΔH1和ΔH2计算ΔH3时,还需要利用反应___ 的ΔH。
(2)如图为刚性容器中,进料浓度比c(HCl):c(O2)分别等于1:1、4:1、7:1时HCl平衡转化率随温度变化的关系:

可知反应平衡常数K(400℃)__ K(500℃)(填“大于”或“小于”)。设容器内初始压强为p0,根据进料浓度比c(HCl):c(O2)=4:1的数据,计算400℃时容器内的平衡压强=___ (列出计算式)。按化学计量比进料可以保持反应物高转化率,同时降低产物分离的能耗。进料浓度比c(HCl):c(O2)过低、过高的不利影响分别是___ 。
(3)已知:氯气与NaOH溶液反应可生成NaClO3。有研究表明,生成NaClO3的反应分两步进行:
Ⅰ.2ClO-=ClO2-+Cl-
Ⅱ.ClO2-+ClO-=ClO3-+Cl-
常温下,反应Ⅱ能快速进行,但氯气与NaOH溶液反应很难得到NaClO3,试用碰撞理论解释其原因:___ 。
(4)电解NaClO3水溶液可制备NaClO4,写出阳极反应式:___ 。
(1)Deacon发明的直接氧化法为:4HCl(g)+O2(g)=2Cl2(g)+2H2O(g)。可按下列催化过程进行:
Ⅰ.CuCl2(s)=CuCl(s)+
 Cl2(g) ΔH1=+83kJ·mol-1
Cl2(g) ΔH1=+83kJ·mol-1Ⅱ.CuCl(s)+
 O2(g)=CuO(s)+
O2(g)=CuO(s)+ Cl2(g) ΔH2=-20kJ·mol-1
Cl2(g) ΔH2=-20kJ·mol-1Ⅲ.4HCl(g)+O2(g)=2Cl2(g)+2H2O(g) ΔH3
反应Ⅰ能自发进行的条件是
(2)如图为刚性容器中,进料浓度比c(HCl):c(O2)分别等于1:1、4:1、7:1时HCl平衡转化率随温度变化的关系:

可知反应平衡常数K(400℃)
(3)已知:氯气与NaOH溶液反应可生成NaClO3。有研究表明,生成NaClO3的反应分两步进行:
Ⅰ.2ClO-=ClO2-+Cl-
Ⅱ.ClO2-+ClO-=ClO3-+Cl-
常温下,反应Ⅱ能快速进行,但氯气与NaOH溶液反应很难得到NaClO3,试用碰撞理论解释其原因:
(4)电解NaClO3水溶液可制备NaClO4,写出阳极反应式:
您最近一年使用:0次
2020-03-27更新
|
410次组卷
|
3卷引用:湖北省宜昌市2020届高三年级3月线上统一调研试题理综化学试题
3 . “低碳经济”已成为全世界科学家研究的重要课题。为减小和消除 CO2对环境的影响,一方面世界各国都在限制其排放量,另一方面科学家加强了对 CO2 创新利用的研究。
(1)已知:①CO(g)+H2O(g) H2(g)+CO2(g) △H=-41kJ/mol
H2(g)+CO2(g) △H=-41kJ/mol
②C(s)+2H2(g) CH4(g) △H=-73kJ/mol
CH4(g) △H=-73kJ/mol
③2CO(g) C(s)+CO2(g) △H=-171kJ/mol
C(s)+CO2(g) △H=-171kJ/mol
写出CO2与H2反应生成CH4和H2O(g)的热化学方程式:_____ 。
(2)目前工业上有一种方法是用 CO2来生产燃料甲醇。为探究该反应原理,在容积为 2L密闭容器中,充入1molCO2和 3.25molH2在一定条件下发生反应,测得 CO2、CH3OH(g)和 H2O(g)的物质的量(n)随时间的变化如图所示:
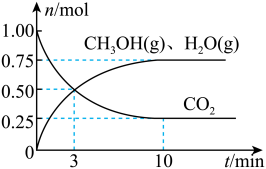
①从反应开始到平衡,氢气的平均反应速率v(H2)=____ 。
②下列措施一定不能使CO2的平衡转化率增大的是____ (填字母)。
A.在原容器中再充入1molCO2
B.在原容器中再充入1molH2
C.在原容器中充入1mol氦气
D.使用更有效的催化剂
E.缩小容器的容积
F.将水蒸气从体系中分离
(3)煤化工通常研究不同条件下CO转化率以解决实际问题。已知在催化剂存在条件下反应:CO(g)+H2O(g)⇌H2(g)+CO2(g)的平衡转化率随p(H2O)/p(CO)及温度变化关系如图所示:
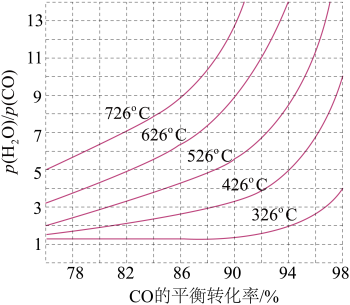
①上述反应的正反应方向是____ (填“吸热”或“放热”)反应;
②对于气相反应,用某组分(B)的平衡压强(pB)代替物质的量浓度(cB)也可以表示平衡常数(记作 Kp),则在恒温密闭容器中,该反应的Kp与Kc的关系是_______ ,如果提高p(H2O)/p(CO),则Kp_______ (填“变大”“变小”或“不变”);使用铁镁催化剂的实际工业流程中,一般采用400℃左右,p(H2O)/p(CO) =3~5,采取此条件的原因可能是 _________ 。
(4)科学家用氮化镓材料与铜组装成如图所示的人工光合系统,利用该装置实现了用CO2和H2O合成CH4。下列关于该电池的叙述正确的是____ (填字母)。
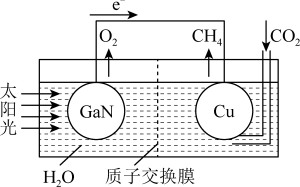
A.该装置能量转化形式仅存在太阳能转化为电能
B.铜电极为正极,电极反应式为CO2+8e-+8H+=CH4+2H2O
C.电池内部H+透过质子交换膜从左向右移动
D.反应结束后,理论上溶液的 pH 值保持不变
(1)已知:①CO(g)+H2O(g)
 H2(g)+CO2(g) △H=-41kJ/mol
H2(g)+CO2(g) △H=-41kJ/mol②C(s)+2H2(g)
 CH4(g) △H=-73kJ/mol
CH4(g) △H=-73kJ/mol③2CO(g)
 C(s)+CO2(g) △H=-171kJ/mol
C(s)+CO2(g) △H=-171kJ/mol写出CO2与H2反应生成CH4和H2O(g)的热化学方程式:
(2)目前工业上有一种方法是用 CO2来生产燃料甲醇。为探究该反应原理,在容积为 2L密闭容器中,充入1molCO2和 3.25molH2在一定条件下发生反应,测得 CO2、CH3OH(g)和 H2O(g)的物质的量(n)随时间的变化如图所示:

①从反应开始到平衡,氢气的平均反应速率v(H2)=
②下列措施一定不能使CO2的平衡转化率增大的是
A.在原容器中再充入1molCO2
B.在原容器中再充入1molH2
C.在原容器中充入1mol氦气
D.使用更有效的催化剂
E.缩小容器的容积
F.将水蒸气从体系中分离
(3)煤化工通常研究不同条件下CO转化率以解决实际问题。已知在催化剂存在条件下反应:CO(g)+H2O(g)⇌H2(g)+CO2(g)的平衡转化率随p(H2O)/p(CO)及温度变化关系如图所示:

①上述反应的正反应方向是
②对于气相反应,用某组分(B)的平衡压强(pB)代替物质的量浓度(cB)也可以表示平衡常数(记作 Kp),则在恒温密闭容器中,该反应的Kp与Kc的关系是
(4)科学家用氮化镓材料与铜组装成如图所示的人工光合系统,利用该装置实现了用CO2和H2O合成CH4。下列关于该电池的叙述正确的是

A.该装置能量转化形式仅存在太阳能转化为电能
B.铜电极为正极,电极反应式为CO2+8e-+8H+=CH4+2H2O
C.电池内部H+透过质子交换膜从左向右移动
D.反应结束后,理论上溶液的 pH 值保持不变
您最近一年使用:0次
名校
解题方法
4 . 在化工生产、污水处理中广泛涉及硫单质及其化合物。
Ⅰ.煤制得的化工原料中含有羰基硫(O===C===S),该物质可转化为H2S,主要反应如下:①水解反应:COS(g)+H2O(g) H2S(g)+CO2(g) ΔH1=-94 kJ·mol-1,②氢解反应:COS(g)+H2(g)
H2S(g)+CO2(g) ΔH1=-94 kJ·mol-1,②氢解反应:COS(g)+H2(g) H2S(g)+CO(g) ΔH2=-54 kJ·mol-1。
H2S(g)+CO(g) ΔH2=-54 kJ·mol-1。
(1)请计算CO(g)和H2O(g)生成H2(g)和CO2(g)的反应热ΔH=______ 。
(2)在定温定容的密闭容器中进行反应①,下列事实说明反应①达到平衡状态的是_____ (填字母)。
A.容器的压强不再改变
B.混合气体的密度不再改变
C.化学平衡常数不再改变
D.生成1 mol H—O键,同时生成1 mol H—S键
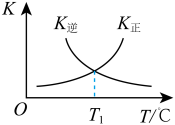
(3)反应②的正、逆反应的平衡常数(K)与温度(T)的关系如图所示。在T1℃时,向容积为5 L的密闭容器中加入2 mol COS(g)和1 mol H2(g),充分反应,COS的平衡转化率为______ 。
Ⅱ.在容积为2 L的恒容密闭容器中,充入0.5 mol H2S(g),发生反应:2H2S(g) 2H2(g)+S2(g),在不同温度和压强下进行实验,结果如图所示。
2H2(g)+S2(g),在不同温度和压强下进行实验,结果如图所示。
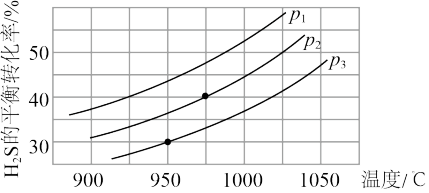
(4)图中压强p1、p2、p3由大到小的顺序是______ 。
(5)在950 ℃,压强为p3时,反应经30 min达到平衡,则平均反应速率v(H2)=_______ 。
(6)在p2=6 MPa,温度为975 ℃时,请计算该反应的平衡常数Kc为_____ (保留2位有效数字)。对于气相反应,用某组分(B)的平衡分压(pB)代替物质的量浓度(cB)也可以表示平衡常数(记作Kp),pB=p总×B的物质的量分数,则此条件下该反应的平衡常数Kp=___ MPa。
Ⅰ.煤制得的化工原料中含有羰基硫(O===C===S),该物质可转化为H2S,主要反应如下:①水解反应:COS(g)+H2O(g)
 H2S(g)+CO2(g) ΔH1=-94 kJ·mol-1,②氢解反应:COS(g)+H2(g)
H2S(g)+CO2(g) ΔH1=-94 kJ·mol-1,②氢解反应:COS(g)+H2(g) H2S(g)+CO(g) ΔH2=-54 kJ·mol-1。
H2S(g)+CO(g) ΔH2=-54 kJ·mol-1。(1)请计算CO(g)和H2O(g)生成H2(g)和CO2(g)的反应热ΔH=
(2)在定温定容的密闭容器中进行反应①,下列事实说明反应①达到平衡状态的是
A.容器的压强不再改变
B.混合气体的密度不再改变
C.化学平衡常数不再改变
D.生成1 mol H—O键,同时生成1 mol H—S键
(3)反应②的正、逆反应的平衡常数(K)与温度(T)的关系如图所示。在T1℃时,向容积为5 L的密闭容器中加入2 mol COS(g)和1 mol H2(g),充分反应,COS的平衡转化率为
Ⅱ.在容积为2 L的恒容密闭容器中,充入0.5 mol H2S(g),发生反应:2H2S(g)
 2H2(g)+S2(g),在不同温度和压强下进行实验,结果如图所示。
2H2(g)+S2(g),在不同温度和压强下进行实验,结果如图所示。
(4)图中压强p1、p2、p3由大到小的顺序是
(5)在950 ℃,压强为p3时,反应经30 min达到平衡,则平均反应速率v(H2)=
(6)在p2=6 MPa,温度为975 ℃时,请计算该反应的平衡常数Kc为
您最近一年使用:0次
2020-03-17更新
|
205次组卷
|
2卷引用:云南省楚雄姚安一中2020届高三3月线上模拟理综化学试题
名校
解题方法
5 . 三甲胺N(CH3)3是重要的化工原料。最近我国科学家实现了使用铜催化剂将N,N—二甲基甲酰胺【N(CH3)2NCHO,简称DMF】转化为三甲胺的合成路线。回答下列问题:
(1)结合实验与计算机模拟结果,研究单一DMF分子在铜催化剂表面的反应历程,如图所示:
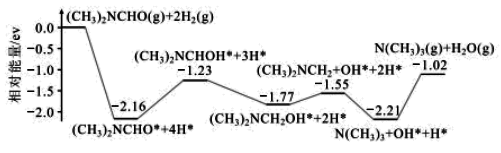
该历程中最大能垒(活化能)=__ eV,该步骤的化学方程式为__ 。
(2)该反应变化的ΔH__ 0(填“<”、“>”或“=”),制备三甲胺的热化学方程式为__ 。
(3)160℃时,将DMF(g)和H2(g)以物质的量之比为1:2充入盛有催化剂的刚性容器中,容器内起始压强为p0,达到平衡时DMF的转化率为25%,则该反应的平衡常数Kp=__ (Kp为以分压表示的平衡常数);能够增大DMF平衡转化率同时加快反应速率的操作是__ 。
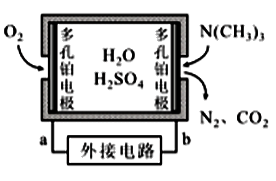
(4)三甲胺是鱼腥臭的主要来源,是判断海水鱼类鲜度的化学指标之一。通过传感器产生的电流强度可以监测水产品中三甲胺的含量,一种燃料电池型三甲胺气体传感器的原理如图所示。外电路的电流方向为__ (填“a→b”或“b→a”),负极的电极反应式为__ 。
(1)结合实验与计算机模拟结果,研究单一DMF分子在铜催化剂表面的反应历程,如图所示:

该历程中最大能垒(活化能)=
(2)该反应变化的ΔH
(3)160℃时,将DMF(g)和H2(g)以物质的量之比为1:2充入盛有催化剂的刚性容器中,容器内起始压强为p0,达到平衡时DMF的转化率为25%,则该反应的平衡常数Kp=
(4)三甲胺是鱼腥臭的主要来源,是判断海水鱼类鲜度的化学指标之一。通过传感器产生的电流强度可以监测水产品中三甲胺的含量,一种燃料电池型三甲胺气体传感器的原理如图所示。外电路的电流方向为

您最近一年使用:0次
2020-03-14更新
|
733次组卷
|
3卷引用:武汉市2020届高中毕业生学生质量检测化学试题
武汉市2020届高中毕业生学生质量检测化学试题吉林省实验中学2022届高三下学期第二次模拟理综化学试题(已下线)01 化学反应原理综合题型集训之催化剂、活化能与反应历程(解析)-备战2023年高考化学大题逐空突破系列(全国通用)
名校
解题方法
6 . 根据要求填空
(1)打火机、运动会中的火炬一般采用丙烷(C3H8)为燃料。丙烷热值较高,污染较小,是一种优良的燃料。已知一定量丙烷完全燃烧生成CO2和1molH2O(l)过程中的能量变化如图,请写出表示丙烷燃烧热的热化学方程式:__ 。

(2)CO与H2反应还可制备CH3OH,CH3OH可作为燃料使用,用CH3OH和O2组合形成的质子交换膜燃料电池的结构示意图如图:

①电池总反应为2CH3OH+3O2=2CO2+4H2O,则c电极是__ (填“正极”或“负极”),c电极的反应方程式为___ 。
②用该燃料电池电解1L饱和食盐水(足量),当燃料电池消耗0.56L(标准状况下)氧气时,溶液pH=___ (不考虑溶液体积变化)。
(3)有人设想以N2和H2为反应物,以溶有A的稀盐酸为电解质溶液,可制造出既能提供电能,又能固氮的新型燃料电池,装置如图所示,电池正极的电极反应式是__ ,该反应能设计成原电池的原因是__ 。A是__ (填物质名称)。

(1)打火机、运动会中的火炬一般采用丙烷(C3H8)为燃料。丙烷热值较高,污染较小,是一种优良的燃料。已知一定量丙烷完全燃烧生成CO2和1molH2O(l)过程中的能量变化如图,请写出表示丙烷燃烧热的热化学方程式:

(2)CO与H2反应还可制备CH3OH,CH3OH可作为燃料使用,用CH3OH和O2组合形成的质子交换膜燃料电池的结构示意图如图:

①电池总反应为2CH3OH+3O2=2CO2+4H2O,则c电极是
②用该燃料电池电解1L饱和食盐水(足量),当燃料电池消耗0.56L(标准状况下)氧气时,溶液pH=
(3)有人设想以N2和H2为反应物,以溶有A的稀盐酸为电解质溶液,可制造出既能提供电能,又能固氮的新型燃料电池,装置如图所示,电池正极的电极反应式是

您最近一年使用:0次
2020-03-08更新
|
125次组卷
|
2卷引用:湖北省荆州市四县市2019-2020学年高二上学期期末考试化学试题
名校
7 . 研究碳、氮、硫等元素化合物的性质或转化对建设生态文明、美丽中国具有重要意义。
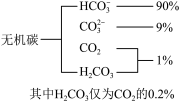
(1)海水中无机碳的存在形式及分布如图所示,用离子方程式表示海水呈弱碱性的主要原因______________________ 。已知春季海水pH=8.1,预测冬季海水碱性将会_______ (填“增强”或“减弱”),理由是_________________ 。
(2)工业上以CO和H2为原料合成甲醇的反应:CO(g)+2H2(g)===CH3OH(g) ΔH<0,在容积为1L的恒容容器中,分别在T1、T2、T3三种温度下合成甲醇。如图是上述三种温度下不同H2和CO的起始组成比(起始时CO的物质的量均为1mol)与CO平衡转化率的关系。下列说法正确的是________ (填字母)。
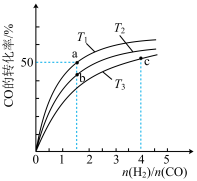
A.a、b、c三点H2转化率:c>a>b
B.上述三种温度之间关系为T1>T2>T3
C.c点状态下再通入1molCO和4molH2,新平衡中H2的体积分数增大
D.a点状态下再通入0.5molCO和0.5molCH3OH,平衡不移动
(3)NO加速臭氧层被破坏,其反应过程如下图所示:
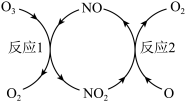
①NO的作用是_________________ 。
②已知:O3(g)+O(g)===2O2(g) ΔH=-143kJ·mol-1
反应1:O3(g)+NO(g)===NO2(g)+O2(g) ΔH1=-200.2kJ·mol-1。
反应2:热化学方程式为____________________________ 。
(4)若将CO和NO按不同比例投入一密闭容器中发生反应:2CO(g)+2NO(g)=N2(g)+2CO2(g) ΔH=-759.8kJ·mol -1,反应达到平衡时,N的体积分数随n(CO)n(NO)的变化曲线如下图。
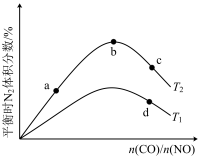
①b点时,平衡体系中C、N原子个数之比接近________ 。
②a、b、c三点CO的转化率从小到大的顺序为________ ;b、c、d三点的平衡常数从大到小的顺序为__________ 。
③若n(CO)n(NO)=0.8,反应达平衡时,N的体积分数为20%,则NO的转化率为_____ 。

(1)海水中无机碳的存在形式及分布如图所示,用离子方程式表示海水呈弱碱性的主要原因
(2)工业上以CO和H2为原料合成甲醇的反应:CO(g)+2H2(g)===CH3OH(g) ΔH<0,在容积为1L的恒容容器中,分别在T1、T2、T3三种温度下合成甲醇。如图是上述三种温度下不同H2和CO的起始组成比(起始时CO的物质的量均为1mol)与CO平衡转化率的关系。下列说法正确的是

A.a、b、c三点H2转化率:c>a>b
B.上述三种温度之间关系为T1>T2>T3
C.c点状态下再通入1molCO和4molH2,新平衡中H2的体积分数增大
D.a点状态下再通入0.5molCO和0.5molCH3OH,平衡不移动
(3)NO加速臭氧层被破坏,其反应过程如下图所示:

①NO的作用是
②已知:O3(g)+O(g)===2O2(g) ΔH=-143kJ·mol-1
反应1:O3(g)+NO(g)===NO2(g)+O2(g) ΔH1=-200.2kJ·mol-1。
反应2:热化学方程式为
(4)若将CO和NO按不同比例投入一密闭容器中发生反应:2CO(g)+2NO(g)=N2(g)+2CO2(g) ΔH=-759.8kJ·mol -1,反应达到平衡时,N的体积分数随n(CO)n(NO)的变化曲线如下图。

①b点时,平衡体系中C、N原子个数之比接近
②a、b、c三点CO的转化率从小到大的顺序为
③若n(CO)n(NO)=0.8,反应达平衡时,N的体积分数为20%,则NO的转化率为
您最近一年使用:0次
2020-03-05更新
|
448次组卷
|
2卷引用:湖北省黄石二中2020届高三4月线上考试理综化学试题
8 . 含氮化合物是化工、能源、环保等领域的研究热点。回答下列问题:
(1)N2O在金粉表面发生热分解反应:2N2O(g) 2N2(g)+O2(g) ∆H
2N2(g)+O2(g) ∆H
已知:4NH3(g)+3O2(g)=2N2(g)+6H2O(l) ∆H1
2NH3(g)+3N2O(g)=4N2(g)+3H2O(l) ∆H2
∆H=____ (用含∆H1、∆H2的代数式表示)。
(2)一氧化二氮可反生2N2O(g) 2N2(g)+O2(g)。不同温度(T),N2O分解半哀期随起始压强的变化关系如图所示(图中半衰期指任一浓度N2O消耗一半时所需的相应时间),则T1
2N2(g)+O2(g)。不同温度(T),N2O分解半哀期随起始压强的变化关系如图所示(图中半衰期指任一浓度N2O消耗一半时所需的相应时间),则T1___ T2(填“>”、“=”或“<”)。当温度为T1、起始压强为P0,反应至t1min时,体系压强P=____ (用P0表示)。

(3)将NH3与O2按体积比4:5充入刚性容器中,起始体系总压强为P0kPa,分别在催化剂M、N作用下发生反应4NH3(g)+5O2(g)=4NO(g)+6H2O(g) ∆H3=-905.0kJ/mol,NH3的分压(P)与时间和温度的关系如图所示:

①催化剂的催化效果:M____ N(填“强于”或“弱于”)。
②T°C时,0~12.5min内P(NH3)减小量___ (填“>”、“=”或“<”)12.5~25min内P(NH3)减小量,理由为___ 。
(4)NaClO2是一种绿色消毒剂和漂白剂,工业上采用电解法制备NaClO2的原理如图所示。
①交换膜应选用___ (填“阳离子交换膜”或“阴离子交换膜”)。
②阳极的电极反应式为_____ 。

(1)N2O在金粉表面发生热分解反应:2N2O(g)
 2N2(g)+O2(g) ∆H
2N2(g)+O2(g) ∆H已知:4NH3(g)+3O2(g)=2N2(g)+6H2O(l) ∆H1
2NH3(g)+3N2O(g)=4N2(g)+3H2O(l) ∆H2
∆H=
(2)一氧化二氮可反生2N2O(g)
 2N2(g)+O2(g)。不同温度(T),N2O分解半哀期随起始压强的变化关系如图所示(图中半衰期指任一浓度N2O消耗一半时所需的相应时间),则T1
2N2(g)+O2(g)。不同温度(T),N2O分解半哀期随起始压强的变化关系如图所示(图中半衰期指任一浓度N2O消耗一半时所需的相应时间),则T1
(3)将NH3与O2按体积比4:5充入刚性容器中,起始体系总压强为P0kPa,分别在催化剂M、N作用下发生反应4NH3(g)+5O2(g)=4NO(g)+6H2O(g) ∆H3=-905.0kJ/mol,NH3的分压(P)与时间和温度的关系如图所示:

①催化剂的催化效果:M
②T°C时,0~12.5min内P(NH3)减小量
(4)NaClO2是一种绿色消毒剂和漂白剂,工业上采用电解法制备NaClO2的原理如图所示。
①交换膜应选用
②阳极的电极反应式为

您最近一年使用:0次
9 . 根据要求填空:
(1)FeSO4可转化为FeCO3,FeCO3在空气中加热可制得铁系氧化物材料,已知25℃,101KPa时:4Fe(s)+3O2(g)=2Fe2O3(s) △H=-1648kJ/mol
C(s)+O2(g)=CO2(g) △H=-393kJ/mol
2Fe(s)+2C(s)+3O2(g)=2FeCO3(s) △H=-1480kJ/mol
FeCO3在空气中加热反应生成Fe2O3的热化学方程式为___ 。
(2)某温度时水的离子积Kw=1.0×10-13,则该温度时纯水的pH__ 7(填“>”、“<”或“=”)。该温度下,pH=2的CH3COOH溶液中,c(OH-)=__ 。
(3)向2份0.1mol/LCH3COONa溶液中分别加入少量NH4NO3、Na2SO3固体(忽略体积变化),则CH3COO-浓度的变化依次为___ 、___ (填“减小”“增大”或“不变”)。
(4)同浓度的NaA和NaB两种溶液pH前者大于后者,比较两份溶液中所含阴离子总浓度大小为c(NaA)__ c(NaB)(填“>”、“<”或“=“)。
(5)25℃时,某溶液中Fe3+的浓度为0.010mol/L,使Fe3+恰好完全沉淀的pH为__ 。(已知:当离子浓度小于或等于10-5mol/L认为完全反应;Ksp[Fe(OH)3]=8×10-38,lg2=0.3)
(1)FeSO4可转化为FeCO3,FeCO3在空气中加热可制得铁系氧化物材料,已知25℃,101KPa时:4Fe(s)+3O2(g)=2Fe2O3(s) △H=-1648kJ/mol
C(s)+O2(g)=CO2(g) △H=-393kJ/mol
2Fe(s)+2C(s)+3O2(g)=2FeCO3(s) △H=-1480kJ/mol
FeCO3在空气中加热反应生成Fe2O3的热化学方程式为
(2)某温度时水的离子积Kw=1.0×10-13,则该温度时纯水的pH
(3)向2份0.1mol/LCH3COONa溶液中分别加入少量NH4NO3、Na2SO3固体(忽略体积变化),则CH3COO-浓度的变化依次为
(4)同浓度的NaA和NaB两种溶液pH前者大于后者,比较两份溶液中所含阴离子总浓度大小为c(NaA)
(5)25℃时,某溶液中Fe3+的浓度为0.010mol/L,使Fe3+恰好完全沉淀的pH为
您最近一年使用:0次
2020-03-02更新
|
83次组卷
|
2卷引用:湖北省鄂州市2019-2020学年高二上学期期末考试化学试题
名校
解题方法
10 . 乙酸制氢具有重要意义:
热裂解反应:CH3COOH(g)=2CO(g)+2H2(g) ∆H=+213.7kJ·mol-1
脱羧基反应:CH3COOH(g)=CH4(g)+CO2(g) ∆H=−33.5kJ·mol-1
(1)2CO(g)+2H2(g)=CH4(g)+CO2(g) ∆H=____ kJ·mol-1。
(2)在密闭容器中,利用乙酸制氢,选择的压强为_____ (填“高压”或“常压”)。其中温度与气体产率的关系如图:

①约650℃之前,脱羧基反应活化能低,反应速率快,很快达到平衡,故氢气产率低于甲烷;650℃之后氢气产率高于甲烷,理由是____ 。
②保持其他条件不变,在乙酸气中掺杂一定量的水,氢气产率显著提高而CO的产率下降,请用化学方程式表示____ 。
(3)保持温度为T℃,压强为pkPa不变的条件下,在密闭容器中投入一定量的醋酸发生上述两个反应,达到平衡时热裂解反应消耗乙酸20%,脱羧基反应消耗乙酸60%,则平衡时乙酸体积分数为____ (结果保留1位小数);脱羧基反应的平衡常数Kp为____ kPa(结果保留1位小数)。
(4)光催化反应技术使用CH4和____ (填化学式)直接合成乙酸,且符合“绿色化学”的要求(原子利用率100%)。
(5)若室温下将amol/L的CH3COOH溶液和bmol/LBa(OH)2溶液等体积混合,恢复室温后有2c(Ba2+)=c(CH3COO-),则乙酸的电离平衡常数Ka=____ (用含a和b的代数式表示)。
热裂解反应:CH3COOH(g)=2CO(g)+2H2(g) ∆H=+213.7kJ·mol-1
脱羧基反应:CH3COOH(g)=CH4(g)+CO2(g) ∆H=−33.5kJ·mol-1
(1)2CO(g)+2H2(g)=CH4(g)+CO2(g) ∆H=
(2)在密闭容器中,利用乙酸制氢,选择的压强为

①约650℃之前,脱羧基反应活化能低,反应速率快,很快达到平衡,故氢气产率低于甲烷;650℃之后氢气产率高于甲烷,理由是
②保持其他条件不变,在乙酸气中掺杂一定量的水,氢气产率显著提高而CO的产率下降,请用化学方程式表示
(3)保持温度为T℃,压强为pkPa不变的条件下,在密闭容器中投入一定量的醋酸发生上述两个反应,达到平衡时热裂解反应消耗乙酸20%,脱羧基反应消耗乙酸60%,则平衡时乙酸体积分数为
(4)光催化反应技术使用CH4和
(5)若室温下将amol/L的CH3COOH溶液和bmol/LBa(OH)2溶液等体积混合,恢复室温后有2c(Ba2+)=c(CH3COO-),则乙酸的电离平衡常数Ka=
您最近一年使用:0次
2020-02-26更新
|
583次组卷
|
5卷引用:重庆市第一中学2020届高三下学期第一次月考理科综合化学试题



