1 . 室温下,将1mol的CuSO4·5H2O(s)溶于水会使溶液温度降低,热效应为ΔH1,将1mol的CuSO4(s)溶于水会使溶液温度升高,热效应为ΔH2,CuSO4·5H2O受热分解的化学方程式为:CuSO4·5H2O(s) CuSO4(s)+5H2O(1),热效应为ΔH3.则下列判断正确的是
CuSO4(s)+5H2O(1),热效应为ΔH3.则下列判断正确的是
 CuSO4(s)+5H2O(1),热效应为ΔH3.则下列判断正确的是
CuSO4(s)+5H2O(1),热效应为ΔH3.则下列判断正确的是| A.ΔH2>ΔH3 | B.ΔH1<ΔH3 |
| C.ΔH1+ΔH3=ΔH2 | D.ΔH1+ΔH2=ΔH3 |
您最近一年使用:0次
2021-07-24更新
|
262次组卷
|
2卷引用:辽宁省铁岭市六校2020-2021学年高一下学期期末联考化学试题
名校
解题方法
2 . 源开发和利用是科学研究的热点课题。
(1)几个有关CO的热化学方程式如下:
I.CO(g)+2H2(g)⇌CH3OH(g) ∆H1
II.2CH3OH(g)⇌CH3OCH3(g)+H2O(g) ∆H2
III.CO(g)+H2O(g)⇌CO2(g)+H2(g) ∆H3
则3CO(g)+3H2(g)⇌CH3OCH3(g)+CO2(g) ∆H=_______ (用含∆H1、∆H2、∆H3的代数表示)。
(2)在1L恒容密闭容器中充入一定量CH3OH发生反应:2CH3OH(g)⇌CH3OCH3(g)+H2O(g) ∆H,测得CH3OH的浓度与温度的关系如图所示:
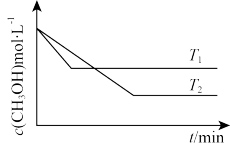
则T1_______ T2;∆H_______ 0(填“>”“<”或“=”)。
(3)工业上,利用水煤气合成CH3OH的反应表示如下:2H2(g)+CO(g)⇌CH3OH(g) ∆H=-91.0kJ·mol-1,向1L的恒容密容器中加入0.1molH2和0.05molCO在一定温度下发生上述反应,10min后反应达到平衡状态,测得放出的热量为3.64kJ。
①从反应开始恰好平衡状态时,H2的平均反应速率v(H2)为_______ 。
②在温度不变条件下,上述反应达到平衡后再向容器中充入0.01molH2和0.05molCH3OH(g)时,平衡_______ (填“向左移动”、“向右移动”或“不移动”)。
(4)探究CH3OH合成反应化学平衡的影响因素,有利于提高CH3OH的产率。以CO2、H2为原料合成CH3OH涉及的主要反应如下:
I.CO2(g)+3H2(g)⇌CH3OH(g)+H2O(g) ∆H=-49.5kJ·mol-1
II.CO(g)+2H2(g)⇌CH3OH(g) ∆H2=-90.4kJ·mol-1
III.CO2(g)+H2(g)⇌CO(g)+H2O(g) ∆H3
一定条件下,向体积为VL的恒容密闭容器中通入1molCO2和3molH2发生上述反应,达到平衡时,容器中CH3OH(g)为amol,CO为bmol,此时H2O(g)的浓度为_______ mol·L-1(用含a、b、V的代数式表示,下同),反应III的平衡常数为_______ 。
(1)几个有关CO的热化学方程式如下:
I.CO(g)+2H2(g)⇌CH3OH(g) ∆H1
II.2CH3OH(g)⇌CH3OCH3(g)+H2O(g) ∆H2
III.CO(g)+H2O(g)⇌CO2(g)+H2(g) ∆H3
则3CO(g)+3H2(g)⇌CH3OCH3(g)+CO2(g) ∆H=
(2)在1L恒容密闭容器中充入一定量CH3OH发生反应:2CH3OH(g)⇌CH3OCH3(g)+H2O(g) ∆H,测得CH3OH的浓度与温度的关系如图所示:

则T1
(3)工业上,利用水煤气合成CH3OH的反应表示如下:2H2(g)+CO(g)⇌CH3OH(g) ∆H=-91.0kJ·mol-1,向1L的恒容密容器中加入0.1molH2和0.05molCO在一定温度下发生上述反应,10min后反应达到平衡状态,测得放出的热量为3.64kJ。
①从反应开始恰好平衡状态时,H2的平均反应速率v(H2)为
②在温度不变条件下,上述反应达到平衡后再向容器中充入0.01molH2和0.05molCH3OH(g)时,平衡
(4)探究CH3OH合成反应化学平衡的影响因素,有利于提高CH3OH的产率。以CO2、H2为原料合成CH3OH涉及的主要反应如下:
I.CO2(g)+3H2(g)⇌CH3OH(g)+H2O(g) ∆H=-49.5kJ·mol-1
II.CO(g)+2H2(g)⇌CH3OH(g) ∆H2=-90.4kJ·mol-1
III.CO2(g)+H2(g)⇌CO(g)+H2O(g) ∆H3
一定条件下,向体积为VL的恒容密闭容器中通入1molCO2和3molH2发生上述反应,达到平衡时,容器中CH3OH(g)为amol,CO为bmol,此时H2O(g)的浓度为
您最近一年使用:0次
名校
解题方法
3 . 回答下列问题:
Ⅰ.已知: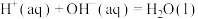
 ,现用下图所示装置测定中和热。
,现用下图所示装置测定中和热。
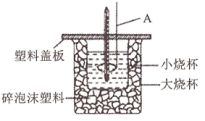
回答下列问题:
(1)碎泡沫塑料的作用是___________ ;若将A换为“铜丝搅拌棒”测得的 将
将___________ (填“偏大”、“偏小”或“不变”)。
(2)若用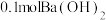 配制成稀溶液,与足量的稀硝酸反应,放出的热量为
配制成稀溶液,与足量的稀硝酸反应,放出的热量为___________ kJ。
Ⅱ.2021年5月29日天舟二号货运飞船成功发射,为中国空间站进一步开展在轨建造奠定了坚实基础,该飞船由长征七号遥三运载火箭搭载。长征七号遥三运载火箭使用煤油为燃料
(3)煤油的主要成分为 ,已知
,已知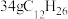 完全燃烧生成气态水时放出1386.2kJ热量;
完全燃烧生成气态水时放出1386.2kJ热量;
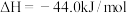 。则表示煤油燃烧热的热化学方程式为
。则表示煤油燃烧热的热化学方程式为___________ 。
(4)前期的火箭曾用液态肼(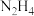 )与双氧水反应来提供能量。已知0.4mol液态肼与足量的双氧水反应,生成氮气和水蒸气,放出256.7kJ的热量,则此反应的热化学方程式为
)与双氧水反应来提供能量。已知0.4mol液态肼与足量的双氧水反应,生成氮气和水蒸气,放出256.7kJ的热量,则此反应的热化学方程式为___________ 。
Ⅲ.将氧化铁还原为铁的技术在人类文明进步中占据十分重要的地位。高炉炼铁中发生的部分反应为:
①
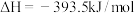
②

(5)已知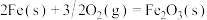
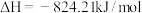 。则高炉内
。则高炉内 被CO还原为Fe的热化学方程式为
被CO还原为Fe的热化学方程式为___________ 。
(6)碳(s)在氧气不足的情况下燃烧,会生成CO,但同时也有部分生成 ,因此无法通过实验直接测得反应:
,因此无法通过实验直接测得反应: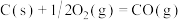 的
的 ,计算时需要测得的实验数据有
,计算时需要测得的实验数据有___________ 。若根据上述信息可计算出该反应的
___________ kJ/mol。
Ⅰ.已知:
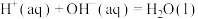
 ,现用下图所示装置测定中和热。
,现用下图所示装置测定中和热。
回答下列问题:
(1)碎泡沫塑料的作用是
 将
将(2)若用
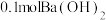 配制成稀溶液,与足量的稀硝酸反应,放出的热量为
配制成稀溶液,与足量的稀硝酸反应,放出的热量为Ⅱ.2021年5月29日天舟二号货运飞船成功发射,为中国空间站进一步开展在轨建造奠定了坚实基础,该飞船由长征七号遥三运载火箭搭载。长征七号遥三运载火箭使用煤油为燃料
(3)煤油的主要成分为
 ,已知
,已知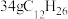 完全燃烧生成气态水时放出1386.2kJ热量;
完全燃烧生成气态水时放出1386.2kJ热量;
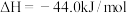 。则表示煤油燃烧热的热化学方程式为
。则表示煤油燃烧热的热化学方程式为(4)前期的火箭曾用液态肼(
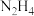 )与双氧水反应来提供能量。已知0.4mol液态肼与足量的双氧水反应,生成氮气和水蒸气,放出256.7kJ的热量,则此反应的热化学方程式为
)与双氧水反应来提供能量。已知0.4mol液态肼与足量的双氧水反应,生成氮气和水蒸气,放出256.7kJ的热量,则此反应的热化学方程式为Ⅲ.将氧化铁还原为铁的技术在人类文明进步中占据十分重要的地位。高炉炼铁中发生的部分反应为:
①

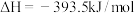
②


(5)已知
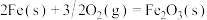
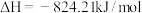 。则高炉内
。则高炉内 被CO还原为Fe的热化学方程式为
被CO还原为Fe的热化学方程式为(6)碳(s)在氧气不足的情况下燃烧,会生成CO,但同时也有部分生成
 ,因此无法通过实验直接测得反应:
,因此无法通过实验直接测得反应: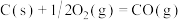 的
的 ,计算时需要测得的实验数据有
,计算时需要测得的实验数据有
您最近一年使用:0次
2021-07-22更新
|
255次组卷
|
2卷引用:四川省成都市龙泉驿区2020-2021学年高一下学期末学业质量监测联考化学试题
4 . 已知
①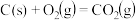
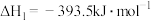
②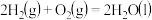
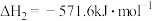
③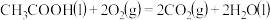
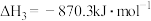
则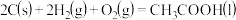 的
的 值为
值为
①
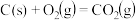
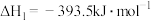
②
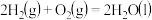
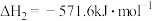
③
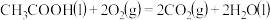
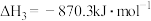
则
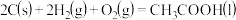 的
的 值为
值为A.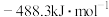 | B. |
C.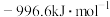 | D.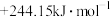 |
您最近一年使用:0次
2021-07-22更新
|
887次组卷
|
3卷引用:四川省成都市龙泉驿区2020-2021学年高一下学期末学业质量监测联考化学试题
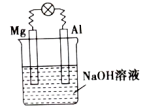
5 . 随着低碳钢等洁净钢技术的发展,Al2O3-C耐火材料和钢水之间的相互作用已成为当前的一个研究重点。请回答下列问题:
(1)将镁片、铝片平行插入一定浓度的NaOH溶液中,用导线连接成闭合回路,如图所示。写出铝电极的电极反应式:_____ 。
(2)在埋炭实验条件下,不同碳素材料的Al2O3-C耐火材料与铁液之间的可能反应如下:
①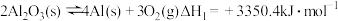
②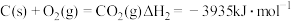
③
④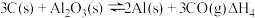 则
则

______  。
。
(3)直接碳热还原氧化铝法除需要高温外,系统中生成的碳化铝、碳氧化铝等会与生成的铝混合在一起,难以分离。实际生产中,至今仍未用直接碳热还原氧化铝法来炼铝。氧化铝碳热还原氯化法炼铝是生产铝的一种可行性新方法,其反应过程如下:
⑤
⑥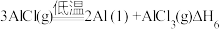
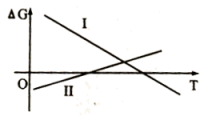
反应⑤、反应⑥中自由能( )与温度(T)的变化关系如图所示,由此判断反应⑤对应图中的曲线
)与温度(T)的变化关系如图所示,由此判断反应⑤对应图中的曲线____ (填“I”或“II”),试分析氧化铝碳热还原氯化法炼铝的可行性:______
(4)在埋炭情况下,碳过剩时,碳的氧化反应主要考虑: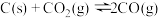 。在实验室研究该反应,一定温度下,向某体积可变的恒压密闭容器(总压强为p总)中加入足量的碳和2 molCO2(g),平衡时体系中气体体积分数与温度的关系如图所示。
。在实验室研究该反应,一定温度下,向某体积可变的恒压密闭容器(总压强为p总)中加入足量的碳和2 molCO2(g),平衡时体系中气体体积分数与温度的关系如图所示。
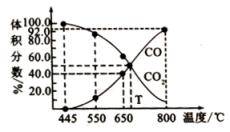
①650℃反应达到平衡时,容器体积为10L,则平衡时c(CO)=___________ 。
②T℃时,若向平衡体系中再充入一定量n(CO):n(CO2)=3:2的混合气体,则平衡___________ (填“向正反应方向”、“向逆反应方向”或“不”)移动。
③800℃时,如图CO的体积分数为92%,用平衡分压代替平衡浓度表示的化学平衡常数Kp=___________ [用含p总的代数式表示,气体分压(p分)=气体总压(p总) 体积分数]。
体积分数]。
(1)将镁片、铝片平行插入一定浓度的NaOH溶液中,用导线连接成闭合回路,如图所示。写出铝电极的电极反应式:

(2)在埋炭实验条件下,不同碳素材料的Al2O3-C耐火材料与铁液之间的可能反应如下:
①
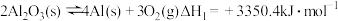
②
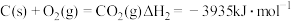
③

④
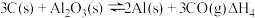 则
则
 。
。(3)直接碳热还原氧化铝法除需要高温外,系统中生成的碳化铝、碳氧化铝等会与生成的铝混合在一起,难以分离。实际生产中,至今仍未用直接碳热还原氧化铝法来炼铝。氧化铝碳热还原氯化法炼铝是生产铝的一种可行性新方法,其反应过程如下:
⑤

⑥
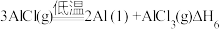
反应⑤、反应⑥中自由能(
 )与温度(T)的变化关系如图所示,由此判断反应⑤对应图中的曲线
)与温度(T)的变化关系如图所示,由此判断反应⑤对应图中的曲线
(4)在埋炭情况下,碳过剩时,碳的氧化反应主要考虑:
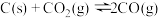 。在实验室研究该反应,一定温度下,向某体积可变的恒压密闭容器(总压强为p总)中加入足量的碳和2 molCO2(g),平衡时体系中气体体积分数与温度的关系如图所示。
。在实验室研究该反应,一定温度下,向某体积可变的恒压密闭容器(总压强为p总)中加入足量的碳和2 molCO2(g),平衡时体系中气体体积分数与温度的关系如图所示。
①650℃反应达到平衡时,容器体积为10L,则平衡时c(CO)=
②T℃时,若向平衡体系中再充入一定量n(CO):n(CO2)=3:2的混合气体,则平衡
③800℃时,如图CO的体积分数为92%,用平衡分压代替平衡浓度表示的化学平衡常数Kp=
 体积分数]。
体积分数]。
您最近一年使用:0次
解题方法
6 . 石油是宝贵的能源,属于战略资源。 、
、 均是石油裂解的产物。请回答下列问题:
均是石油裂解的产物。请回答下列问题:
(1)石油裂化、裂解为_______ (填“物理”或“化学")变化。
(2)已知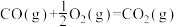
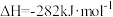
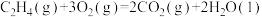
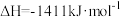
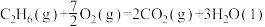
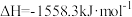
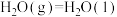
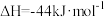
则反应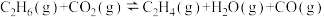

_______  。
。
(3)一定温度下,在某2L恒容密闭容器中充入1mol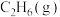 和1mol
和1mol 发生反应
发生反应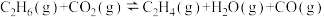 ,10min后达到平衡,容器内压强为起始压强的1.25倍。
,10min后达到平衡,容器内压强为起始压强的1.25倍。
①下列说法可以判定反应到达平衡状态的是_______ 。(填字母序号)
A.
B.相同时间内,断裂2mol 的同时断裂1mol
的同时断裂1mol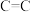
C.容器内气体的密度不再发生变化
D.容器内气体的平均相对分子质量不再发生变化
②0~10min,v(CO)=_______  ,
, 的转化率为
的转化率为_______ %, 的体积分数为
的体积分数为_______ %。
 、
、 均是石油裂解的产物。请回答下列问题:
均是石油裂解的产物。请回答下列问题:(1)石油裂化、裂解为
(2)已知
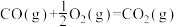
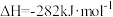
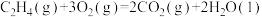
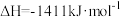
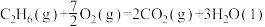
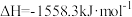
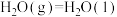
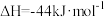
则反应
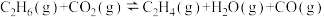

 。
。(3)一定温度下,在某2L恒容密闭容器中充入1mol
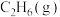 和1mol
和1mol 发生反应
发生反应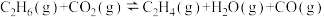 ,10min后达到平衡,容器内压强为起始压强的1.25倍。
,10min后达到平衡,容器内压强为起始压强的1.25倍。①下列说法可以判定反应到达平衡状态的是
A.

B.相同时间内,断裂2mol
 的同时断裂1mol
的同时断裂1mol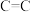
C.容器内气体的密度不再发生变化
D.容器内气体的平均相对分子质量不再发生变化
②0~10min,v(CO)=
 ,
, 的转化率为
的转化率为 的体积分数为
的体积分数为
您最近一年使用:0次
解题方法
7 . (1)研究 、
、 等大气污染气体的处理方法具有重要的意义。
等大气污染气体的处理方法具有重要的意义。
已知:①
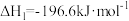
②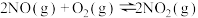
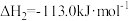
则反应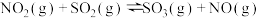 的
的
_______  。
。
(2)t℃时,将2mol 和1mol
和1mol 通入体积为2L的恒温、恒容密闭容器中,发生如下反应:
通入体积为2L的恒温、恒容密闭容器中,发生如下反应: ,2min时反应达到化学平衡,此时测得容器内的压强为起始压强的0.8倍,请回答:
,2min时反应达到化学平衡,此时测得容器内的压强为起始压强的0.8倍,请回答:
①下列叙述能证明该反应已达到化学平衡状态的是_______ (选填字母)。
A.容器内压强不再发生变化
B. 的体积分数不再发生变化
的体积分数不再发生变化
C.容器内气体原子总数不再发生变化
D.相同时间内消耗2nmol 的同时消耗nmol
的同时消耗nmol
E.相同时间内消耗2nmol 的同时生成nmol
的同时生成nmol
F.混合气体密度不再变化
②从反应开始到达化学平衡,生成 的平均反应速率为
的平均反应速率为___ ;平衡时, 的转化率为
的转化率为___ 。
(3)已知 电池可用于心脏起搏器。该电池的电极材料分别为锂和碳,电解液是
电池可用于心脏起搏器。该电池的电极材料分别为锂和碳,电解液是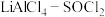 。电池的总反应可表示为
。电池的总反应可表示为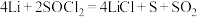 。请回答下列问题:
。请回答下列问题:
①电池的负极材料为_______ ,发生的电极反应为_______ 。
②电池正极发生的电极反应为_______ 。
 、
、 等大气污染气体的处理方法具有重要的意义。
等大气污染气体的处理方法具有重要的意义。已知:①

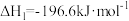
②
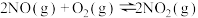
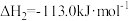
则反应
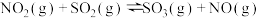 的
的
 。
。(2)t℃时,将2mol
 和1mol
和1mol 通入体积为2L的恒温、恒容密闭容器中,发生如下反应:
通入体积为2L的恒温、恒容密闭容器中,发生如下反应: ,2min时反应达到化学平衡,此时测得容器内的压强为起始压强的0.8倍,请回答:
,2min时反应达到化学平衡,此时测得容器内的压强为起始压强的0.8倍,请回答:①下列叙述能证明该反应已达到化学平衡状态的是
A.容器内压强不再发生变化
B.
 的体积分数不再发生变化
的体积分数不再发生变化C.容器内气体原子总数不再发生变化
D.相同时间内消耗2nmol
 的同时消耗nmol
的同时消耗nmol
E.相同时间内消耗2nmol
 的同时生成nmol
的同时生成nmol
F.混合气体密度不再变化
②从反应开始到达化学平衡,生成
 的平均反应速率为
的平均反应速率为 的转化率为
的转化率为(3)已知
 电池可用于心脏起搏器。该电池的电极材料分别为锂和碳,电解液是
电池可用于心脏起搏器。该电池的电极材料分别为锂和碳,电解液是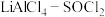 。电池的总反应可表示为
。电池的总反应可表示为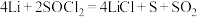 。请回答下列问题:
。请回答下列问题:①电池的负极材料为
②电池正极发生的电极反应为
您最近一年使用:0次
8 . 某温度时,VIA元素单质与H2反应生成气态H2X的热化学方程式如下:
①H2(g)+ O2(g)=H2O(g) ΔH=-242kJ•mol-1
O2(g)=H2O(g) ΔH=-242kJ•mol-1
②H2(g)+S(g)=H2S(g) ΔH=-20kJ•mol-1
③H2(g)+Se(g)⇌H2Se(g) ΔH=+81kJ•mol-1
④H2O(g)=H2O(l) ∆H=-44kJ/mol
请回答:
(1)上述反应中属于放热反应的是_______ (填序号,下同),属于吸热反应的是_______ 。
(2)2gH2完全燃烧生成气态水,放出的热量为_______ 。
(3)请写出O2与H2S反应生成S的热化学方程式_______ 。
(4)根据下图写出热化学方程式_______ 。
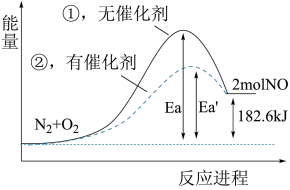
(5)加入催化剂该反应的反应热∆H是否发生了改变_______ (填“是”或“否”)。
(6)请写出H2燃烧热的热化学方程式_______ 。
①H2(g)+
 O2(g)=H2O(g) ΔH=-242kJ•mol-1
O2(g)=H2O(g) ΔH=-242kJ•mol-1②H2(g)+S(g)=H2S(g) ΔH=-20kJ•mol-1
③H2(g)+Se(g)⇌H2Se(g) ΔH=+81kJ•mol-1
④H2O(g)=H2O(l) ∆H=-44kJ/mol
请回答:
(1)上述反应中属于放热反应的是
(2)2gH2完全燃烧生成气态水,放出的热量为
(3)请写出O2与H2S反应生成S的热化学方程式
(4)根据下图写出热化学方程式

(5)加入催化剂该反应的反应热∆H是否发生了改变
(6)请写出H2燃烧热的热化学方程式
您最近一年使用:0次
名校
9 . 按要求书写下列方程式:
(1)制备粗硅的化学方程式___________ 。
(2)碱性锌锰干电池的正极反应式___________ 。
(3)用氢氧化钠溶液处理NO2尾气的化学方程式___________ 。
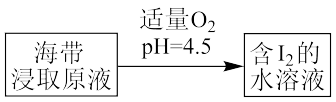
(4)海带提取碘下图所示步骤中反应的离子方程式___________ 。
(5)甲硅烷(SiH4)常温下是无色气体遇空气能自燃,生成二氧化硅和水。已知101kPa 25℃时,测得1g SiH4自燃放出热量44.6kJ/mol。写出其热化学方程式___________ 。
(1)制备粗硅的化学方程式
(2)碱性锌锰干电池的正极反应式
(3)用氢氧化钠溶液处理NO2尾气的化学方程式
(4)海带提取碘下图所示步骤中反应的离子方程式

(5)甲硅烷(SiH4)常温下是无色气体遇空气能自燃,生成二氧化硅和水。已知101kPa 25℃时,测得1g SiH4自燃放出热量44.6kJ/mol。写出其热化学方程式
您最近一年使用:0次
名校
10 . 下列说法正确的是
| A.已知H+(aq)+OH-(aq)=H2O(l)ΔH=-57.3kJ/mol,则1molH2SO4与1molBa(OH)2的反应热ΔH=2×(-57.3)kJ/mol |
| B.已知4P(红磷,s)=P4(白磷,s)ΔH=+17kJ/mol,则白磷比红磷更稳定 |
| C.同温同压下,H2(g)+Cl2(g)=2HCl(g)在光照和点燃条件下的ΔH不同 |
D.一定条件下,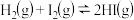 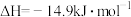 ,则该条件下分解1mol HI吸收的热量为7.45kJ ,则该条件下分解1mol HI吸收的热量为7.45kJ |
您最近一年使用:0次
2021-07-15更新
|
239次组卷
|
2卷引用:黑龙江省鹤岗市第一中学2020-2021学年高一下学期期末考试化学试题



