1 . 选择性催化还原法(SCR)是目前应用最为广泛的氮氧化物NOx的净化方法,其原理是利用NH3在特定催化剂作用下将NOx还原为N2。
主反应:4NH3(g) +4NO(g)+O2(g) 4N2(g)+6H2O(g) ΔH1
4N2(g)+6H2O(g) ΔH1
副反应:4NH3(g)+ 3O2(g) 2N2(g)+6H2O(g) ΔH2
2N2(g)+6H2O(g) ΔH2
(1)在无氧条件下,NH3也可还原NO:4NH3(g)+6NO(g) 5N2(g)+6H2O(g) ΔH3,
5N2(g)+6H2O(g) ΔH3,
则ΔH2=___________ (用含ΔH1、ΔH3的式子表示)。一定温度下,向2 L密闭刚性容器(含催化剂)中投入2 mol NH3和3 mol NO,发生反应4NH3(g)+6NO(g)  5N2(g)+ 6H2O(g)。达到平衡状态时,NO的转化率为60 %,则平衡常数为
5N2(g)+ 6H2O(g)。达到平衡状态时,NO的转化率为60 %,则平衡常数为___________ mol·L-1(列出计算式即可)。
(2)目前使用的SCR催化剂是V2O5-WO3/TiO2,关于该催化剂的说法正确的是___________ 。
A.能加快反应速率,并且改变反应的焓变
B.能增大NH3还原NOx反应的平衡常数
C.具有选择性,能降低特定反应的活化能
(3)催化剂V2O5-WO3/TiO2中的V2O5是活性组分。在石英微型反应器中以一定流速通过烟气[n(O2):n(NH3):n(NO)=71:1:1],在不同温度下进行该催化还原反应,V2O5的质量分数对单位时间内NO去除率的影响如图所示。
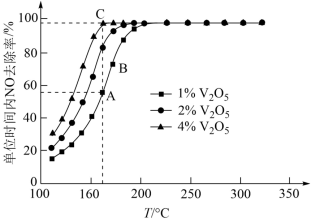
①从起始至对应A、B、C三点的平均反应速率由大到小的顺序为___________ 。
②V2O5的质量分数对该催化剂活性的影响是___________ 。
(4)NO2存在如下平衡:2NO2(g) N2O4(g) △H<0,在一定条件下,NO2与N2O4的消耗速率与各自的分压(分压=总压×物质的量分数)有如下关系:v(NO2)=k1·p2(NO2),v(N2O4)= k2·p(N2O4)。一定温度下,k1、k2与平衡常数kp(压力平衡常数,用平衡分压代替平衡浓度计算)间的关系k1=
N2O4(g) △H<0,在一定条件下,NO2与N2O4的消耗速率与各自的分压(分压=总压×物质的量分数)有如下关系:v(NO2)=k1·p2(NO2),v(N2O4)= k2·p(N2O4)。一定温度下,k1、k2与平衡常数kp(压力平衡常数,用平衡分压代替平衡浓度计算)间的关系k1=_____ 。
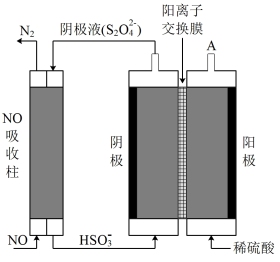
(5)还可用间接电解法除NO。其原理如图所示,则电解池阴极的电极反应为___________ 。
主反应:4NH3(g) +4NO(g)+O2(g)
 4N2(g)+6H2O(g) ΔH1
4N2(g)+6H2O(g) ΔH1副反应:4NH3(g)+ 3O2(g)
 2N2(g)+6H2O(g) ΔH2
2N2(g)+6H2O(g) ΔH2(1)在无氧条件下,NH3也可还原NO:4NH3(g)+6NO(g)
 5N2(g)+6H2O(g) ΔH3,
5N2(g)+6H2O(g) ΔH3,则ΔH2=
 5N2(g)+ 6H2O(g)。达到平衡状态时,NO的转化率为60 %,则平衡常数为
5N2(g)+ 6H2O(g)。达到平衡状态时,NO的转化率为60 %,则平衡常数为(2)目前使用的SCR催化剂是V2O5-WO3/TiO2,关于该催化剂的说法正确的是
A.能加快反应速率,并且改变反应的焓变
B.能增大NH3还原NOx反应的平衡常数
C.具有选择性,能降低特定反应的活化能
(3)催化剂V2O5-WO3/TiO2中的V2O5是活性组分。在石英微型反应器中以一定流速通过烟气[n(O2):n(NH3):n(NO)=71:1:1],在不同温度下进行该催化还原反应,V2O5的质量分数对单位时间内NO去除率的影响如图所示。

①从起始至对应A、B、C三点的平均反应速率由大到小的顺序为
②V2O5的质量分数对该催化剂活性的影响是
(4)NO2存在如下平衡:2NO2(g)
 N2O4(g) △H<0,在一定条件下,NO2与N2O4的消耗速率与各自的分压(分压=总压×物质的量分数)有如下关系:v(NO2)=k1·p2(NO2),v(N2O4)= k2·p(N2O4)。一定温度下,k1、k2与平衡常数kp(压力平衡常数,用平衡分压代替平衡浓度计算)间的关系k1=
N2O4(g) △H<0,在一定条件下,NO2与N2O4的消耗速率与各自的分压(分压=总压×物质的量分数)有如下关系:v(NO2)=k1·p2(NO2),v(N2O4)= k2·p(N2O4)。一定温度下,k1、k2与平衡常数kp(压力平衡常数,用平衡分压代替平衡浓度计算)间的关系k1=(5)还可用间接电解法除NO。其原理如图所示,则电解池阴极的电极反应为

您最近一年使用:0次
名校
解题方法
2 . 化学反应伴随能量变化,获取反应能量变化有多条途径。
Ⅰ.(1)下列反应中,属于吸热反应的是___________ 。
A.C和CO2高温下反应 B.甲烷的燃烧反应
C.Ba(OH)2·8H2O与氯化铵反应 D.锌与盐酸反应
(2)获取能量变化的途径
①通过化学键的键能计算。已知:
计算可得:H2(g)+Cl2(g)=2HCl(g) △H=___________ kJ·mol-1。
②通过盖斯定律可计算。已知在25 ℃、101 kPa时:
I.2Na(s)+ O2(g)=Na2O(s) △H=—414 kJ·mol-1
O2(g)=Na2O(s) △H=—414 kJ·mol-1
II.2Na(s)+O2(g)=Na2O2(s) △H=—511 kJ·mol-1
写出Na2O2与Na反应生成Na2O的热化学方程式:___________ 。
(3)以CO2(g)和H2(g)为原料合成甲醇,反应的能量变化如图所示。
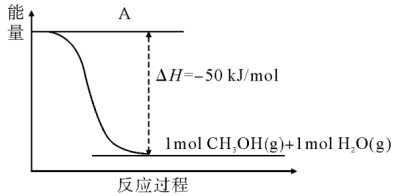
①补全图:图中A处应填入___________ 。
②该反应需要加入铜—锌基催化剂。加入催化剂后,该反应的△H___________ (填“增大”、“减小”或者“不变”);若上述反应中产物为液态水,则该反应的△H___________ (填“变大”、“变小”或者“不变”)。
II.某同学设计一个燃料电池(如图所示),目的是探究氯碱工业原理和粗铜的精炼原理,根据要求回答相关问题:
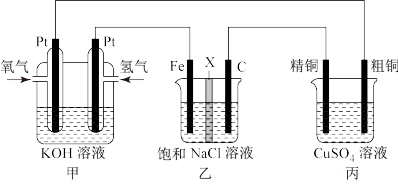
(1)若在标准状况下,甲装置有448 mL氧气参加反应,则乙装置中铁电极上生成的气体在标准状况下体积为___________ 。
(2)若用隔膜法电解饱和食盐水生成NaClO,则X应用___________ 交换膜(填“阳离子”或“阴离子”)。
(3)如果粗铜中含有锌、银等杂质,丙装置中反应一段时间,硫酸铜溶液浓度将___________ (填 “增大”、“减小”或者“不变”)。
Ⅰ.(1)下列反应中,属于吸热反应的是
A.C和CO2高温下反应 B.甲烷的燃烧反应
C.Ba(OH)2·8H2O与氯化铵反应 D.锌与盐酸反应
(2)获取能量变化的途径
①通过化学键的键能计算。已知:
| 化学键种类 | H—H | Cl—Cl | H—Cl |
| 键能(kJ/mol) | 436 | 247 | 434 |
计算可得:H2(g)+Cl2(g)=2HCl(g) △H=
②通过盖斯定律可计算。已知在25 ℃、101 kPa时:
I.2Na(s)+
 O2(g)=Na2O(s) △H=—414 kJ·mol-1
O2(g)=Na2O(s) △H=—414 kJ·mol-1II.2Na(s)+O2(g)=Na2O2(s) △H=—511 kJ·mol-1
写出Na2O2与Na反应生成Na2O的热化学方程式:
(3)以CO2(g)和H2(g)为原料合成甲醇,反应的能量变化如图所示。

①补全图:图中A处应填入
②该反应需要加入铜—锌基催化剂。加入催化剂后,该反应的△H
II.某同学设计一个燃料电池(如图所示),目的是探究氯碱工业原理和粗铜的精炼原理,根据要求回答相关问题:

(1)若在标准状况下,甲装置有448 mL氧气参加反应,则乙装置中铁电极上生成的气体在标准状况下体积为
(2)若用隔膜法电解饱和食盐水生成NaClO,则X应用
(3)如果粗铜中含有锌、银等杂质,丙装置中反应一段时间,硫酸铜溶液浓度将
您最近一年使用:0次
名校
3 . 下列说法正确的是
| A.当反应体系放热时其焓减小,ΔH为负值 |
| B.化学键断裂的能量是化学变化中能量变化的主要原因 |
| C.一个化学反应,不管是一步完成的还是分几步完成的,其反应热是不相同的 |
| D.苛性钠固体溶于水属于放热反应 |
您最近一年使用:0次
2021-07-07更新
|
232次组卷
|
3卷引用:黑龙江省大庆市铁人中学2020-2021学年高一下学期期末考试化学试题
4 . 下列与化学反应能量变化相关的叙述中,正确的是
| A.热化学方程式的ΔH大小与化学计量数无关 |
| B.利用盖斯定律,可计算某些难以直接测量的反应焓变 |
| C.H2(g)的燃烧热ΔH=-285.8kJ·mol-1,则反应2H2O(g)=2H2(g)+O2(g)的反应热ΔH=+571.6kJ·mol-1 |
| D.测定中和反应反应热的时候,测量盐酸和NaOH混合溶液刚开始的温度,记为反应前体系的温度 |
您最近一年使用:0次
名校
解题方法
5 . (1)①已知:
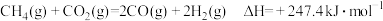
则 与
与 反应生成
反应生成 和
和 的热化学方程式为
的热化学方程式为_______ 。
(2)一定条件下,在水溶液中所含离子 、
、 、
、 、
、 、
、 各
各 ,其相对能量的大小如下图所示(各离子在图中用氯元素的相应化合价表示),则反应
,其相对能量的大小如下图所示(各离子在图中用氯元素的相应化合价表示),则反应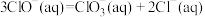 的
的
_______  。
。
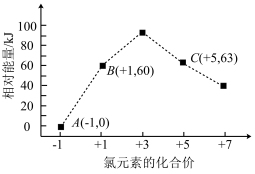
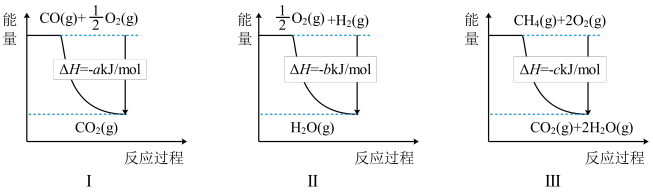
(3)工业上可通过天然气跟水蒸气反应制取 :
: ,有关反应的能量变化如下图所示,则该反应的
,有关反应的能量变化如下图所示,则该反应的
_______  (用含
(用含 、
、 、c的式子表示)。
、c的式子表示)。

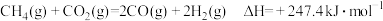
则
 与
与 反应生成
反应生成 和
和 的热化学方程式为
的热化学方程式为(2)一定条件下,在水溶液中所含离子
 、
、 、
、 、
、 、
、 各
各 ,其相对能量的大小如下图所示(各离子在图中用氯元素的相应化合价表示),则反应
,其相对能量的大小如下图所示(各离子在图中用氯元素的相应化合价表示),则反应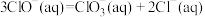 的
的
 。
。
(3)工业上可通过天然气跟水蒸气反应制取
 :
: ,有关反应的能量变化如下图所示,则该反应的
,有关反应的能量变化如下图所示,则该反应的
 (用含
(用含 、
、 、c的式子表示)。
、c的式子表示)。
您最近一年使用:0次
解题方法
6 .  、
、 、
、 等是对环境影响较大的几种气体,对它们的合理控制和治理是优化我们生存环境的有效途径。
等是对环境影响较大的几种气体,对它们的合理控制和治理是优化我们生存环境的有效途径。
(1)二甲醚( )被誉为“21世纪的清洁燃料”,由
)被誉为“21世纪的清洁燃料”,由 和
和 制备二甲醚的反应原理如下:
制备二甲醚的反应原理如下:
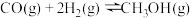

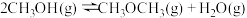
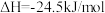
已知: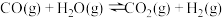
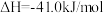
则 的
的
_______ 。
(2)200℃,在2L的密闭容器中充入
 和
和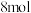
 ,发生反应
,发生反应 (I);
(I); (II),
(II), 达到平衡,平衡时
达到平衡,平衡时 的转化率为80%,且
的转化率为80%,且 ,则:
,则:
① 内,反应(Ⅰ)平均反应速率
内,反应(Ⅰ)平均反应速率
_______ 。
②反应(Ⅱ)中 的转化率
的转化率
_______ 。
(3)利用电化学原理将 、
、 转化为重要化工原料,装置如图所示:
转化为重要化工原料,装置如图所示:

①若A为 ,B为
,B为 ,C为
,C为 ,则通入
,则通入 一极的电极反应式为
一极的电极反应式为_______ 。
②若A为 ,B为
,B为 ,C为
,C为 ,则负极的电极反应式为
,则负极的电极反应式为_______ 。
 、
、 、
、 等是对环境影响较大的几种气体,对它们的合理控制和治理是优化我们生存环境的有效途径。
等是对环境影响较大的几种气体,对它们的合理控制和治理是优化我们生存环境的有效途径。(1)二甲醚(
 )被誉为“21世纪的清洁燃料”,由
)被誉为“21世纪的清洁燃料”,由 和
和 制备二甲醚的反应原理如下:
制备二甲醚的反应原理如下: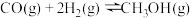

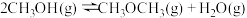
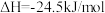
已知:
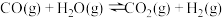
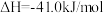
则
 的
的
(2)200℃,在2L的密闭容器中充入

 和
和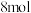
 ,发生反应
,发生反应 (I);
(I); (II),
(II), 达到平衡,平衡时
达到平衡,平衡时 的转化率为80%,且
的转化率为80%,且 ,则:
,则:①
 内,反应(Ⅰ)平均反应速率
内,反应(Ⅰ)平均反应速率
②反应(Ⅱ)中
 的转化率
的转化率
(3)利用电化学原理将
 、
、 转化为重要化工原料,装置如图所示:
转化为重要化工原料,装置如图所示:
①若A为
 ,B为
,B为 ,C为
,C为 ,则通入
,则通入 一极的电极反应式为
一极的电极反应式为②若A为
 ,B为
,B为 ,C为
,C为 ,则负极的电极反应式为
,则负极的电极反应式为
您最近一年使用:0次
解题方法
7 . 消除氮氧化物污染对优化环境至关重要。
(1)用 催化还原
催化还原 消除氮氧化物污染的变化如下:
消除氮氧化物污染的变化如下:
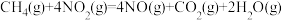
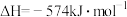

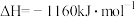
若用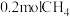 还原
还原 至
至 ,整个过程中放出的热量为
,整个过程中放出的热量为___________ kJ。(假设水全部以气态形成存在)
(2)活性炭(C)可处理大气污染物NO。在2L密闭容器中加入NO和活性炭(无杂质),生成气体E和F,当温度分别在 和
和 时,测得各物质平衡时物质的量如下表:
时,测得各物质平衡时物质的量如下表:
①根据上表数据,可推测NO与活性炭反应的化学方程式为___________ 。
②如果已知 ,则该反应正反应的
,则该反应正反应的
___________ 0(填“>”、“<”或“=”)。
③在 温度下反应达到平衡后,下列措施能增大NO的转化率的是
温度下反应达到平衡后,下列措施能增大NO的转化率的是___________ 。
a.降低温度 b.增大压强 c.增大 d.移去部分F
d.移去部分F
(3)汽车尾气处理中的反应有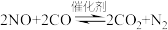 。某温度时,在1L密闭容器中充入0.1mol CO和0.1mol NO,5s时反应达到平衡,测得NO的浓度为0.02mol/L,则反应开始至平衡时,NO的平均反应速率
。某温度时,在1L密闭容器中充入0.1mol CO和0.1mol NO,5s时反应达到平衡,测得NO的浓度为0.02mol/L,则反应开始至平衡时,NO的平均反应速率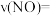
___________ 。此平衡体系中,CO、NO、 、
、 的物质的量比为
的物质的量比为___________ 。
(1)用
 催化还原
催化还原 消除氮氧化物污染的变化如下:
消除氮氧化物污染的变化如下: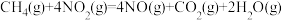
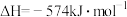

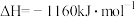
若用
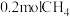 还原
还原 至
至 ,整个过程中放出的热量为
,整个过程中放出的热量为(2)活性炭(C)可处理大气污染物NO。在2L密闭容器中加入NO和活性炭(无杂质),生成气体E和F,当温度分别在
 和
和 时,测得各物质平衡时物质的量如下表:
时,测得各物质平衡时物质的量如下表:| 物质 n/mol T/℃ | 活性炭 | NO | E | F |
| 初始 | 2.030 | 0.100 | 0 | 0 |
 | 2.000 | 0.040 | 0.030 | 0.030 |
 | 2.005 | 0.050 | 0.025 | 0.025 |
②如果已知
 ,则该反应正反应的
,则该反应正反应的
③在
 温度下反应达到平衡后,下列措施能增大NO的转化率的是
温度下反应达到平衡后,下列措施能增大NO的转化率的是a.降低温度 b.增大压强 c.增大
 d.移去部分F
d.移去部分F(3)汽车尾气处理中的反应有
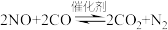 。某温度时,在1L密闭容器中充入0.1mol CO和0.1mol NO,5s时反应达到平衡,测得NO的浓度为0.02mol/L,则反应开始至平衡时,NO的平均反应速率
。某温度时,在1L密闭容器中充入0.1mol CO和0.1mol NO,5s时反应达到平衡,测得NO的浓度为0.02mol/L,则反应开始至平衡时,NO的平均反应速率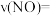
 、
、 的物质的量比为
的物质的量比为
您最近一年使用:0次
8 . I.(1)如图是化学反应中物质变化和能量变化的示意图。
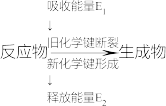
在锌与稀盐酸的反应中,E1______ E2(填“>”或“<”或“=”)
(2)工业上利用 和
和 比在催化剂作用下合成甲醇:
比在催化剂作用下合成甲醇: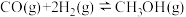 ,已知反应中有关物质的化学键键能数据如下表所示:
,已知反应中有关物质的化学键键能数据如下表所示:
则 生成
生成
 放出
放出______  热量。
热量。
(3)化学兴趣小组进行测定中和热的实验,装置如图,步骤如下。
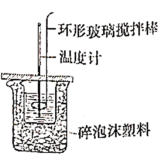
a.用量筒量取
 盐酸倒入如图装置的小烧杯中,测出盐酸温度。
盐酸倒入如图装置的小烧杯中,测出盐酸温度。
b.用另一量筒量取

 溶液,并用另一温度计测出其温度。
溶液,并用另一温度计测出其温度。
c.将 溶液倒入小烧杯中,使之混合均匀,测得混合液最高温度。
溶液倒入小烧杯中,使之混合均匀,测得混合液最高温度。
①实验中,倒入 溶液的正确操作是
溶液的正确操作是_______ 。
A.一次性快速倒入 B.分3次倒入 C.边搅拌边慢慢倒入
②若将各含 溶质的
溶质的 稀溶液、
稀溶液、 稀溶液、稀氨水,分别与足量的稀盐酸反应,放出的热量分别为Q1、Q2、Q3,则Q1、Q2、Q3的关系为
稀溶液、稀氨水,分别与足量的稀盐酸反应,放出的热量分别为Q1、Q2、Q3,则Q1、Q2、Q3的关系为______ 。
II.甲烷燃料电池。已知电池的总反应为 ,
,
①负极的电极反应式为_______ 。
②当消耗甲烷11.2L(标准状况下时),则导线中转移的电子的物质的量为______ mol。

在锌与稀盐酸的反应中,E1
(2)工业上利用
 和
和 比在催化剂作用下合成甲醇:
比在催化剂作用下合成甲醇: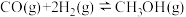 ,已知反应中有关物质的化学键键能数据如下表所示:
,已知反应中有关物质的化学键键能数据如下表所示:| 化学键 |  |  |  |  |  |
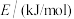 | 436 | 343 | 1076 | 465 | 413 |
则
 生成
生成
 放出
放出 热量。
热量。(3)化学兴趣小组进行测定中和热的实验,装置如图,步骤如下。

a.用量筒量取

 盐酸倒入如图装置的小烧杯中,测出盐酸温度。
盐酸倒入如图装置的小烧杯中,测出盐酸温度。b.用另一量筒量取


 溶液,并用另一温度计测出其温度。
溶液,并用另一温度计测出其温度。c.将
 溶液倒入小烧杯中,使之混合均匀,测得混合液最高温度。
溶液倒入小烧杯中,使之混合均匀,测得混合液最高温度。①实验中,倒入
 溶液的正确操作是
溶液的正确操作是A.一次性快速倒入 B.分3次倒入 C.边搅拌边慢慢倒入
②若将各含
 溶质的
溶质的 稀溶液、
稀溶液、 稀溶液、稀氨水,分别与足量的稀盐酸反应,放出的热量分别为Q1、Q2、Q3,则Q1、Q2、Q3的关系为
稀溶液、稀氨水,分别与足量的稀盐酸反应,放出的热量分别为Q1、Q2、Q3,则Q1、Q2、Q3的关系为II.甲烷燃料电池。已知电池的总反应为
 ,
,①负极的电极反应式为
②当消耗甲烷11.2L(标准状况下时),则导线中转移的电子的物质的量为
您最近一年使用:0次
解题方法
9 . (1)已知0.5mol的液态甲醇(CH3OH)在空气中完全燃烧生成CO2气体和液态水时放出350kJ的热量,则表示甲醇燃烧热的热化学方程式为___________ 。
(2)已知:①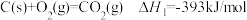
②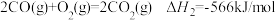
③
则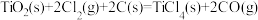 的
的
___________ 。
(3)燃料电池是一种具有应用前景的绿色电源。下图为燃料电池的结构示意图,电解质溶液为NaOH溶液,电极材料为疏松多孔的石墨棒。请回答下列问题:
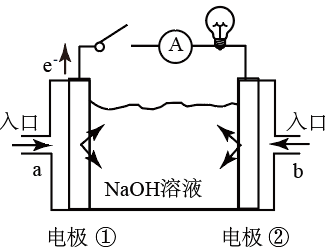
若该燃料电池为氢氧燃料电池。
①a极通入的物质为___________ (填物质名称),电解质溶液中的 移向
移向___________ 极(填“负”或“正”)。
②写出此氢氧燃料电池工作时,负极的电极反应式:___________ 。
若该燃料电池为甲烷燃料电池。已知电池的总反应为:
③下列有关说法正确的是___________ (填字母代号)。
A.燃料电池将电能转变为化学能
B.负极的电极反应式为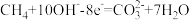
C.正极的电极反应式为
D.通入甲烷的电极发生还原反应
(2)已知:①
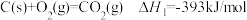
②
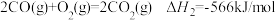
③

则
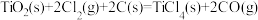 的
的
(3)燃料电池是一种具有应用前景的绿色电源。下图为燃料电池的结构示意图,电解质溶液为NaOH溶液,电极材料为疏松多孔的石墨棒。请回答下列问题:

若该燃料电池为氢氧燃料电池。
①a极通入的物质为
 移向
移向②写出此氢氧燃料电池工作时,负极的电极反应式:
若该燃料电池为甲烷燃料电池。已知电池的总反应为:

③下列有关说法正确的是
A.燃料电池将电能转变为化学能
B.负极的电极反应式为
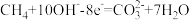
C.正极的电极反应式为

D.通入甲烷的电极发生还原反应
您最近一年使用:0次
10 . 氢能是一种极具发展潜力的清洁能源。以太阳能为热源,热化学硫碘循环分解水是一种高效、无污染的制氢方法。其反应过程如图所示:
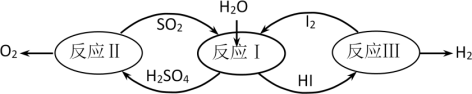
(1)反应Ⅰ的化学方程式是___ 。
(2)反应Ⅱ:2H2SO4(l)=2SO2(g)+O2(g)+2H2O(g) △H=+550kJ•mol-1。该反应自发进行的条件是__ (填“高温”、“低温”或“任意温度”),理由是__ 。
反应Ⅱ由两步反应组成:i.H2SO4(l)=SO3(g)+H2O(g) △H=+177kJ•mol-1
ii.SO3(g)分解。则SO3(g)分解的热化学方程式为___ 。
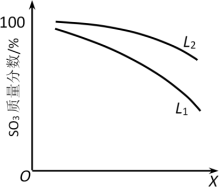
(3)L(L1、L2)、X可分别代表压强或温度。如图表示L一定时,ii中SO3(g)的平衡转化率随X的变化关系。
①X代表的物理量是___ 。
②判断L1、L2的大小关系,L1___ L2,并简述理由:___ 。
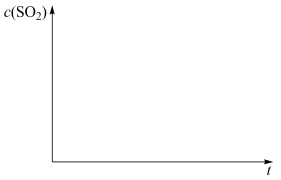
(4)煤炭燃烧过程中会释放出大量的SO2,严重破坏生态环境。采用一定的脱硫技术可以把硫元素以CaSO4的形式固定,从而降低SO2的排放。但是煤炭燃烧过程中产生的CO又会与CaSO4发生化学反应,降低脱硫效率。相关反应的热化学方程式如下:
CaSO4(s)+CO(g) CaO(s)+SO2(g)+CO2(g) △H1=218.4kJ•mol-1(反应Ⅰ)
CaO(s)+SO2(g)+CO2(g) △H1=218.4kJ•mol-1(反应Ⅰ)
CaSO4(s)+4CO(g) CaS(s)+4CO2(g) △H2=-175.6kJ•mol-1(反应Ⅱ)
CaS(s)+4CO2(g) △H2=-175.6kJ•mol-1(反应Ⅱ)
恒温恒容条件下,假设反应Ⅰ和Ⅱ同时发生,且v1>v2,请画出反应体系中c(SO2)随时间 变化的总趋势图
变化的总趋势图___ 。
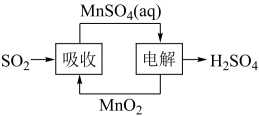
(5)工业生产中产生的SO2废气也可用如图方法获得H2SO4。写出电解的阳极反应式___ 。

(1)反应Ⅰ的化学方程式是
(2)反应Ⅱ:2H2SO4(l)=2SO2(g)+O2(g)+2H2O(g) △H=+550kJ•mol-1。该反应自发进行的条件是
反应Ⅱ由两步反应组成:i.H2SO4(l)=SO3(g)+H2O(g) △H=+177kJ•mol-1
ii.SO3(g)分解。则SO3(g)分解的热化学方程式为
(3)L(L1、L2)、X可分别代表压强或温度。如图表示L一定时,ii中SO3(g)的平衡转化率随X的变化关系。
①X代表的物理量是
②判断L1、L2的大小关系,L1

(4)煤炭燃烧过程中会释放出大量的SO2,严重破坏生态环境。采用一定的脱硫技术可以把硫元素以CaSO4的形式固定,从而降低SO2的排放。但是煤炭燃烧过程中产生的CO又会与CaSO4发生化学反应,降低脱硫效率。相关反应的热化学方程式如下:
CaSO4(s)+CO(g)
 CaO(s)+SO2(g)+CO2(g) △H1=218.4kJ•mol-1(反应Ⅰ)
CaO(s)+SO2(g)+CO2(g) △H1=218.4kJ•mol-1(反应Ⅰ)CaSO4(s)+4CO(g)
 CaS(s)+4CO2(g) △H2=-175.6kJ•mol-1(反应Ⅱ)
CaS(s)+4CO2(g) △H2=-175.6kJ•mol-1(反应Ⅱ)恒温恒容条件下,假设反应Ⅰ和Ⅱ同时发生,且v1>v2,请画出反应体系中c(SO2)随时间
 变化的总趋势图
变化的总趋势图
(5)工业生产中产生的SO2废气也可用如图方法获得H2SO4。写出电解的阳极反应式

您最近一年使用:0次



