名校
1 . 下列内容与结论相对应的是
| 选项 | 内容 | 结论 |
| A |  变成 变成 |  |
| B | 硝酸铵溶于水可自发进行 | 该过程的 |
| C | 一个反应的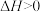 、 、 | 反应一定不能自发进行 |
| D | 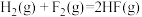 的 的 , ,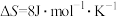 | 反应在任意温度下都不能自发进行 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
2020-09-16更新
|
718次组卷
|
17卷引用:湖北省武汉市新洲区城关高级中学2020-2021学年高二下学期开学收心考试化学试题
湖北省武汉市新洲区城关高级中学2020-2021学年高二下学期开学收心考试化学试题2019年10月24日《每日一题》2019-2020学年高二化学人教选修4——化学反应方向的判断鲁科版(2019)选择性必修1 第2章 化学反应的方向、限度与速率 第1节 化学反应的方向人教版(2019)高二选择性必修第一册 第二章 化学反应速率与化学平衡 第三节 化学反应的方向 教材帮安徽省合肥市第九中学2020-2021学年高二上学期第一次月考化学试题鲁科版(2019)高二选择性必修第一册第2章 化学反应的方向、限度与速率 第1节 化学反应的方向人教版(2019)高二化学选择性必修1第二章 化学反应速率与化学平衡 第三节 化学反应的方向河北省沧州市任丘市第一中学2020-2021学年高二上学期第一次阶段考试化学试题黑龙江省大庆市大庆中学2021届高三上学期期中考试化学试题(已下线)专题2.3 化学反应的方向(备作业)-【上好课】2021-2022学年高二化学同步备课系列(人教版2019选择性必修1)内蒙古赤峰市第二中学2021-2022学年高二上学期第一次月考化学试题江西省宜春中学2021-2022学年高二上学期第一次月考化学试题内蒙古自治区赤峰学院附属中学2020-2021学年高二下学期期中考试化学试题(已下线)化学反应速率与化学平衡——课时6化学反应的方向作业(十) 化学反应的方向(已下线)专题06 化学反应的方向及调控【考点清单】(讲+练)-2023-2024学年高二化学期中考点大串讲(人教版2019选择性必修1)广东省广州市第八十九中学2023-2024学年高二上学期10月月考化学试题
名校
2 . 下列说法正确的是
| A.常温下反应C(s)+CO2 (g)⇌2CO(g)不能自发进行,则该反应△H>0 |
| B.自发反应的熵一定增大,非自发反应的熵一定减小 |
| C.凡是放热反应都是自发的,凡是吸热反应都是非自发的 |
| D.反应2Mg(s)+CO2 (g)⇌C(s)+2MgO(s)能自发进行,则该反应△H>0 |
您最近一年使用:0次
2020-04-16更新
|
208次组卷
|
13卷引用:湖北省武汉市东湖中学2023-2024学年高二上学期期中考试化学试题
湖北省武汉市东湖中学2023-2024学年高二上学期期中考试化学试题2014-2015陕西省西安市一中高二上学期期末化学试卷陕西省西安市第一中学2015-2016学年高二上12月月考化学试卷山西省康杰中学2017-2018学年高二上学期期中考试化学试题河南省实验中学2019-2020学年高二10月月考化学试题安徽省天长市炳辉中学2019-2020学年高二上学期第二次月考化学试题黑龙江省宾县一中2019-2020学年高二上学期第二次月考化学试题湖北省鄂州市2019-2020学年高二上学期期末考试化学试题内蒙古包头市第六中学2019-2020学年高二上学期期中考试化学试题四川省武胜烈面中学校2019-2020学年高二下学期开学考试化学试题(已下线)2.3 化学反应的方向(练习)-2020-2021学年上学期高二化学同步精品课堂(新教材人教版选择性必修1)湖南省常德市二中2020-2021学年高二上学期期中考试化学试题广东省佛山市顺德区容山中学2022-2023学年高二上学期期中测试化学试题
3 . 下列关于判断过程的方向的说法正确的是( )
| A.所有自发进行的化学反应都是放热反应 |
| B.高温高压下可以使石墨转化为金刚石是自发的化学反应 |
| C.由能量判据和熵判据组合而成的复合判据,将更适合于所有的过程 |
| D.同一物质的固、液、气三种状态的熵值相同 |
您最近一年使用:0次
2019-11-05更新
|
374次组卷
|
23卷引用:湖北省武汉2017-2018学年高二化学上学期期末考试题
湖北省武汉2017-2018学年高二化学上学期期末考试题(已下线)2011-2012学年山东省宁阳四中高二上学期期中学分认定化学试卷(已下线)2011-2012学年山东省潍坊市高二寒假作业化学(二)试卷(已下线)2012-2013学年河北省石家庄市高一下学期期末考试化学试卷(已下线)2012-2013学年辽宁省沈阳铁路实验中学高一下学期期末考试化学试卷(已下线)2014年高中化学苏教版选修四专题2 反应速率与化学平衡练习卷2015-2016学年四川省新津中学高二上学期12月月考化学试卷2016-2017学年四川省资阳市高二上学期期末化学试卷(已下线)2.4 化学反应进行的方向河北省定州市第二中学2017-2018学年高二上学期第一次月考化学试题高中化学人教版 选修四 第二章 化学反应速率和化学平衡 第四节 化学反应进行的方向 化学反应进行的方向吉林省辽源市田家炳高级中学等五校2017-2018学年高二上学期期末联考化学试题四川省成都外国语学校2018-2019学年高二上学期半期考试化学试题河南省永城市实验高级中学2018-2019学年高二上学期期中考试化学试题黑龙江省齐齐哈尔市第八中学2019-2020学年高二9月月考化学试题山西省应县第一中学校2019-2020学年高二上学期期中考试化学试题山东省泰安市泰山国际学校2019-2020学年高二上学期第一次月考化学试题湖南省常德市石门县第二中学2019-2020学年高二上学期第二次月考化学试题湖南省娄底市第一中学2020-2021学年高二上学期9月月考化学试题安徽省六安市裕安区新安中学2020-2021学年高二上学期期中考试化学试题云南省凤庆县第一中学2021-2022学年高二下学期3月份考试化学试题陕西省西安市雁塔区第二中学2021-2022学年高二上学期第一次月考化学试题四川省广安市育才学校2022-2023学年高二上学期11月期中考试化学试题
4 . 下列说法不正确的是
| A.ΔH>0、ΔS>0的反应在任何温度下都不能自发进行 |
| B.反应NH4HCO3(s)===NH3(g)+H2O(g)+CO2(g)ΔH=+185.57 kJ·mol-1 之所以能自发进行,原因是体系有自发地向混乱度增加的方向转变的倾向 |
| C.因为焓变和熵变都与反应的自发性有关,因此焓变或熵变均不能单独作为反应自发性的判据 |
| D.在其他外界条件不变的情况下,使用催化剂,可以改变化学反应进行的速率 |
您最近一年使用:0次
2019-01-30更新
|
112次组卷
|
2卷引用:2014-2015湖北省武汉市部分重点中学高二下学期期中考试化学试卷
名校
5 . 在不同浓度(c)、不同温度(T)下,某物质发生分解的瞬时反应速率如下表所示:
下列推断正确的是
| c/mol·L-1 v/mol·L-1·s-1 T/K | 1.00 | 0.08 | 0.06 | 0.04 |
| 273.15 | 3.00 | 2.40 | 1.80 | 1.20 |
| 298.15 | 6.00 | 5.00 | 4.00 | 3.00 |
| T3 | 5.40 | 5.04 | 4.68 | 4.32 |
| A.T3<273.15 |
| B.同时改变起始浓度和温度,瞬时速率可能相等 |
| C.该物质最适宜的分解条件是,温度为298.15 K,起始浓度为 1.0 mol·L-1 |
| D.该分解反应一定是熵增、焓增反应 |
您最近一年使用:0次
2018-12-06更新
|
152次组卷
|
2卷引用:【全国百强校】湖北省武汉市华中师范大学第一附属中学2018-2019学年高二上学期期中检测化学试题
真题
名校
6 . 下列说法正确的是
| A.氢氧燃料电池放电时化学能全部转化为电能 |
| B.反应4Fe(s)+3O2(g)=2Fe2O3(s)常温下可自发进行,该反应为吸热反应 |
| C.3 mol H2与1 mol N2混合反应生成NH3,转移电子的数目小于6×6.02×1023 |
| D.在酶催化淀粉水解反应中,温度越高淀粉水解速率越快 |
您最近一年使用:0次
2018-06-10更新
|
7345次组卷
|
51卷引用:湖北省武汉市钢城四中2020-2021学年高二上学期期中考试化学试题
湖北省武汉市钢城四中2020-2021学年高二上学期期中考试化学试题2018年全国普通高等学校招生统一考试化学(江苏卷)西藏日喀则市南木林高级中学2017-2018学年高一下学期期末考试化学试题(已下线)2018年高考题及模拟题汇编 专题07 化学反应中的能量变化江苏师范大学附属实验学校2019届高三上学期10月学情调研化学试题(已下线)2019高考备考二轮复习精品资料-专题8 化学反应中与能量变化(教学案)(已下线)2019年高考总复习巅峰冲刺-专题05 化学反应中的能量变化应试策略云南省腾冲市第八中学2018-2019学年高二下学期期中考试化学试题西藏林芝一中2018-2019学年高一下学期期末考试化学试题青海省大通回族土族自治县第一完全中学2018-2019学年高一下学期期中考试化学试题新疆自治区和田地区和田县喀什塔什乡中学2019届高三年级四月调研考试理综化学试题【区级联考】天津市和平区2019届高三下学期三模理科综合化学试题云南省文山壮族苗族自治州马关县第一中学2020届高三上学期9月份考试化学试题云南省开远市实验中学2020届高三上学期开学考试化学试题云南省宾川县三中2020届高三上学期开学考试化学试题云南省大理白族自治州漾濞二中2019—2020学年9月份高三化学考试试题黑龙江省哈尔滨市第六中学2019-2020学年高二10月月考化学试题湖南省娄底市娄星区2019-2020学年高二上学期期中考试化学试题江西省宜春市万载中学2019-2020学年高二上学期期中考试化学试题(衔接班)江苏省苏州市五校2020届高三12月月考化学试题陕西省咸阳市三原县南郊中学2020届高三第五次月考化学试题夯基提能2020届高三化学选择题对题专练——溶解度、质量分数的相关计算贵州省黔东南苗族侗族自治州天柱县第二中学2019-2020学年高三上学期期末考试化学试题天津市海河中学2020届高三第二学期化学测试(二)试卷(已下线)专题九 化学能与热能(真题汇编)-2020年高考二轮模块化复习之《化学基本原理》名师讲案与提分特训河北省唐山遵化市2018-2019学年高二下学期期末考试化学试题山西省忻州市忻州实验中学2019-2020学年高二上学期期始考试化学试题江苏省南通市启东市吕四中学2020届高三第一次质量检测化学试题(已下线)小题必刷08 氧化还原反应的规律及应用——2021年高考化学一轮复习小题必刷(通用版)四川省内江市第六中学2021届高三上学期开学考试(第一次月考)化学试题江苏省扬州市江都区大桥高级中学2021届高三上学期期初调研化学试题湖南省衡阳市第二十六中学2021届高三上学期9月月考化学试题山东省济南第一中学2020-2021学年高二上学期期中考试化学试题福建师范大学第二附属中学2019-2020学年高二上学期期中考试化学(选考)试题重庆市缙云教育联盟2020-2021学年高一下学期期末质量检测化学试题(已下线)考点20 化学能与热能-备战2022年高考化学一轮复习考点帮(全国通用)(已下线)考点20 化学能与热能-备战2022年高考化学一轮复习考点帮(浙江专用)安徽省舒城中学2021-2022学年高二上学期第二次月考化学试题重庆市朝阳中学2021-2022学年高二10月月考化学试题云南省开远市第一中学校2021-2022学年高三下学期开学考试理综化学试题云南省玉溪市民族中学2021-2022年高三下学期适应性考试(七)化学试题云南省景东彝族自治县第一中学2021-2022学年高三下学期3月份考试化学试题云南省曲靖市宣威市第七中学2021-2022学年高三下学期3月考试化学试题云南省瑞丽市第一民族中学2021-2022学年高三下学期3月月考化学试题(已下线)考点17 化学反应的热效应-备战2023年高考化学一轮复习考点帮(全国通用)广东省东莞市第四高级中学2022-2023学年高三8月月考化学试题山东省泰安一中新校2022-2023学年高二上学期10月质量检测化学试题江西省宜春市丰城市东煌学校2022-2023学年高二上学期期中考试化学试卷广东省潮州市潮安区2018-2019学年高一下学期期末考试化学试题浙江省杭州第十四中学2023-2024学年高二上学期 期中考试化学试卷10-2023新东方高二上期中考化学
解题方法
7 . 温度为T1时,在三个容积均为1L的恒容密闭容器中仅发生反应:2NO2(g) 2NO(g)+O2(g)相关数据如下表所示。下列说法错误的是
2NO(g)+O2(g)相关数据如下表所示。下列说法错误的是
 2NO(g)+O2(g)相关数据如下表所示。下列说法错误的是
2NO(g)+O2(g)相关数据如下表所示。下列说法错误的是| 容器 编号 | 物质的起始浓度 (mol·L-1) | 物质的平衡浓度 (mol·L-1) | ||
| c(NO2) | c(NO) | c(O2) | c(O2) | |
| Ⅰ | 0.6 | 0 | 0 | 0.2 |
| Ⅱ | 0.3 | 0.5 | 0.2 | |
| Ⅲ | 0 | 0.5 | 0.35 | |
| A.容器Ⅰ中发生反应的平衡常数为0.8 | B.容器Ⅱ中发生反应的起始阶段有v正>v逆 |
C.达到平衡时,容器Ⅲ中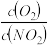 >1 >1 | D.达到平衡时,容器Ⅰ与容器Ⅲ中的总压强之比为16∶17 |
您最近一年使用:0次
2018-05-16更新
|
638次组卷
|
4卷引用:【全国市级联考】湖北省武汉市2018届高中毕业生五月训练题理科综合化学试题
【全国市级联考】湖北省武汉市2018届高中毕业生五月训练题理科综合化学试题(已下线)2018年高考题及模拟题汇编 专题09 反应速率、化学平衡(已下线)高考母题题源07 化学反应速率与化学平衡2020届高三化学二轮冲刺新题专练——化学平衡状态及其判断(提升练)
名校
解题方法
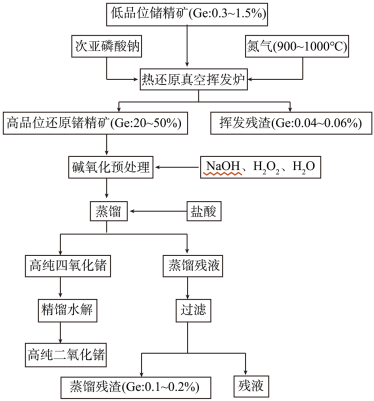
8 . 锗是重要的稀缺战略资源,广泛应用于众多国防军工及民用领域,属于我国战略收储金属。某科研课题采用的提取锗技术路线为:低品位锗精矿-(次亚磷酸钠热还原-真空挥发富集)-挥发产物高品位还原锗精矿-碱氧化预处理-盐酸蒸馏提纯-高纯四氯化锗-高纯二氧化锗。
(1)在周期表中金属与非金属的分界处,可以找到半导体材料,如Si、 等,半导体器件的研制正是开始于 ,后来发展到研制与它同族的 。三种元素依次是_______ (填标号)。
(2)请配平次亚磷酸钠热还原反应的化学方程式并在括号内注明反应条件:
(3)高品位还原锗精矿碱氧化预处理过程的产物是锗酸钠,请写出该过程的化学反应方程式:____________________________________________
(4)高纯二氧化锗含量采用碘酸钾滴定法进行分析。称取3.600g高纯二氧化锗样品,采用氢氧化钠在电炉上溶样,次亚磷酸钠加热还原,然后以淀粉为指示剂,用碘酸钾标准溶液(0.6000mol/L)滴定,消耗的碘酸钾体积为19.00ml。[20℃以下,次亚磷酸钠不会被碘酸钾和碘氧化]
(5)用氢气还原GeO2可制得金属锗。其反应如下:
反应式③ΔH=+13750 kJ/mol ,ΔS=+15600J/(K·mol),则还原反应的温度一般控制在_________ ℃范围内。[已知GeO在700℃会升华,T(K)=t(℃)+273]
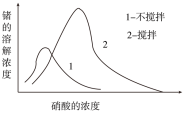
(6)锗在硝酸中的溶解速度受硝酸浓度、搅拌速度、温度等因素影响。如图,锗溶解速度有一最大值,硝酸的浓度小于此值时,随浓度增加溶解速度增加,反之降低,这是由于硝酸浓度高时_________ 加剧所致。
(1)在周期表中金属与非金属的分界处,可以找到半导体材料,如Si、 等,半导体器件的研制正是开始于 ,后来发展到研制与它同族的 。三种元素依次是
a.Ge Si Ge
b.Ge Ge Si
c.C Si Ge
(2)请配平次亚磷酸钠热还原反应的化学方程式并在括号内注明反应条件:
(3)高品位还原锗精矿碱氧化预处理过程的产物是锗酸钠,请写出该过程的化学反应方程式:
(4)高纯二氧化锗含量采用碘酸钾滴定法进行分析。称取3.600g高纯二氧化锗样品,采用氢氧化钠在电炉上溶样,次亚磷酸钠加热还原,然后以淀粉为指示剂,用碘酸钾标准溶液(0.6000mol/L)滴定,消耗的碘酸钾体积为19.00ml。[20℃以下,次亚磷酸钠不会被碘酸钾和碘氧化]
①滴定终点的现象是
②此样品中二氧化锗含量是
(5)用氢气还原GeO2可制得金属锗。其反应如下:
GeO2+ H2= GeO+ H2O ①
GeO+ H2= Ge+ H2O ②
GeO2+ 2H2= Ge+ 2H2O ③
反应式③ΔH=+13750 kJ/mol ,ΔS=+15600J/(K·mol),则还原反应的温度一般控制在
(6)锗在硝酸中的溶解速度受硝酸浓度、搅拌速度、温度等因素影响。如图,锗溶解速度有一最大值,硝酸的浓度小于此值时,随浓度增加溶解速度增加,反之降低,这是由于硝酸浓度高时
您最近一年使用:0次
2018-03-29更新
|
905次组卷
|
2卷引用:湖北省武汉外国语学校2019届高三3月份模拟质量检测理综-化学试题
名校
9 . 某化学反应在较低温度下自发反应,较高温度下非自发进行,有关该反应的下列说法正确的是( )
| A.ΔH > 0,ΔS > 0 | B.ΔH > 0,ΔS < 0 |
| C.ΔH < 0,ΔS > 0 | D.ΔH < 0,ΔS < 0 |
您最近一年使用:0次
2017-11-30更新
|
319次组卷
|
11卷引用:湖北省武汉市武昌区2017_2018学年高二化学上学期期中化学试题
湖北省武汉市武昌区2017_2018学年高二化学上学期期中化学试题2014-2015福建省南安第一中学高二下学期期中考试化学试卷湖南省醴陵二中、醴陵四中2017-2018学年高二上学期期中联考化学试题西藏自治区拉萨中学2017-2018学年高二上学期第二次月考理综化学试题四川省成都树德中学2017-2018学年高二上学期12月月考化学试题【全国百强校】吉林省实验中学2018-2019学年高二上学期期末考试化学试题(已下线)2019年9月25日 《每日一题》选修4—— 化学反应方向的判断广东省中山市第一中学2019-2020学年高二上学期第一次段考化学试题内蒙古翁牛特旗乌丹第一中学2019-2020学年高二10月月考化学试题河南省郑州市高新区一中2019-2020学年高二上学期期中考试化学试题湖南省郴州市湘南中学2019-2020学年高二上学期期中考试化学试题(高考班)
10 . NO是一种性质活泼的大气污染物,它能与很多物质发生反应。
Ⅰ、在2L密闭容器内,800℃时反应:2NO(g)+O2(g) 2NO2 (g)体系中,n(NO)随时间的变化如表:
2NO2 (g)体系中,n(NO)随时间的变化如表:
(1)写出该反应的平衡常数表达式:K=_____ 。已知: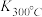 >
>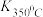 ,则该反应是
,则该反应是___ 热反应。
(2)下图中表示NO2的变化的曲线是___________ 。用O2表示从0-2 s内该反应的平均速率
v =___________ 。
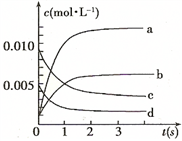
(3)为使该反应的反应速率增大,且平衡向正反应方向移动的是__________ 。
a.及时分离除NO2气体 b.适当升高温度
c.增大O2的浓度 d.选择高效催化剂
Ⅱ、超音速飞机在平流层飞行时,尾气中的NO会破坏臭氧层。科学家正在研究利用催化技术将尾气中的NO和CO转变成CO2和N2,其反应为:2NO+2CO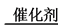 2CO2+N2。为了测定在某种催化剂作用下的反应速率,在某温度下用气体传感器测得不同时间的NO和CO浓度如表:
2CO2+N2。为了测定在某种催化剂作用下的反应速率,在某温度下用气体传感器测得不同时间的NO和CO浓度如表:
请回答下列问题(均不考虑温度变化对催化剂催化效率的影响):
(1)上述条件下反应能够自发进行,则该反应的△H_____ 0(填写“>”、“<”、“=”)。
(2)假设在密闭容器中发生上述反应,达到平衡时下列措施能提高NO转化率的是________ 。
A.选用更有效的催化剂 B.升高反应体系的温度
C.降低反应体系的温度 D.缩小容器的体积
(3)某同学设计了三组实验,实验条件已经填在下面实验设计表中,分析表格我们可以看出该同学的实验目的主要是研究_______________ 和_____________________ 对化学反应速率的影响。
Ⅰ、在2L密闭容器内,800℃时反应:2NO(g)+O2(g)
 2NO2 (g)体系中,n(NO)随时间的变化如表:
2NO2 (g)体系中,n(NO)随时间的变化如表:| 时间(s) | 0 | 1 | 2 | 3 | 4 | 5 |
| n(NO)(mol) | 0.020 | 0.010 | 0.008 | 0.007 | 0.007 | 0.007 |
(1)写出该反应的平衡常数表达式:K=
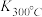 >
>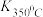 ,则该反应是
,则该反应是(2)下图中表示NO2的变化的曲线是
v =

(3)为使该反应的反应速率增大,且平衡向正反应方向移动的是
a.及时分离除NO2气体 b.适当升高温度
c.增大O2的浓度 d.选择高效催化剂
Ⅱ、超音速飞机在平流层飞行时,尾气中的NO会破坏臭氧层。科学家正在研究利用催化技术将尾气中的NO和CO转变成CO2和N2,其反应为:2NO+2CO
 2CO2+N2。为了测定在某种催化剂作用下的反应速率,在某温度下用气体传感器测得不同时间的NO和CO浓度如表:
2CO2+N2。为了测定在某种催化剂作用下的反应速率,在某温度下用气体传感器测得不同时间的NO和CO浓度如表:| 时间(s) | 0 | 1 | 2 | 3 | 4 | 5 |
| c(NO)(mol/L) | 1.00×10-3 | 4.50×10-4 | 2.50×10-4 | 1.50×10-4 | 1.00×10-4 | 1.00×10-4 |
| c(CO)(mol/L) | 3.60×10-3 | 3.05×10-3 | 2.85×10-3 | 2.75×10-3 | 2.70×10-3 | 2.70×10-3 |
请回答下列问题(均不考虑温度变化对催化剂催化效率的影响):
(1)上述条件下反应能够自发进行,则该反应的△H
(2)假设在密闭容器中发生上述反应,达到平衡时下列措施能提高NO转化率的是
A.选用更有效的催化剂 B.升高反应体系的温度
C.降低反应体系的温度 D.缩小容器的体积
(3)某同学设计了三组实验,实验条件已经填在下面实验设计表中,分析表格我们可以看出该同学的实验目的主要是研究
| 实验编号 | T(℃) | NO初始浓(mol/L) | CO初始浓度(mol/L) | 催化剂的比表面积(m2/g) |
| Ⅰ | 280 | 1.20×10-3 | 5.80×10-3 | 82 |
| Ⅱ | 280 | 1.20×10-3 | 5.80×10-3 | 124 |
| Ⅲ | 350 | 1.20×10-3 | 5.80×10-3 | 124 |
您最近一年使用:0次



