名校
1 . 关节炎首次发作一般在寒冷季节,原因是关节滑液中形成了尿酸钠晶体(NaUr),易诱发关节疼痛,其化学机理是:①HUr(aq)+H2O(1)⇌Ur-(aq)+H3O+(aq) ② Ur-(aq)+Na+(aq)⇌NaUr(s)∆H下列叙述不正确的是
| A.降低温度,反应②平衡正向移动 |
| B.反应②正方向是吸热反应 |
| C.降低关节滑液中HUr及Na+含量是治疗方法之一 |
| D.关节保暖可以缓解疼痛,原理是平衡②逆向移动 |
您最近一年使用:0次
2020-11-26更新
|
349次组卷
|
17卷引用:江苏省启东市2020-2021学年高二上学期期中考试化学试题
江苏省启东市2020-2021学年高二上学期期中考试化学试题江苏省南通市通州区金沙中学2021-2022学年高二上学期第一次调研考试化学试题【市级联考】山东省潍坊市2018-2019学年高二上学期期中考试化学试题山东省博兴县2018-2019学年高二上学期期中考试化学试题山东省济宁市泗水县2019-2020学年高二上学期期中考试化学试题(已下线)【南昌新东方】1. 新建二中 李莹 梁莎江西省南昌市新建区第二中学2020-2021学年高二上学期10月份考试化学试题山东省聊城市茌平区第二中学2020-2021学年高二上学期第二次月考化学试题河北省衡水市武邑武罗学校2020-2021学年高二上学期期中考试化学试题(已下线)2.3.2 温度变化对化学平衡的影响(备作业)-【上好课】2021-2022学年高二化学同步备课系列(苏教版2019选择性必修1)河北省唐山市遵化市2021-2022学年高二上学期期中考试化学试题(已下线)6.2.2 化学平衡(第2课时 化学平衡移动)-【帮课堂】2021-2022学年高一化学同步精品讲义(沪科版2020必修第二册)广东省揭阳华侨高级中学2021-2022学年高二上学期期中考试化学试题云南省蒙自市第一高级中学2022-2023学年高二下学期3月月考化学试题黑龙江省鹤岗市第一中学2022-2023学年高三上学期11月月考化学试题福建省三明第一中学2023-2024学年高二上学期10月月考化学试题(已下线)BBWYhjhx1105.pdf
名校
2 . 某硫酸厂产生的烧渣(主要含 、
、 及少量
及少量 )可用于制备
)可用于制备 和还原铁粉,其流程如图:
和还原铁粉,其流程如图:
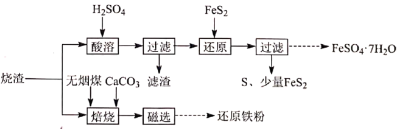
(1)“酸溶”前需粉碎烧渣,其目的是_________ 、________ 。
(2)“滤渣”的主要成分是_________ (填化学式)。
(3)“还原”时, 被氧化为
被氧化为 的离子方程式是
的离子方程式是_________ 。
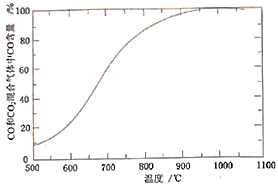
(4)“焙烧”时,烧渣、无烟煤、 的投料质量比为100∶40∶10,温度控制在1000℃(温度对焙烧炉气含量的影响变化如图所示):
的投料质量比为100∶40∶10,温度控制在1000℃(温度对焙烧炉气含量的影响变化如图所示):
添加 的目的是:①脱除
的目的是:①脱除 等;②
等;②_________ 。
(5)“焙烧”在半封闭装置中进行,投料层表面盖有适当厚度的煤层,“焙烧”时间控制在4~4.5小时(焙烧时间对还原铁粉产率的影响如图所示),超过5小时后还原铁粉产率降低的原因是_______ 。

 、
、 及少量
及少量 )可用于制备
)可用于制备 和还原铁粉,其流程如图:
和还原铁粉,其流程如图:
(1)“酸溶”前需粉碎烧渣,其目的是
(2)“滤渣”的主要成分是
(3)“还原”时,
 被氧化为
被氧化为 的离子方程式是
的离子方程式是(4)“焙烧”时,烧渣、无烟煤、
 的投料质量比为100∶40∶10,温度控制在1000℃(温度对焙烧炉气含量的影响变化如图所示):
的投料质量比为100∶40∶10,温度控制在1000℃(温度对焙烧炉气含量的影响变化如图所示):
添加
 的目的是:①脱除
的目的是:①脱除 等;②
等;②(5)“焙烧”在半封闭装置中进行,投料层表面盖有适当厚度的煤层,“焙烧”时间控制在4~4.5小时(焙烧时间对还原铁粉产率的影响如图所示),超过5小时后还原铁粉产率降低的原因是

您最近一年使用:0次
2020-03-14更新
|
269次组卷
|
2卷引用:江苏省扬州市2020届高三上学期期末检测化学试题
10-11高三上·江苏盐城·阶段练习
3 . 天然气中伴随有H2S等合硫化合物,脱硫方法有多种:
(1)一种湿法脱硫是用碳酸钾溶液吸收其中的H2S,同时生成两种酸式盐,该反应的化学方程为___________ 。
(2)一种于法脱硫,其涉及反应:H2(g)+CO(g)+SO2(g) H2O(g)+CO2(g)+S(s)
H2O(g)+CO2(g)+S(s) ,高脱硫率可采取的措施是
,高脱硫率可采取的措施是_____________ 。
a.高压 b.加入催化剂 c.减少CO2的浓度 d.增加CO的浓度 e.分离出硫
(3)用脱硫剂ZDE—01的海绵铁法脱硫,可实现常温脱硫
①脱硫:Fe2O3·H2O(s)+3H2S(g)=Fe2S3·H2O(s)+3H2O(g)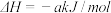
②再生:2Fe2S3·H2O(s)+3O2(g)=2Fe2O3·H2O(s)+6S(s)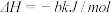
则2H2S(g)+O2(g)=2H2O(g)+2S(s) =
=_______ (用a、b表示)
(4)一种改进的克劳斯法脱硫的工艺,化学反应如下:
H3S+1.5O2=H2O+SO2 SO2+0.5O2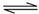 SO3
SO3
SO3(g)+H2O(g)=H2SO4(g) H2SO4(g)+0.17H2O(g) H2SO4(aq)
H2SO4(aq)
该法最终得到的硫酸溶液的质量分数为________ 。
(1)一种湿法脱硫是用碳酸钾溶液吸收其中的H2S,同时生成两种酸式盐,该反应的化学方程为
(2)一种于法脱硫,其涉及反应:H2(g)+CO(g)+SO2(g)
 H2O(g)+CO2(g)+S(s)
H2O(g)+CO2(g)+S(s) ,高脱硫率可采取的措施是
,高脱硫率可采取的措施是a.高压 b.加入催化剂 c.减少CO2的浓度 d.增加CO的浓度 e.分离出硫
(3)用脱硫剂ZDE—01的海绵铁法脱硫,可实现常温脱硫
①脱硫:Fe2O3·H2O(s)+3H2S(g)=Fe2S3·H2O(s)+3H2O(g)
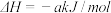
②再生:2Fe2S3·H2O(s)+3O2(g)=2Fe2O3·H2O(s)+6S(s)
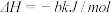
则2H2S(g)+O2(g)=2H2O(g)+2S(s)
 =
=(4)一种改进的克劳斯法脱硫的工艺,化学反应如下:
H3S+1.5O2=H2O+SO2 SO2+0.5O2
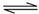 SO3
SO3SO3(g)+H2O(g)=H2SO4(g) H2SO4(g)+0.17H2O(g)
 H2SO4(aq)
H2SO4(aq)该法最终得到的硫酸溶液的质量分数为
您最近一年使用:0次
名校
4 . 可逆反应进行到一定程度会达到化学平衡状态,如K2Cr2O7溶液中存在平衡:Cr2 (橙色)+H2O
(橙色)+H2O 2Cr
2Cr (黄色)+2H+。平衡时各种物质含量保持不变,达到一种相对的静止(如平衡时,每消耗1molH2O同时也会生成1molH2O)。外界条件改变时,平衡状态会被破坏而发生移动(如消耗的水多于生成的水,则平衡向正向移动),平衡移动符合勒夏特列原理,即如果改变可逆反应的条件(如浓度、压强、温度等),化学平衡就被破坏,并向减弱这种改变的方向移动。现在用K2Cr2O7溶液进行下列实验:
(黄色)+2H+。平衡时各种物质含量保持不变,达到一种相对的静止(如平衡时,每消耗1molH2O同时也会生成1molH2O)。外界条件改变时,平衡状态会被破坏而发生移动(如消耗的水多于生成的水,则平衡向正向移动),平衡移动符合勒夏特列原理,即如果改变可逆反应的条件(如浓度、压强、温度等),化学平衡就被破坏,并向减弱这种改变的方向移动。现在用K2Cr2O7溶液进行下列实验:
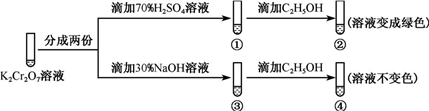
已知:C2H5OH遇到氧化剂容易被氧化。
结合实验,下列说法不正确的是
 (橙色)+H2O
(橙色)+H2O 2Cr
2Cr (黄色)+2H+。平衡时各种物质含量保持不变,达到一种相对的静止(如平衡时,每消耗1molH2O同时也会生成1molH2O)。外界条件改变时,平衡状态会被破坏而发生移动(如消耗的水多于生成的水,则平衡向正向移动),平衡移动符合勒夏特列原理,即如果改变可逆反应的条件(如浓度、压强、温度等),化学平衡就被破坏,并向减弱这种改变的方向移动。现在用K2Cr2O7溶液进行下列实验:
(黄色)+2H+。平衡时各种物质含量保持不变,达到一种相对的静止(如平衡时,每消耗1molH2O同时也会生成1molH2O)。外界条件改变时,平衡状态会被破坏而发生移动(如消耗的水多于生成的水,则平衡向正向移动),平衡移动符合勒夏特列原理,即如果改变可逆反应的条件(如浓度、压强、温度等),化学平衡就被破坏,并向减弱这种改变的方向移动。现在用K2Cr2O7溶液进行下列实验:
已知:C2H5OH遇到氧化剂容易被氧化。
结合实验,下列说法不正确的是
| A.①中溶液橙色加深,③中溶液变黄 | B.②中Cr2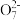 被C2H5OH还原 被C2H5OH还原 |
| C.对比②和④可知K2Cr2O7酸性溶液氧化性弱 | D.若向④中加入70%H2SO4溶液至过量,溶液变为橙色 |
您最近一年使用:0次
2010·江苏盐城·一模
5 . 在一密闭容器中进行如下可逆反应H2(g)+I2(g) 2HI(g),达到平衡时,下列有关说法不正确的是
2HI(g),达到平衡时,下列有关说法不正确的是
 2HI(g),达到平衡时,下列有关说法不正确的是
2HI(g),达到平衡时,下列有关说法不正确的是| A.恒温加压,该化学平衡一定不移动 |
| B.其它条件不变,当加入与初始投入量相同量的氢气和碘蒸气,达到平衡后HI的百分含量增大 |
| C.升温,此化学平衡肯定会发生移动 |
| D.在原平衡基础上,恒容,充入氢气,达到新平衡时逆反应速率也会增大 |
您最近一年使用:0次
11-12高二上·江苏南通·阶段练习
6 . 在450℃并有催化剂存在下,于一容积恒定的密闭容器内进行下列反应:
2SO2(g)+O2(g) 2SO3(g) △H=―190 kJ·mol—1
2SO3(g) △H=―190 kJ·mol—1
⑴该反应500℃时的平衡常数________ 450℃时的平衡常数(填“>”、“<”或“=”)。
⑵判断该反应达到平衡状态的标志是_______________ 。(填字母)
a.SO2和SO3浓度相等 b.SO2百分含量保持不变
c.容器中气体的压强不变 d.v(O2)正=2v(SO3)逆
e.容器中混合气体的密度保持不变
⑶欲提高SO2的转化率,下列措施可行的是_______________ 。(填字母)
a.向装置中再充入N2 b.向装置中再充入O2
c.改变反应的催化剂 d.升高温度
⑷在一个固定容积为5 L的密闭容器中充入0.20 mol SO2和0.10 mol O2,半分钟后达到平衡,测得容器中含SO30.18 mol;若继续通入0.20 mol SO2和0.10 mol O2,则平衡____________ 移动(填“向正反应方向”、“向逆反应方向”或“不”),再次达到平衡后,______ mol<n(SO3)<______ mol。
2SO2(g)+O2(g)
 2SO3(g) △H=―190 kJ·mol—1
2SO3(g) △H=―190 kJ·mol—1⑴该反应500℃时的平衡常数
⑵判断该反应达到平衡状态的标志是
a.SO2和SO3浓度相等 b.SO2百分含量保持不变
c.容器中气体的压强不变 d.v(O2)正=2v(SO3)逆
e.容器中混合气体的密度保持不变
⑶欲提高SO2的转化率,下列措施可行的是
a.向装置中再充入N2 b.向装置中再充入O2
c.改变反应的催化剂 d.升高温度
⑷在一个固定容积为5 L的密闭容器中充入0.20 mol SO2和0.10 mol O2,半分钟后达到平衡,测得容器中含SO30.18 mol;若继续通入0.20 mol SO2和0.10 mol O2,则平衡
您最近一年使用:0次



