名校
解题方法
1 . 下列实验事实不能用勒夏特列原理来解释的是
A.用 与稀硫酸制氢气时,为加快反应速率,将锌片换成锌粉 与稀硫酸制氢气时,为加快反应速率,将锌片换成锌粉 |
B.向 溶液中加入铁粉,溶液颜色变浅 溶液中加入铁粉,溶液颜色变浅 |
C.配制 溶液时将 溶液时将 晶体溶在浓盐酸中再加水稀释到所需浓度 晶体溶在浓盐酸中再加水稀释到所需浓度 |
D.用 溶液清洗油污时,加热可以增强去污效果 溶液清洗油污时,加热可以增强去污效果 |
您最近半年使用:0次
2024-02-26更新
|
108次组卷
|
2卷引用:云南省大理州民族中学2023-2024学年高二下学期见面考化学试题
解题方法
2 . 下列实验方案对应的实验操作、目的或现象均正确的是
| 选项 | 实验方案 | 现象或目的 |
| A. | 在一支试管中先加入2 mL 0.1 mol/L K2Cr2O7溶液,再滴入5~10滴6 mol/L H2SO4溶液 | 溶液橙色变深 |
| B. | 在试管中先加入2 mL 0.1 mol/L Na2CO3溶液,然后加热,利用pH传感器测量溶液pH | 溶液pH不断上升 |
| C. | 在盛有甲苯和苯酚混合溶液的试管中滴加少量酸性KMnO4溶液,溶液褪色 | 甲苯中含有苯酚 |
| D. | 向试管中先加C2H5CH2-X再加入NaOH溶液并加热,最后滴加AgNO3溶液 | 验证X为氯原子 |
| A.A | B.B | C.C | D.D |
您最近半年使用:0次
3 . 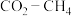 催化重整可获得合成气
催化重整可获得合成气 。重整过程中主要反应的热化学方程式为
。重整过程中主要反应的热化学方程式为
反应①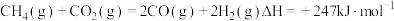
反应②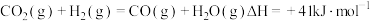
反应③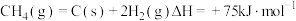
反应④
研究发现在密闭容器中 下,
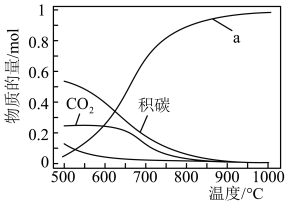
下,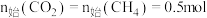 ,平衡时各含碳物种的物质的量随温度的变化如图所示。下列说法正确的是
,平衡时各含碳物种的物质的量随温度的变化如图所示。下列说法正确的是
 催化重整可获得合成气
催化重整可获得合成气 。重整过程中主要反应的热化学方程式为
。重整过程中主要反应的热化学方程式为反应①
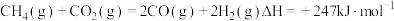
反应②
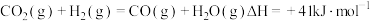
反应③
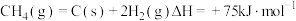
反应④

研究发现在密闭容器中
 下,
下,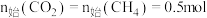 ,平衡时各含碳物种的物质的量随温度的变化如图所示。下列说法正确的是
,平衡时各含碳物种的物质的量随温度的变化如图所示。下列说法正确的是
A.图中a表示 |
B. 的 的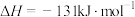 |
C.其他条件不变,在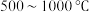 范围,随着温度的升高,平衡时 范围,随着温度的升高,平衡时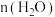 不断增大 不断增大 |
D.当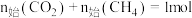 ,其他条件不变时,提高 ,其他条件不变时,提高 的值,能减少平衡时积碳量 的值,能减少平衡时积碳量 |
您最近半年使用:0次
2024-02-13更新
|
1108次组卷
|
4卷引用:江苏省南京市2023-2024学年高二下学期期初学业质量调研化学试卷
江苏省南京市2023-2024学年高二下学期期初学业质量调研化学试卷江苏省南通市2024届高三上学期第一次调研测试(一模)化学试题(已下线)专题05 化学反应与能量-【好题汇编】2024年高考化学一模试题分类汇编(全国通用)山东省潍坊市2024届高高考模拟训练调研化学试题
名校
解题方法
4 . 下列实验中,不能 达到实验目的是
| A | B | C | D |
验证平衡: | 证明 | 测定HCl溶液的浓度 | 由FeCl3溶液制取无水FeCl3固体 |
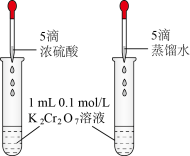 |  |  | 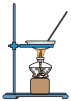 |
| A.A | B.B | C.C | D.D |
您最近半年使用:0次
2024-01-20更新
|
72次组卷
|
2卷引用:安徽省马鞍山市第二中学2023-2024学年高二下学期开学考试化学试题
名校
5 . 下列事实不能用勒夏特列原理(化学平衡移动原理)解释的是
| A.合成氨时,选定温度为400~500℃,而不是常温 |
| B.人体血液的pH稳定在7.4±0.05范围内 |
| C.氯气在水中的溶解度大于在饱和食盐水中的溶解度 |
| D.生活中,可用热的纯碱溶液除油污 |
您最近半年使用:0次
2024-01-18更新
|
78次组卷
|
3卷引用:吉林省四校期初联考2023-2024学年高二下学期开学考试化学试题
名校
6 . 下列事实中,不能 用勒夏特列原理解释的是
① 溶液中加入固体
溶液中加入固体 后颜色变深
后颜色变深
②向稀盐酸中加入少量蒸馏水,盐酸中氢离子浓度降低
③实验室常用排饱和食盐水的方法收集氯气
④棕红色 加压后颜色先变深后变浅
加压后颜色先变深后变浅
⑤在配制硫酸亚铁溶液时往往要加入少量铁粉
⑥由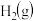 、
、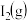 和
和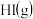 组成的平衡体系加压后颜色变深
组成的平衡体系加压后颜色变深
⑦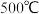 时比室温更有利于合成氨的反应
时比室温更有利于合成氨的反应
⑧将混合气体中的氨液化有利于合成氨反应
①
 溶液中加入固体
溶液中加入固体 后颜色变深
后颜色变深②向稀盐酸中加入少量蒸馏水,盐酸中氢离子浓度降低
③实验室常用排饱和食盐水的方法收集氯气
④棕红色
 加压后颜色先变深后变浅
加压后颜色先变深后变浅⑤在配制硫酸亚铁溶液时往往要加入少量铁粉
⑥由
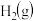 、
、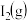 和
和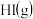 组成的平衡体系加压后颜色变深
组成的平衡体系加压后颜色变深⑦
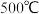 时比室温更有利于合成氨的反应
时比室温更有利于合成氨的反应⑧将混合气体中的氨液化有利于合成氨反应
| A.②⑤⑥⑦ | B.①③⑤⑦ | C.②③⑦⑧ | D.①②⑥⑧ |
您最近半年使用:0次
名校
7 . 氯化银的还原精炼技术是银回收精炼过程中的重要环节,有多种方法还原精炼。
(一)、甲小组选择强还原剂:肼(N2H4)。
在还原AgCl制取银的过程中有对环境无污染气体产生。
(1)①写出相关的化学反应方程式:___________ 。
【资料】工业上一般先向氯化银中加入氨水浆化,然后用N2H4还原,可有利于反应的进行。
②写出浆化过程中的离子反应式:___________ 。从N2H4发生的氧化反应(半反应)的角度分析加入氨水的作用___________ 。
(二)、乙小组换用铁粉还原AgCl制取银,探究其过程和影响因素。
【实验A】在试管中加入NaCl溶液,然后滴入AgNO3溶液,产生白色沉淀。滤出白色沉淀,继续实验如下:
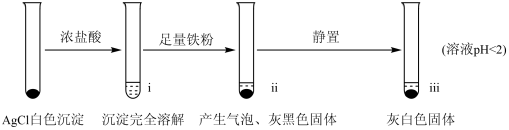
【资料】①AgCl+Cl- AgCl
AgCl
②Fe3++4Cl- FeCl
FeCl
(2)检验ⅱ中产物
①取ⅱ中上层清液,滴加K3[Fe(CN)6]溶液,___________ (填现象),说明溶液中含有Fe2+。
②取ⅱ中少量灰黑色固体,洗涤后将固体等分两份。取其中一份,加入___________ (填试剂)溶解,再加入NaCl溶液生成白色沉淀,证明灰黑色固体中含有Ag。向另一份加入KI溶液,无明显现象。
(3)检验ⅲ中产物。
①取ⅲ中灰白色固体,洗涤。进行如下实验,确认灰白色固体中含AgCl:
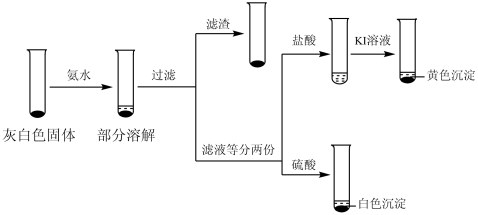
滤液加盐酸未产生沉淀,但加入硫酸后产生了白色沉淀,请结合离子方程式解释原因:___________ 。
②取iii中上层溶液,加几滴KSCN溶液。取样时间与溶液颜色如下表。
用离子方程式表示溶液变红的原因___________ ,Fe3++SCN- Fe(SCN)3。
Fe(SCN)3。
(4)小组同学认为不能排除O2直接氧化Ag继而生成AgCl,对此设计实验:___________ 。结果发现,该实验产生AgCl所需的时间更长。说明AgCl的产生主要与Fe3+有关。
(5)实验A中的i~iii中,i中AgCl溶解,iii中又生成AgCl的原因是:___________ 。
乙组实验反思:铁粉还原AgCl制取银时应控制铁粉、盐酸的浓度和浸泡时间等因素
(一)、甲小组选择强还原剂:肼(N2H4)。
在还原AgCl制取银的过程中有对环境无污染气体产生。
(1)①写出相关的化学反应方程式:
【资料】工业上一般先向氯化银中加入氨水浆化,然后用N2H4还原,可有利于反应的进行。
②写出浆化过程中的离子反应式:
(二)、乙小组换用铁粉还原AgCl制取银,探究其过程和影响因素。
【实验A】在试管中加入NaCl溶液,然后滴入AgNO3溶液,产生白色沉淀。滤出白色沉淀,继续实验如下:

【资料】①AgCl+Cl-
 AgCl
AgCl
②Fe3++4Cl-
 FeCl
FeCl
(2)检验ⅱ中产物
①取ⅱ中上层清液,滴加K3[Fe(CN)6]溶液,
②取ⅱ中少量灰黑色固体,洗涤后将固体等分两份。取其中一份,加入
(3)检验ⅲ中产物。
①取ⅲ中灰白色固体,洗涤。进行如下实验,确认灰白色固体中含AgCl:

滤液加盐酸未产生沉淀,但加入硫酸后产生了白色沉淀,请结合离子方程式解释原因:
②取iii中上层溶液,加几滴KSCN溶液。取样时间与溶液颜色如下表。
| 取样时间 | 10分钟 | 12小时 | 24小时 |
| 溶液颜色 | 浅红色 | 红色 | 深红色 |
 Fe(SCN)3。
Fe(SCN)3。(4)小组同学认为不能排除O2直接氧化Ag继而生成AgCl,对此设计实验:
(5)实验A中的i~iii中,i中AgCl溶解,iii中又生成AgCl的原因是:
乙组实验反思:铁粉还原AgCl制取银时应控制铁粉、盐酸的浓度和浸泡时间等因素
您最近半年使用:0次
名校
解题方法
8 . 某化学小组通过测定溶液pH,计算K2Cr2O7溶液中“Cr2O (橙色)+H2O=2CrO
(橙色)+H2O=2CrO (黄色)+2H+”的平衡常数,结果如下:
(黄色)+2H+”的平衡常数,结果如下:
下列说法不合理的是
 (橙色)+H2O=2CrO
(橙色)+H2O=2CrO (黄色)+2H+”的平衡常数,结果如下:
(黄色)+2H+”的平衡常数,结果如下:| 实验序号 | 温度(°C) | K2Cr2O7溶液浓度(mol/L) | pH | 平衡常数 |
| ① | 26.3 | 0.1000 | a | 2.5×10-15 |
| ② | 26.3 | 0.3000 | 3.78 | b |
| ③ | 50.0 | 0.1000 | 3.75 | 1.01×10-14 |
| A.a大于3.78 |
| B.b等于2.5×10-15 |
| C.由实验①③结果可说明该反应为吸热反应 |
| D.向实验①2mL溶液中加入6滴6mol/LNaOH溶液,溶液橙色加深;恢复原温度,平衡常数不变 |
您最近半年使用:0次
名校
9 . I.某小组对Cu与浓HNO3的反应进行研究。记录如下:
(1)Cu与浓HNO3反应的化学方程式是___________ 。
II.探究实验1中溶液A呈绿色而不是蓝色的原因。
(2)甲认为溶液呈绿色是由Cu2+离子浓度较大引起的。乙根据实验记录,认为此观点不正确,乙的依据是___________ 。
(3)乙认为溶液呈绿色是由溶解的NO2引起的。
进行实验2:先将NO2通入B中,再鼓入N2,结果证实假设成立。
则以上两步操作对应的现象分别是___________ 、___________ 。
(4)为深入研究,丙查阅资料,有如下信息:
i.溶有NO2的浓HNO3呈黄色;水或稀HNO3中通少量NO2溶液呈无色。
ii.NO2溶于水,会发生反应2NO2+H2O= HNO3+HNO2;
HNO2是弱酸,只能稳定存在于冷、稀的溶液中,否则易分解。
iii. 能与Cu2+反应:Cu2+(蓝色)+4
能与Cu2+反应:Cu2+(蓝色)+4

 (绿色)
(绿色)
据此,丙进一步假设:
①可能是A中剩余的浓HNO3溶解了NO2得到的黄色溶液与Cu(NO3)2的蓝色溶液混合而形成的绿色;
②可能是A中生成了 使溶液呈绿色。
使溶液呈绿色。
丙进行如下实验:
①亚硝酸分解的化学方程式是___________ 。
②请用平衡原理解释加入H2SO4后绿色溶液变蓝的原因:___________ 。
(5)根据实验得出结论:实验1中溶液A呈绿色的主要原因是___________ 。请依据实验现象阐述理由:___________ 。
| 装置 | 药品 | 现象 | |
| 实验1 |  | 0.64gCu片(0.01mol) Cu片和20.0 mL浓HNO3 | Cu片消失,得到绿色溶液A,放置较长时间后得到蓝色溶 液B,…… |
(1)Cu与浓HNO3反应的化学方程式是
II.探究实验1中溶液A呈绿色而不是蓝色的原因。
(2)甲认为溶液呈绿色是由Cu2+离子浓度较大引起的。乙根据实验记录,认为此观点不正确,乙的依据是
(3)乙认为溶液呈绿色是由溶解的NO2引起的。
进行实验2:先将NO2通入B中,再鼓入N2,结果证实假设成立。
则以上两步操作对应的现象分别是
(4)为深入研究,丙查阅资料,有如下信息:
i.溶有NO2的浓HNO3呈黄色;水或稀HNO3中通少量NO2溶液呈无色。
ii.NO2溶于水,会发生反应2NO2+H2O= HNO3+HNO2;
HNO2是弱酸,只能稳定存在于冷、稀的溶液中,否则易分解。
iii.
 能与Cu2+反应:Cu2+(蓝色)+4
能与Cu2+反应:Cu2+(蓝色)+4

 (绿色)
(绿色)据此,丙进一步假设:
①可能是A中剩余的浓HNO3溶解了NO2得到的黄色溶液与Cu(NO3)2的蓝色溶液混合而形成的绿色;
②可能是A中生成了
 使溶液呈绿色。
使溶液呈绿色。丙进行如下实验:
| 操作 | 现象 | |
| 实验3 | i.配制与溶液A的c(H+)相同的HNO3溶液,取20.0mL,通入NO2气体 | 溶液呈黄色 |
| ii.再加0.01molCu(NO3)2固体搅拌至完全溶解 | 溶液变为绿色 | |
| iii.加水稀释 | 溶液立即变蓝 | |
| 实验4 | i.向20.0mL0.5mol/L Cu(NO3)2蓝色溶液中通入少量NO2 | 溶液呈绿色 |
| ii.加入稀H2SO4 | 有无色气体放出,遇空气变红棕色,溶液很快变为蓝色 |
②请用平衡原理解释加入H2SO4后绿色溶液变蓝的原因:
(5)根据实验得出结论:实验1中溶液A呈绿色的主要原因是
您最近半年使用:0次
名校
10 . 在体积为1 L的恒温密闭容器中,充入1 mol CO2和3 mol H2,一定条件下发生反应: CO2(g)+3H2(g)⇌CH3OH(g)+H2O(g) ,测得CO2和CH3OH(g)的浓度随时间变化如图所示。下列说法正确的是
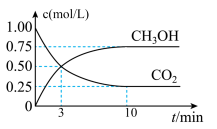
| A.该化学反应在3 min时达到平衡状态 |
| B.保持其他条件不变,降低温度,平衡时c(CH3OH)=0.85 mol·L-1,则该反应的ΔH >0 |
| C.相同温度下,起始时向上述容器中充入0.5 mol CO2、1.5 mol H2,平衡时CO2的转化率为75% |
| D.12 min时,向上述容器中再充入0.25 mol CO2、0.25 mol H2O(g),此时反应将向正反应方向进行 |
您最近半年使用:0次
2023-12-23更新
|
121次组卷
|
3卷引用:河北省衡水市安平中学2023-2024学年高二下学期开学考试化学试题



