1 . 对下列实验操作的相关现象预测和所得的结论均正确的是
选项 | 实验操作 | 现象预测 | 结论 |
A | 向  黄色溶液中滴5~10滴 黄色溶液中滴5~10滴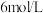  溶液 溶液 | 溶液颜色由黄色变为橙色 | 增大反应物浓度,平衡正向移动 |
B | 取适量食品包装袋中的抗氧化“铁粉包”样品,滴加适量稀硝酸溶解,再滴加几滴 溶液 溶液 | 溶液变红色 | 该铁粉已经完全被空气氧化 |
C | 向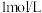  溶液中滴加 溶液中滴加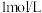  溶液 溶液 | 有白色沉淀生成 |
|
D | 将3g铜片和适量稀 混合 混合 | 管口有红棕色气体 | 稀硝酸被Cu还原为 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
2 . 工业上以铬铁矿( ,含Al,Si氧化物等杂质)为主要原料制备重铬酸钾的工艺流程如图。回答下列问题:
,含Al,Si氧化物等杂质)为主要原料制备重铬酸钾的工艺流程如图。回答下列问题: (铁、铬分别为
(铁、铬分别为 、
、 价)转化为
价)转化为 和
和 ,同时A1、Si氧化物转化为可溶性钠盐。
,同时A1、Si氧化物转化为可溶性钠盐。
(1)“焙烧”过程与 有关的化学反应中,氧化剂和还原剂物质的量之比为
有关的化学反应中,氧化剂和还原剂物质的量之比为___________ 。“浸取”过程所得滤渣的用途有___________ (合理即可)。
(2)矿物中相关元素可溶性组分物质的量浓度c与pH的关系如图所示。当溶液中可溶组分浓度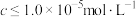 时,可认为已除尽。
时,可认为已除尽。___________ ;从平衡移动的角度解释“酸化”过程加入 的原因
的原因___________ 。
(3)“冷却结晶”时,相关化学反应方程式为___________ 。
(4)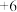 价铬的化合物毒性较大,需将
价铬的化合物毒性较大,需将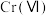 转化为毒性较低的
转化为毒性较低的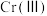 ;工业上可采用电解法处理酸性含铬废水:以铁板做阴、阳极,电解含铬(Ⅵ)废水,示意如图。
;工业上可采用电解法处理酸性含铬废水:以铁板做阴、阳极,电解含铬(Ⅵ)废水,示意如图。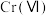 :向含铬(Ⅵ)废水中加入适量
:向含铬(Ⅵ)废水中加入适量 溶液发生反应,生成在乙醚中较稳定存在的
溶液发生反应,生成在乙醚中较稳定存在的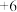 价的含铬氧化物
价的含铬氧化物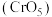 ,1mol
,1mol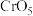 中含过氧键
中含过氧键 的数量是
的数量是___________ 。
②电解开始时,A极上主要发生的电极反应式为___________ 。
③电解产生的 将
将 还原为
还原为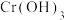 同时产生
同时产生 ,其离子方程式为
,其离子方程式为___________ 。
 ,含Al,Si氧化物等杂质)为主要原料制备重铬酸钾的工艺流程如图。回答下列问题:
,含Al,Si氧化物等杂质)为主要原料制备重铬酸钾的工艺流程如图。回答下列问题: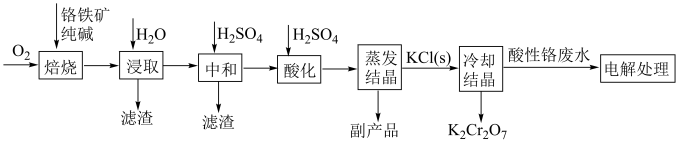
 (铁、铬分别为
(铁、铬分别为 、
、 价)转化为
价)转化为 和
和 ,同时A1、Si氧化物转化为可溶性钠盐。
,同时A1、Si氧化物转化为可溶性钠盐。(1)“焙烧”过程与
 有关的化学反应中,氧化剂和还原剂物质的量之比为
有关的化学反应中,氧化剂和还原剂物质的量之比为(2)矿物中相关元素可溶性组分物质的量浓度c与pH的关系如图所示。当溶液中可溶组分浓度
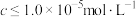 时,可认为已除尽。
时,可认为已除尽。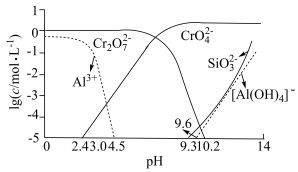
 的原因
的原因(3)“冷却结晶”时,相关化学反应方程式为
(4)
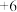 价铬的化合物毒性较大,需将
价铬的化合物毒性较大,需将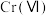 转化为毒性较低的
转化为毒性较低的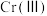 ;工业上可采用电解法处理酸性含铬废水:以铁板做阴、阳极,电解含铬(Ⅵ)废水,示意如图。
;工业上可采用电解法处理酸性含铬废水:以铁板做阴、阳极,电解含铬(Ⅵ)废水,示意如图。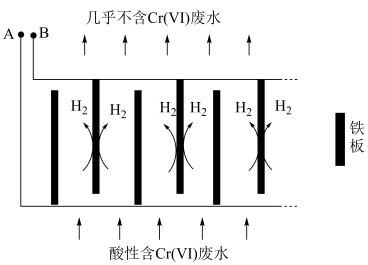
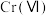 :向含铬(Ⅵ)废水中加入适量
:向含铬(Ⅵ)废水中加入适量 溶液发生反应,生成在乙醚中较稳定存在的
溶液发生反应,生成在乙醚中较稳定存在的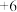 价的含铬氧化物
价的含铬氧化物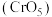 ,1mol
,1mol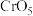 中含过氧键
中含过氧键 的数量是
的数量是②电解开始时,A极上主要发生的电极反应式为
③电解产生的
 将
将 还原为
还原为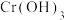 同时产生
同时产生 ,其离子方程式为
,其离子方程式为
您最近一年使用:0次
2024-04-11更新
|
285次组卷
|
2卷引用:2024届四川省雅安市、遂宁市、眉山市高三第二次诊断性考试理科综合试题-高中化学
名校
解题方法
3 . 铟(In)是一种稀散金属,常与其他金属矿石伴生,回收氧化锌烟尘(主要成分是ZnO,还含少量PbO、FeS、FeSiO3、 In2O3、 In2S3等)中的金属铟的工艺流程如下:
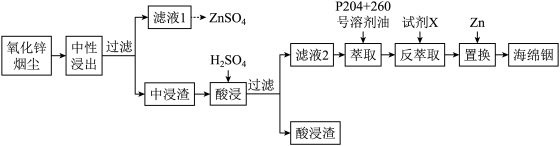
已知:室温下,金属离子开始沉淀和完全沉淀的pH如表所示。
回答下列问题:
(1)In2O3中In的化合价是_______________________ 。
(2)“中性浸出”的过程为:先加入稀硫酸和适量氧化剂MnO2氧化酸浸氧化锌烟尘,反应结束前半个小时加入CaO调整pH=5.0~5.2。
①FeSiO3与稀H2SO4反应的化学方程式为____________________________________________ 。
②氧化酸浸过程中,In2S3中的硫元素被MnO2氧化为 ,该反应的离子方程式为
,该反应的离子方程式为____________________ 。
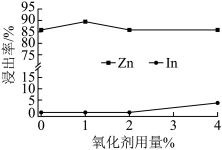
③氧化剂用量对中性浸出效果的影响如图所示。最佳氧化剂用量为_________________ 。
④“中浸渣”的主要成分为In(OH)3、________________ 。 (写化学式)
(3)萃取时,发生反应In3+ +3H2A2 In(HA2)3 +3H+,H2A2代表有机萃取剂。
In(HA2)3 +3H+,H2A2代表有机萃取剂。
①反萃取时,宜选用的试剂X为_____________________ (写化学式)
②实验室进行萃取和反萃取时,均需要使用的玻璃仪器有_________________________ 。
(4)“置换”后的滤液可返回________________________ (填“滤液 1”或“滤液2”)中利用。
(5)“置换”时锌粉的利用率为90%,若想获得6.9 kg海绵铟,需要使用锌粉___ _kg (结果保留1位小数)

已知:室温下,金属离子开始沉淀和完全沉淀的pH如表所示。
金属离子 | Fe3+ | Fe2+ | In3+ |
开始沉淀pH(离子浓度为0.1mol·L-1时) | 1.3 | 6 | 3 |
完全沉淀pH | 2.7 | 8 | 4.3 |
(1)In2O3中In的化合价是
(2)“中性浸出”的过程为:先加入稀硫酸和适量氧化剂MnO2氧化酸浸氧化锌烟尘,反应结束前半个小时加入CaO调整pH=5.0~5.2。
①FeSiO3与稀H2SO4反应的化学方程式为
②氧化酸浸过程中,In2S3中的硫元素被MnO2氧化为
 ,该反应的离子方程式为
,该反应的离子方程式为③氧化剂用量对中性浸出效果的影响如图所示。最佳氧化剂用量为

④“中浸渣”的主要成分为In(OH)3、
(3)萃取时,发生反应In3+ +3H2A2
 In(HA2)3 +3H+,H2A2代表有机萃取剂。
In(HA2)3 +3H+,H2A2代表有机萃取剂。①反萃取时,宜选用的试剂X为
②实验室进行萃取和反萃取时,均需要使用的玻璃仪器有
(4)“置换”后的滤液可返回
(5)“置换”时锌粉的利用率为90%,若想获得6.9 kg海绵铟,需要使用锌粉
您最近一年使用:0次
名校
4 . 下列实验操作和实验现象不相匹配的是
| 实验操作 | 实验现象 | |
| A | 将一小块钠投入硫酸铜溶液中 | 有气泡冒出,产生蓝色沉淀 |
| B | 将Na2O2加入适量水中,滴入几滴酚酞 | 溶液先变红后褪色,有气泡产生 |
| C | 向重铬酸钾溶液中滴加几滴浓硫酸 | 随着浓硫酸加入,溶液颜色变浅 |
| D | 将铜丝在盛满氯气的烧瓶中点燃 | 烧瓶中充满棕黄色的烟 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
2022-11-05更新
|
854次组卷
|
4卷引用:四川省绵阳市2022-2023学年高三上学期“一诊”考试 化学试题
名校
解题方法
5 . 乙烯水合法是工业制乙醇的方法: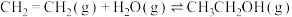 ,该反应在密闭容器中进行,下列说法错误的是
,该反应在密闭容器中进行,下列说法错误的是
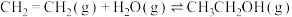 ,该反应在密闭容器中进行,下列说法错误的是
,该反应在密闭容器中进行,下列说法错误的是A.恒温恒容,充入 , ,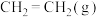 的转化率增大 的转化率增大 |
B.若升高温度,平衡常数减小,则该反应 |
| C.压缩容积,活化分子百分数增大,反应速率加快 |
D.恒温恒压,通入 ,平衡向左移动 ,平衡向左移动 |
您最近一年使用:0次
2022-10-29更新
|
581次组卷
|
7卷引用:四川省雅安市2023届高三上学期零诊考试化学试题
四川省雅安市2023届高三上学期零诊考试化学试题(已下线)专题13 化学反应速率和化学平衡(已下线)查补易混易错04 化学反应原理部分-【查漏补缺】2023年高考化学三轮冲刺过关(新高考专用)湖南省衡阳市第一中学2023届高三下学期5月月考化学试题(已下线)2019年高考海南卷化学试题变式题(单选题)(已下线)选择题11-15辽宁省锦州市渤海大学附属高级中学2023-2024学年高三上学期第三次考试化学试题
解题方法
6 . 下列实验操作所对应的现象正确的是
| 选项 | 实验操作 | 现象 |
| A | 向5mL0.1mol·L-1K2Cr2O7溶液中滴加3~10滴浓硫酸 | 溶液橙色加深 |
| B | 将乙烯通入溴的CCl4溶液中 | 溴的CCl4溶液褪色并分层 |
| C | 向1 mL 0.1 mol·L-1 Na2CO3溶液中加入硼酸溶液 | 产生大量气泡 |
| D | 将AgCl和AgBr饱和溶液等体积混合 | 有白色沉淀析出 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
7 . 利用合成气(主要成分为CO、CO2、 H2) 一定条件下合成甲醇(CH3OH),发生的主要反应如下:
Ⅰ. CO(g) + 2H2(g)=CH3OH(g) △H。
Ⅱ. CO(g) + H2O(g)=CO2(g) +H2(g) ∆H2=-41.2 kJ/mol
回答下列问题:
(1)已知反应①中的相关化学键键能数据如下:
写出由二氧化碳、氢气制备甲醇的热化学方程式_______ 反应I在_______ (填“高温”、“低温”或“任意温度”)条件下自发进行。
(2)在T℃时,向5L恒容密闭容器中加入0.6 mol CO和0.45 molH2,发生反应Ⅰ。CO和CH3OH的浓度在不同时刻的变化状况如图所示:
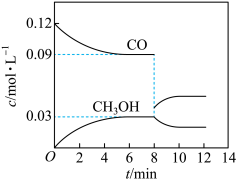
①下列能够说明反应在第6min时达到平衡状态的是______
A.混合气体的平均摩尔质量不再改变
B. CH3OH 的浓度不变
C. v(CO)正 : v(H2)逆= 2:1
D. P(CO):P( H2)= 1:2
第8 min时改变的条件是_______
②在第12 min时升高温度,重新达到平衡时,化学平衡常数将_______ (填 “增大”“不变”或“减小”),理由是_______
(3)某科研小组研究了反应CO(g) + 2H2(g)= CH3OH(g)的动力学,获得其速率方程v=k[c(H2)]1/2[c(CO)]m,k为速率常数(只受温度影响),m为CO的反应级数。在某温度下进行实验,测得各组分初浓度和反应初速率如下:
CO的反应级数m=_______ , 当实验2进行到某时刻,测得c(H3)= 0.010 mol·L-1,则此时的反应速率v_______ mol·L-1·s-1(已知: ≈0.3)。
≈0.3)。
(4)利用CH4重整CO2的催化转化如图所示,CH4与CO2重整反应的方程式为_______ 。有关转化过程,下列说法正确的是_______ (填序号)。
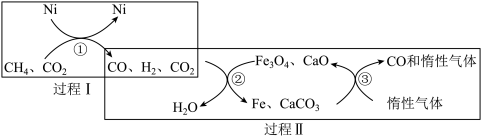
a. 过程Ⅰ中CO2未参与反应
b.过程Ⅱ实现了含碳物质与含氢物质的分离
c.转化②中CaO消耗过程中的CO2,有利于反应正向进行
d. 转化③中Fe与CaCO3,反应的物质的量之比为4:3
Ⅰ. CO(g) + 2H2(g)=CH3OH(g) △H。
Ⅱ. CO(g) + H2O(g)=CO2(g) +H2(g) ∆H2=-41.2 kJ/mol
回答下列问题:
(1)已知反应①中的相关化学键键能数据如下:
| 化学键 | H-H | C-O | C≡O | H-O | C-H |
| E/(kJ/mol) | 436 | 343 | 1076 | 465 | 413 |
(2)在T℃时,向5L恒容密闭容器中加入0.6 mol CO和0.45 molH2,发生反应Ⅰ。CO和CH3OH的浓度在不同时刻的变化状况如图所示:

①下列能够说明反应在第6min时达到平衡状态的是
A.混合气体的平均摩尔质量不再改变
B. CH3OH 的浓度不变
C. v(CO)正 : v(H2)逆= 2:1
D. P(CO):P( H2)= 1:2
第8 min时改变的条件是
②在第12 min时升高温度,重新达到平衡时,化学平衡常数将
(3)某科研小组研究了反应CO(g) + 2H2(g)= CH3OH(g)的动力学,获得其速率方程v=k[c(H2)]1/2[c(CO)]m,k为速率常数(只受温度影响),m为CO的反应级数。在某温度下进行实验,测得各组分初浓度和反应初速率如下:
| 实验序号 | c(H2)/mol/L | c(CO)/mol/L | v/mol/L |
| 1 | 0.100 | 0.100 | 1.2×10-2 |
| 2 | 0.050 | 0.100 | 8.4×10-3 |
| 3 | 0.100 | 0.200 | 2.4×10-2 |
 ≈0.3)。
≈0.3)。(4)利用CH4重整CO2的催化转化如图所示,CH4与CO2重整反应的方程式为

a. 过程Ⅰ中CO2未参与反应
b.过程Ⅱ实现了含碳物质与含氢物质的分离
c.转化②中CaO消耗过程中的CO2,有利于反应正向进行
d. 转化③中Fe与CaCO3,反应的物质的量之比为4:3
您最近一年使用:0次
解题方法
8 . 室温下,初始浓度为1.0mol·L-1的Na2CrO4溶液中c(Cr2O )随c(H+)的变化如图所示。下列说法正确的是
)随c(H+)的变化如图所示。下列说法正确的是

 )随c(H+)的变化如图所示。下列说法正确的是
)随c(H+)的变化如图所示。下列说法正确的是
| A.随着c(H+)增大,溶液由橙色变为黄色 |
B.由A点可以得出2CrO +2H+=Cr2O +2H+=Cr2O +H2O的K=5×1013 +H2O的K=5×1013 |
C.溶液pH变化过程中c(Na+)=2c(CrO )+4c(Cr2O )+4c(Cr2O ) ) |
D.当溶液pH=7时,c(Na+)=2c(CrO )+2c(Cr2O )+2c(Cr2O ) ) |
您最近一年使用:0次
名校
9 .  资源化在推进能源绿色转型,实现“碳达峰、碳中和”中具有重要意义。
资源化在推进能源绿色转型,实现“碳达峰、碳中和”中具有重要意义。
Ⅰ. 与
与 催化重整制合成气是研究热点之一、发生的主要反应有:
催化重整制合成气是研究热点之一、发生的主要反应有:
反应①:
反应②: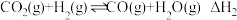
(1)有关化学键键能数据如表:
则反应②的反应热
_______  。
。
(2)对于上述反位体系,下列说法错误的是_______ 。
A.增大 的浓度,反应①②的正反应速率均增加
的浓度,反应①②的正反应速率均增加
B.恒容密闭容器中当气体密度不变时,反应达到平衡状态
C.加入催化剂,可提高 的平衡转化率
的平衡转化率
(3)恒压下进行 与
与 催化重整实验。初始压强为
催化重整实验。初始压强为 ,起始投料
,起始投料 ,
, 和
和 的平衡转化率随温度变化曲线如图所示。
的平衡转化率随温度变化曲线如图所示。
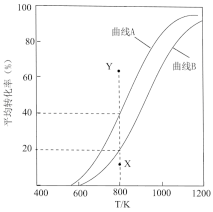
①曲线_______ (填“A”或“B”)表示 的平衡转化率。
的平衡转化率。
②800K,反应至 转化率达到X点时,v(正)
转化率达到X点时,v(正)_______ v(逆)(填“>”、“<”或“=”)。若要使 的转化率由X点达到Y点,改变的外界条件可以是
的转化率由X点达到Y点,改变的外界条件可以是_______ (答一条即可)。
③800K,反应①的分压平衡常数
_______ (分压=总压×物质的量分数)。
Ⅱ.利用电化学装置可实现 和
和 两种分子的耦合转化,其原理如图所示。
两种分子的耦合转化,其原理如图所示。
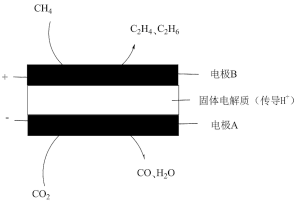
(4)阴极的电极反应式为_______ 。
 资源化在推进能源绿色转型,实现“碳达峰、碳中和”中具有重要意义。
资源化在推进能源绿色转型,实现“碳达峰、碳中和”中具有重要意义。Ⅰ.
 与
与 催化重整制合成气是研究热点之一、发生的主要反应有:
催化重整制合成气是研究热点之一、发生的主要反应有:反应①:

反应②:
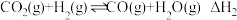
(1)有关化学键键能数据如表:
| 化学键 | 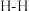 | H-O | C=O |  |
键能/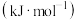 | 436 | 463 | 803 | 1076 |

 。
。(2)对于上述反位体系,下列说法错误的是
A.增大
 的浓度,反应①②的正反应速率均增加
的浓度,反应①②的正反应速率均增加B.恒容密闭容器中当气体密度不变时,反应达到平衡状态
C.加入催化剂,可提高
 的平衡转化率
的平衡转化率(3)恒压下进行
 与
与 催化重整实验。初始压强为
催化重整实验。初始压强为 ,起始投料
,起始投料 ,
, 和
和 的平衡转化率随温度变化曲线如图所示。
的平衡转化率随温度变化曲线如图所示。
①曲线
 的平衡转化率。
的平衡转化率。②800K,反应至
 转化率达到X点时,v(正)
转化率达到X点时,v(正) 的转化率由X点达到Y点,改变的外界条件可以是
的转化率由X点达到Y点,改变的外界条件可以是③800K,反应①的分压平衡常数

Ⅱ.利用电化学装置可实现
 和
和 两种分子的耦合转化,其原理如图所示。
两种分子的耦合转化,其原理如图所示。
(4)阴极的电极反应式为
您最近一年使用:0次
2022-01-24更新
|
594次组卷
|
4卷引用:四川省成都艺术高级中学2021-2022学年高三下学期模拟考试理科综合化学部分试题(三)
四川省成都艺术高级中学2021-2022学年高三下学期模拟考试理科综合化学部分试题(三)安徽省合肥市2022届高三上学期第一次教学质量检测化学试题甘肃省武威第六中学2022届高三下学期第八次诊断考试理综化学试题(已下线)专项16 化学反应原理综合题-备战2022年高考化学阶段性新题精选专项特训(全国卷)(3月期)
名校
10 . 二甲醚简称DME,是一种基础化工原料,可用于燃料电池及制取低碳烯烃等,Kagan提出的一步法制取二甲醚的反应为: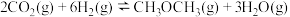 ΔH。下图为刚性容器中,CO2初始浓度相同,进料浓度比c(H2)∶c(CO2)分别等于3和5时CO2平衡转化率随温度变化的关系:
ΔH。下图为刚性容器中,CO2初始浓度相同,进料浓度比c(H2)∶c(CO2)分别等于3和5时CO2平衡转化率随温度变化的关系:

(1)ΔH_______ 0(填“>”或“<”)。进料浓度比c(H2)∶c(CO2)=5的曲线为_______ 点所在曲线(填“A”或“B”),B、C两点用CH3OCH3表示的平均反应速率 (B)
(B)_______  (C)(填“>”、“<”或“=”)。
(C)(填“>”、“<”或“=”)。
(2)在一定条件下,若将CO2改为等物质的量的CO和CO2的混合气,则充入的CO与H2O发生反应: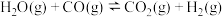 将导致CH3OCH3的产率增大,原因是
将导致CH3OCH3的产率增大,原因是_______ 。
(3)在一定体积的刚性容器中保持温度不变,保持c(H2)∶c(CO2)进料浓度比不变,进一步提高CO2的平衡转化率的方法是_______ 、_______ 。
(4)当进料浓度比c(H2)∶c(CO2)=3、温度为443K时,测得刚性容器中起始总压为4MPa.计算443K时该反应的平衡常数Kp=_______ (列出计算式,用物质的平衡分压代替其物质的量浓度,气体分压=气体总压×物质的量分数)。
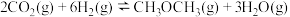 ΔH。下图为刚性容器中,CO2初始浓度相同,进料浓度比c(H2)∶c(CO2)分别等于3和5时CO2平衡转化率随温度变化的关系:
ΔH。下图为刚性容器中,CO2初始浓度相同,进料浓度比c(H2)∶c(CO2)分别等于3和5时CO2平衡转化率随温度变化的关系:
(1)ΔH
 (B)
(B) (C)(填“>”、“<”或“=”)。
(C)(填“>”、“<”或“=”)。(2)在一定条件下,若将CO2改为等物质的量的CO和CO2的混合气,则充入的CO与H2O发生反应:
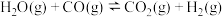 将导致CH3OCH3的产率增大,原因是
将导致CH3OCH3的产率增大,原因是(3)在一定体积的刚性容器中保持温度不变,保持c(H2)∶c(CO2)进料浓度比不变,进一步提高CO2的平衡转化率的方法是
(4)当进料浓度比c(H2)∶c(CO2)=3、温度为443K时,测得刚性容器中起始总压为4MPa.计算443K时该反应的平衡常数Kp=
您最近一年使用:0次
2021-07-15更新
|
367次组卷
|
2卷引用:四川省宜宾市叙州区第一中学校2022届高考三诊模拟考试理科综合化学试题

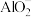 与
与 发生了双水解
发生了双水解


