解题方法
1 . 某实验小组从某废旧锂离子电池正极活性材料(主要成分可表示为 ,还含有少量
,还含有少量 、
、 的化合物)中分别回收处理金属元素,工艺流程如下图所示:
的化合物)中分别回收处理金属元素,工艺流程如下图所示: 、
、 、
、 、
、 ;
;
②有关金属离子沉淀完全的 见下表:
见下表:
(1)丁二酮肟分子中 杂化的碳原子个数为
杂化的碳原子个数为______ ,二丁二酮肟镍中存在的化学键有______ (填序号)。
A. 链 B.氢键 C.金属键 D.配位键
链 B.氢键 C.金属键 D.配位键
(2)“氧化”过程的操作为控制体系的 在
在 ,加入
,加入 溶液,写出反应的离子方程式
溶液,写出反应的离子方程式______ 。
(3)P507萃取剂(用HA表示)萃取 的原理可表示为
的原理可表示为 的浸出与水相
的浸出与水相 的关系如图所示。分析
的关系如图所示。分析 较小时萃取率偏低的原因为
较小时萃取率偏低的原因为______ 。 和
和 在空气氛围中焙烧可得到
在空气氛围中焙烧可得到 ,该反应化学方程式为
,该反应化学方程式为______ 。
(5)将草酸钴晶体 置于空气中加热,受热过程中固体残留率(
置于空气中加热,受热过程中固体残留率( )变化如下图所示,则C点固体物质的化学式为
)变化如下图所示,则C点固体物质的化学式为______ 。 的一种晶胞如图所示(仅标出
的一种晶胞如图所示(仅标出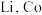 与
与 未标出)、该晶胞中占有O的个数为
未标出)、该晶胞中占有O的个数为______ 。
 ,还含有少量
,还含有少量 、
、 的化合物)中分别回收处理金属元素,工艺流程如下图所示:
的化合物)中分别回收处理金属元素,工艺流程如下图所示: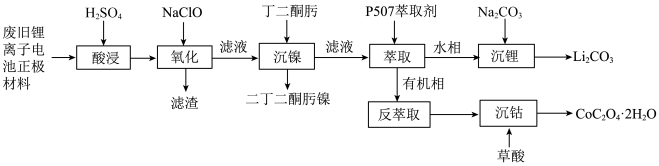
 、
、 、
、 、
、 ;
;②有关金属离子沉淀完全的
 见下表:
见下表:离子 |
|
|
|
|
| 9.3 | 3.2 | 9.0 | 8.9 |
③沉镍反应为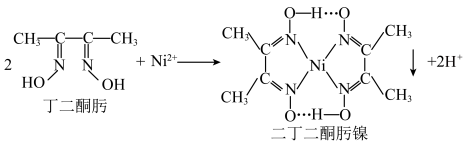
(1)丁二酮肟分子中
 杂化的碳原子个数为
杂化的碳原子个数为A.
 链 B.氢键 C.金属键 D.配位键
链 B.氢键 C.金属键 D.配位键(2)“氧化”过程的操作为控制体系的
 在
在 ,加入
,加入 溶液,写出反应的离子方程式
溶液,写出反应的离子方程式(3)P507萃取剂(用HA表示)萃取
 的原理可表示为
的原理可表示为 的浸出与水相
的浸出与水相 的关系如图所示。分析
的关系如图所示。分析 较小时萃取率偏低的原因为
较小时萃取率偏低的原因为
 和
和 在空气氛围中焙烧可得到
在空气氛围中焙烧可得到 ,该反应化学方程式为
,该反应化学方程式为(5)将草酸钴晶体
 置于空气中加热,受热过程中固体残留率(
置于空气中加热,受热过程中固体残留率( )变化如下图所示,则C点固体物质的化学式为
)变化如下图所示,则C点固体物质的化学式为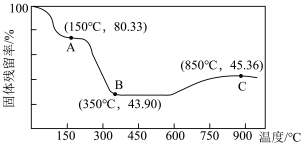
 的一种晶胞如图所示(仅标出
的一种晶胞如图所示(仅标出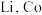 与
与 未标出)、该晶胞中占有O的个数为
未标出)、该晶胞中占有O的个数为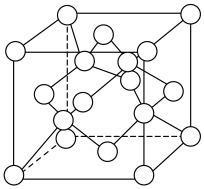
您最近一年使用:0次
2 . 只要善于观察和发现,化学之美随处可见。下列说法错误的是
| A.“日照香炉生紫烟”涉及胶体的丁达尔效应 |
| B.石蕊遇到碱性溶液变为蓝色与平衡移动有关 |
| C.五彩缤纷的烟花,是电子由基态跃迁到激发态时,能量以光的形式释放出来 |
| D.晶莹剔透的大块水晶是由熔融态的二氧化硅缓慢冷却得到的 |
您最近一年使用:0次
3 . 甲醇是一种可再生的清洁能源,二氧化碳催化加氢制甲醇,有利于实现“碳达峰”、“碳中和”。已知有关 的热化学方程式如下:
的热化学方程式如下:
Ⅰ. ,
,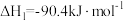 ;
;
Ⅱ. ,
, ;
;
Ⅲ. ,
,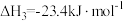 ;
;
Ⅳ. ,
,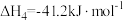 ;
;
请回答下列问题:
(1)

_______ 。
(2)在体积一定的密闭容器中按物质的量比1:2充入CO和 ,发生上述反应Ⅰ,充分反应达平衡后,如图是平衡混合物中
,发生上述反应Ⅰ,充分反应达平衡后,如图是平衡混合物中 的体积分数在不同压强下随温度变化的平衡曲线。
的体积分数在不同压强下随温度变化的平衡曲线。 ,温度为300℃时,反应Ⅰ的压强平衡常数
,温度为300℃时,反应Ⅰ的压强平衡常数
_______ 。(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)
②反应Ⅰ达平衡后,下列措施能提高 产率的是
产率的是_______ (填字母)。
A.加入适量一氧化碳 B.升高温度 C.使用高效催化剂 D.增大压强
(3)一定温度下,向容积为1L的恒容密闭容器中,充入 和
和 ,发生上述反应Ⅱ,测得各物质的物质的量浓度变化如图所示:
,发生上述反应Ⅱ,测得各物质的物质的量浓度变化如图所示:_______ 的浓度随时间的变化; 内,
内, 的平均反应速率为
的平均反应速率为_______  。
。
(4)对于反应Ⅲ,其速率方程式为 ,
, ,
, ,
, 为速率常数且只与温度有关,则该反应的平衡常数
为速率常数且只与温度有关,则该反应的平衡常数
_______ (用含 、
、 的代数式表示)。
的代数式表示)。
已知某温度下,上述反应平衡常数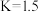 ,在密闭容器中充入一定物质的量的
,在密闭容器中充入一定物质的量的 ,反应到某时刻测得各组分的物质的量如下:
,反应到某时刻测得各组分的物质的量如下:
此时正、逆反应速率的大小:
_______  。
。
 的热化学方程式如下:
的热化学方程式如下:Ⅰ.
 ,
,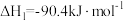 ;
;Ⅱ.
 ,
, ;
;Ⅲ.
 ,
,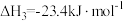 ;
;Ⅳ.
 ,
,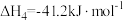 ;
;请回答下列问题:
(1)


(2)在体积一定的密闭容器中按物质的量比1:2充入CO和
 ,发生上述反应Ⅰ,充分反应达平衡后,如图是平衡混合物中
,发生上述反应Ⅰ,充分反应达平衡后,如图是平衡混合物中 的体积分数在不同压强下随温度变化的平衡曲线。
的体积分数在不同压强下随温度变化的平衡曲线。
 ,温度为300℃时,反应Ⅰ的压强平衡常数
,温度为300℃时,反应Ⅰ的压强平衡常数
②反应Ⅰ达平衡后,下列措施能提高
 产率的是
产率的是A.加入适量一氧化碳 B.升高温度 C.使用高效催化剂 D.增大压强
(3)一定温度下,向容积为1L的恒容密闭容器中,充入
 和
和 ,发生上述反应Ⅱ,测得各物质的物质的量浓度变化如图所示:
,发生上述反应Ⅱ,测得各物质的物质的量浓度变化如图所示: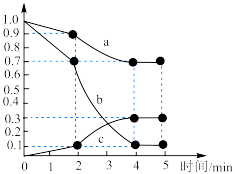
 内,
内, 的平均反应速率为
的平均反应速率为 。
。(4)对于反应Ⅲ,其速率方程式为
 ,
, ,
, ,
, 为速率常数且只与温度有关,则该反应的平衡常数
为速率常数且只与温度有关,则该反应的平衡常数
 、
、 的代数式表示)。
的代数式表示)。已知某温度下,上述反应平衡常数
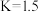 ,在密闭容器中充入一定物质的量的
,在密闭容器中充入一定物质的量的 ,反应到某时刻测得各组分的物质的量如下:
,反应到某时刻测得各组分的物质的量如下:| 物质 |  |  | 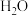 |
| 物质的量/mol | 0.2 | 0.2 | 0.2 |

 。
。
您最近一年使用:0次
4 . 我国提出“CO2排放力争于2023年前达到峰值,努力争取2060年前实现碳中和”。研发CO2的利用技术,降低空气中CO2的含量是实现该目标的重要途径。
(1)下面是用H2捕捉CO2时发生的两个反应:
I.CO2(g)+4H2(g) CH4(g)+2H2O(g) ∆H1
CH4(g)+2H2O(g) ∆H1
II.CO2(g)+H2(g) CO(g)+H2O(g) ∆H2
CO(g)+H2O(g) ∆H2
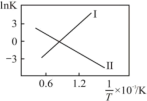
①反应I、II的lnK随1/T的变化如图所示,则ΔH2___________ 0(填“>”“<”或“=”)0;有利于反应I自发进行的温度是___________ (填“高温”或“低温”)。___________ ,而速率仍然增大的可能原因是___________ ___________ ,反应II的平衡常数Kp为___________ (保留两位有效数字)。[已知:CH4的选择性=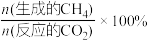 ]
]
(2)利用化学链将高炉废气中的CO2转化为CO的示意图如下。___________ ,该化学链的总反应是___________ 。
(1)下面是用H2捕捉CO2时发生的两个反应:
I.CO2(g)+4H2(g)
 CH4(g)+2H2O(g) ∆H1
CH4(g)+2H2O(g) ∆H1II.CO2(g)+H2(g)
 CO(g)+H2O(g) ∆H2
CO(g)+H2O(g) ∆H2①反应I、II的lnK随1/T的变化如图所示,则ΔH2
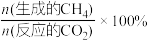 ]
](2)利用化学链将高炉废气中的CO2转化为CO的示意图如下。

您最近一年使用:0次
5 . 向锌氨溶液(由 液、氨水-硫酸铵混合溶液配制而成)中加入萃取剂
液、氨水-硫酸铵混合溶液配制而成)中加入萃取剂 。不同
。不同 下(其它条件不变)达到平衡后
下(其它条件不变)达到平衡后 和
和 的萃取效果如图所示。
的萃取效果如图所示。
反应ⅱ:
反应ⅲ:
② 的锌氨溶液中,
的锌氨溶液中,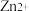 主要以
主要以 形式存在
形式存在
下列说法不正确 的是
 液、氨水-硫酸铵混合溶液配制而成)中加入萃取剂
液、氨水-硫酸铵混合溶液配制而成)中加入萃取剂 。不同
。不同 下(其它条件不变)达到平衡后
下(其它条件不变)达到平衡后 和
和 的萃取效果如图所示。
的萃取效果如图所示。

反应ⅱ:

反应ⅲ:

②
 的锌氨溶液中,
的锌氨溶液中,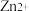 主要以
主要以 形式存在
形式存在下列说法
A.锌氨溶液中存在 的电离平衡和 的电离平衡和 的水解平衡 的水解平衡 |
B. 时,加入萃取剂 时,加入萃取剂 达到平衡后, 达到平衡后,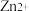 主要以 主要以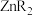 的形式存在 的形式存在 |
C. 由8到10,萃取剂中氨的含量增大的原因是反应ⅲ的平衡向正反应方向移动 由8到10,萃取剂中氨的含量增大的原因是反应ⅲ的平衡向正反应方向移动 |
D. 由8到6, 由8到6, 和 和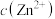 均增大,前者对反应ⅱ的影响小于后者 均增大,前者对反应ⅱ的影响小于后者 |
您最近一年使用:0次
6 . 乙烯合成的发展体现了化学科学与技术的不断进步。
(1)用烃类热裂解法制乙烯是乙烯工业化生产的开端。
①乙烷高温裂解制备乙烯(反应Ⅰ)的化学方程式是______ 。
②在裂解过程中伴随反应Ⅱ: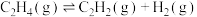 ,在高温下缩短
,在高温下缩短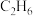 在反应器中的停留时间可提高乙烯的获取率,由此判断反应速率:反应Ⅰ
在反应器中的停留时间可提高乙烯的获取率,由此判断反应速率:反应Ⅰ______ 反应Ⅱ。(填“>”“<”或“=”)
(2)乙炔选择性加氢制乙烯是石油化工领域重要的发展阶段。
以钯(Pd)为催化剂可有效提高乙烯产率,在催化剂表面的反应机理如下图所示(吸附在催化剂表面的粒子用*标注)。______ 。
a.NP-Pd催化反应过程中步骤Ⅰ为放热反应
b.ISA-Pd催化反应过程中步骤Ⅱ为决速步骤
c.两种催化剂均能降低总反应的反应热
②吸附态乙烯( )脱离催化剂表面,可得到
)脱离催化剂表面,可得到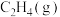 ,如未及时脱附,易在催化剂表面继续氢化经过渡态Ⅲ后而形成乙烷。制
,如未及时脱附,易在催化剂表面继续氢化经过渡态Ⅲ后而形成乙烷。制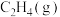 选择性较好的催化剂是
选择性较好的催化剂是______ 。
(3)以 为原料用不同的方法制乙烯有助于实现碳中和。
为原料用不同的方法制乙烯有助于实现碳中和。
I.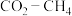 干气重整制乙烯。下图是2种投料比[
干气重整制乙烯。下图是2种投料比[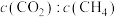 ,分别为1:1、2:1]下,反应温度对
,分别为1:1、2:1]下,反应温度对 平衡转化率影响的曲线。
平衡转化率影响的曲线。______ 。
②当曲线a、b对应的投料比达到相同的 平衡转化率时,对应的反应温度与投料比的关系是
平衡转化率时,对应的反应温度与投料比的关系是______ 。
Ⅱ.双金属串联催化剂电催化 制乙烯,装置示意图如图所示。
制乙烯,装置示意图如图所示。
已知:法拉第效率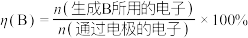
______ 。
④该环境下,测得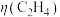 可达50%,若电路中通过1.2mol电子时,则产生乙烯的物质的量是
可达50%,若电路中通过1.2mol电子时,则产生乙烯的物质的量是______ mol。
(1)用烃类热裂解法制乙烯是乙烯工业化生产的开端。
①乙烷高温裂解制备乙烯(反应Ⅰ)的化学方程式是
②在裂解过程中伴随反应Ⅱ:
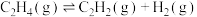 ,在高温下缩短
,在高温下缩短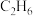 在反应器中的停留时间可提高乙烯的获取率,由此判断反应速率:反应Ⅰ
在反应器中的停留时间可提高乙烯的获取率,由此判断反应速率:反应Ⅰ(2)乙炔选择性加氢制乙烯是石油化工领域重要的发展阶段。
以钯(Pd)为催化剂可有效提高乙烯产率,在催化剂表面的反应机理如下图所示(吸附在催化剂表面的粒子用*标注)。
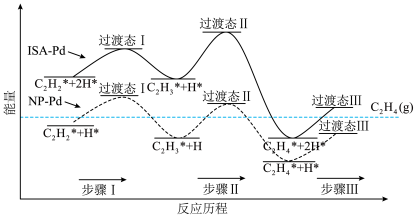
a.NP-Pd催化反应过程中步骤Ⅰ为放热反应
b.ISA-Pd催化反应过程中步骤Ⅱ为决速步骤
c.两种催化剂均能降低总反应的反应热
②吸附态乙烯(
 )脱离催化剂表面,可得到
)脱离催化剂表面,可得到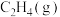 ,如未及时脱附,易在催化剂表面继续氢化经过渡态Ⅲ后而形成乙烷。制
,如未及时脱附,易在催化剂表面继续氢化经过渡态Ⅲ后而形成乙烷。制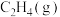 选择性较好的催化剂是
选择性较好的催化剂是(3)以
 为原料用不同的方法制乙烯有助于实现碳中和。
为原料用不同的方法制乙烯有助于实现碳中和。I.
 干气重整制乙烯。下图是2种投料比[
干气重整制乙烯。下图是2种投料比[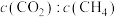 ,分别为1:1、2:1]下,反应温度对
,分别为1:1、2:1]下,反应温度对 平衡转化率影响的曲线。
平衡转化率影响的曲线。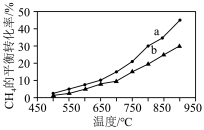
②当曲线a、b对应的投料比达到相同的
 平衡转化率时,对应的反应温度与投料比的关系是
平衡转化率时,对应的反应温度与投料比的关系是Ⅱ.双金属串联催化剂电催化
 制乙烯,装置示意图如图所示。
制乙烯,装置示意图如图所示。已知:法拉第效率
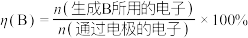
④该环境下,测得
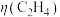 可达50%,若电路中通过1.2mol电子时,则产生乙烯的物质的量是
可达50%,若电路中通过1.2mol电子时,则产生乙烯的物质的量是
您最近一年使用:0次
解题方法
7 . 水热法制备 的流程如图,下列叙述正确的是
的流程如图,下列叙述正确的是
 的流程如图,下列叙述正确的是
的流程如图,下列叙述正确的是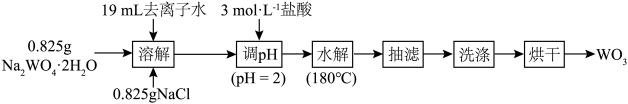
| A.本实验使用托盘天平称量 | B. 作反应的氧化剂 作反应的氧化剂 |
C.调 为2的目的是促进反应完全 为2的目的是促进反应完全 | D.用 溶液检验产品是否洗净 溶液检验产品是否洗净 |
您最近一年使用:0次
8 . 对下列实验操作的相关现象预测和所得的结论均正确的是
选项 | 实验操作 | 现象预测 | 结论 |
A | 向  黄色溶液中滴5~10滴 黄色溶液中滴5~10滴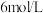  溶液 溶液 | 溶液颜色由黄色变为橙色 | 增大反应物浓度,平衡正向移动 |
B | 取适量食品包装袋中的抗氧化“铁粉包”样品,滴加适量稀硝酸溶解,再滴加几滴 溶液 溶液 | 溶液变红色 | 该铁粉已经完全被空气氧化 |
C | 向  溶液中滴加 溶液中滴加  溶液 溶液 | 有白色沉淀生成 |
|
D | 将3g铜片和适量稀 混合 混合 | 管口有红棕色气体 | 稀硝酸被Cu还原为 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
名校
解题方法
9 . 科学家设计了一种新型 金属框架,可通过静电作用选择性吸附氨气,对于捕捉氨气效果良好。
金属框架,可通过静电作用选择性吸附氨气,对于捕捉氨气效果良好。 和另一种材料
和另一种材料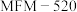 均可用于除去有害气体
均可用于除去有害气体 ,
,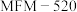 的孔径大小和形状恰能选择性固定
的孔径大小和形状恰能选择性固定 (如图所示)。
(如图所示)。 分子构型与乙烯类似。
分子构型与乙烯类似。
① ;
;
② 。
。
下列关于二者净化气体的说法中,正确的一项是
 金属框架,可通过静电作用选择性吸附氨气,对于捕捉氨气效果良好。
金属框架,可通过静电作用选择性吸附氨气,对于捕捉氨气效果良好。 和另一种材料
和另一种材料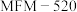 均可用于除去有害气体
均可用于除去有害气体 ,
,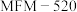 的孔径大小和形状恰能选择性固定
的孔径大小和形状恰能选择性固定 (如图所示)。
(如图所示)。
 分子构型与乙烯类似。
分子构型与乙烯类似。①
 ;
;②
 。
。下列关于二者净化气体的说法中,正确的一项是
A.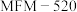 捕获的气体所有原子共平面, 捕获的气体所有原子共平面, 捕获的气体空间构型为正四面体 捕获的气体空间构型为正四面体 |
B.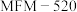 置入废气后,废气颜色变深, 置入废气后,废气颜色变深, 置入废气后,废气颜色变浅 置入废气后,废气颜色变浅 |
C.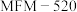 适宜在较低温度下净化气体, 适宜在较低温度下净化气体, 适宜在较高温度下净化气体 适宜在较高温度下净化气体 |
D.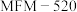 适宜在较高压强下净化气体, 适宜在较高压强下净化气体, 适宜在较低压强下净化气体 适宜在较低压强下净化气体 |
您最近一年使用:0次
2024-05-12更新
|
108次组卷
|
2卷引用:安徽师范大学附属中学2024届高三下学期5月测试化学试卷
10 . 应用(CO2催化加氢规模化生产甲醇是综合利用(CO2,实现“碳达峰”的有效措施之一、我国科学家研究发现二氧化碳电催化还原制甲醇的反应
 ,需通过以下两步实现:
,需通过以下两步实现:
I.

II.

(1)反应过程中各物质的相对能量变化情况如图所示: =
=___________ ,反应是快反应___________ (填“Ⅰ”或“Ⅱ”)
(2)若
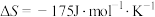 ,下列温度下反应能自发进行的是___________(填序号)。
,下列温度下反应能自发进行的是___________(填序号)。
(3)已知反应 ,在540K下,按初始投料
,在540K下,按初始投料 、
、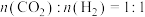 ,
, ,得到不同压强条件下H2的平衡转化率关系图:
,得到不同压强条件下H2的平衡转化率关系图:___________ (用字母表示)。
②N点在b曲线上,540K时的压强平衡常数Kp=___________ (MPa)-2(用平衡分压计算)。
(4)恒压下,分别向无分子筛膜和有分子筛膜(能选择性分离出)H?O)的两个同体积容器中通入1mol CO2和3mol H2,温度相同时,有分子筛膜的容器中甲醇的产率大于无分子筛膜的原因为___________ 。
(5)通过设计燃料电池,可以将甲醇中蕴藏的能量释放出来,酸性电解质溶液中,甲醇在电极上反应,产生碳氧化物COx。请写出燃料电池负极反应方程式___________ 。

 ,需通过以下两步实现:
,需通过以下两步实现:I.


II.


(1)反应过程中各物质的相对能量变化情况如图所示:

 =
=(2)若

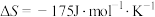 ,下列温度下反应能自发进行的是___________(填序号)。
,下列温度下反应能自发进行的是___________(填序号)。| A.0℃ | B.70℃ | C.150℃ | D.280°C |
(3)已知反应
 ,在540K下,按初始投料
,在540K下,按初始投料 、
、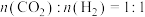 ,
, ,得到不同压强条件下H2的平衡转化率关系图:
,得到不同压强条件下H2的平衡转化率关系图:
②N点在b曲线上,540K时的压强平衡常数Kp=
(4)恒压下,分别向无分子筛膜和有分子筛膜(能选择性分离出)H?O)的两个同体积容器中通入1mol CO2和3mol H2,温度相同时,有分子筛膜的容器中甲醇的产率大于无分子筛膜的原因为
(5)通过设计燃料电池,可以将甲醇中蕴藏的能量释放出来,酸性电解质溶液中,甲醇在电极上反应,产生碳氧化物COx。请写出燃料电池负极反应方程式
您最近一年使用:0次


 与
与 发生了双水解
发生了双水解

