19-20高二·浙江·期末
1 . 下列说法正确 的是
| A.温度、浓度、压强、催化剂均能改变平衡常数 |
| B.弱电解质的电离是一个放热过程 |
| C.增大压强,化学平衡一定发生移动 |
| D.在一定温度下,当弱酸浓度相同时,电离常数越大,弱酸的电离程度就越大 |
您最近一年使用:0次
名校
解题方法
2 . 可逆反应aA(g)+bB(g)⇌ cC(g)+dD(g)△H同时符合下列两图中各曲线的是


| A.a+b>c+d T1>T2 △H>0 | B.a+b>c+d T1<T2 △H<0 |
| C.a+b<c+d T1>T2 △H>0 | D.a+b<c+d T1<T2 △H<0 |
您最近一年使用:0次
2019-12-19更新
|
1812次组卷
|
51卷引用:湖南省株洲市第一中学2022-2023学年高二上学期期末考试化学试题
湖南省株洲市第一中学2022-2023学年高二上学期期末考试化学试题黑龙江省哈尔滨市兆麟中学2023-2024学年高二上学期第一次月考化学试题广东省深圳市光明区高级中学2023-2024学年高二上学期10月月考化学试题广东省普宁二中实验学校2023-2024学年高二上学期第三次月考化学试题(已下线)2011届湖南省十二校联考高三上学期第一次考试化学试卷(已下线)2012-2013学年山东济宁鱼台一中高二上学期期中考试化学试卷(已下线)2013-2014学年安徽师大附中高二下学期期中考查化学试卷(已下线)2013-2014学年福建省长乐第一中学高二上学期第二次月考化学试卷2015-2016学年湖北省襄州区一中高二上学期10月月考化学试卷2016届黑龙江省哈尔滨三十二中高三上学期期末考试化学试卷2016-2017学年湖南省衡阳一中高二上10月月考化学卷2016-2017学年河南郸城高级中学高二上第二次考试化学卷河北省正定中学2016-2017学年高一下学期期末考试化学试题【区级联考】天津市武清区2018-2019学年高二上学期期中质量调查化学试题浙江省宁波市余姚中学2018-2019学年高二上学期期中考试化学试题陕西省渭南市渭南中学2018-2019学年高二上学期第三次月考化学试题山东省沂水外国语2018-2019学年高二上学期第三次月考化学试卷青海省海东市第二中学2018-2019学年高一下学期期中考试化学试题辽宁省大连海湾高级中学2019-2020学年高二上学期第一次质量检测化学试题福建省莆田四中2019-2020学年高二上学期期中考试化学试题广东省广州市2019-2020学年高二上学期期中模拟测试化学试题(二)步步为赢 高二化学寒假作业:作业五 化学平衡的图像分析海南省海南枫叶国际学校2019-2020学年高二上学期期中考试化学试题江苏省盐城市大丰区新丰中学2019-2020学年高二上学期期末考试化学试题云南省曲靖市会泽县第一中学2019-2020高二上学期开学考试化学试题河北省衡水市第十四中学2019-2020学年高二上学期第三次调研考试化学试题河北省新乐市第一中学2019-2020学年高二上学期第二次月考化学试题山东省枣庄市滕州市第一中学2019-2020高二上学期期末考试化学试题辽宁省大连市瓦房店市实验高级中学2020-2021学年高二上学期10月月考化学试题吉林省吉林市第二中学2021届高三上学期9月份考试化学试题山西省新绛县第二中学2019-2020学年高二上学期第一次考试化学试题天津市宝坻九中2020-2021学年高二上学期第一次月考化学试题天津市静海瀛海学校2020-2021学年高二上学期11月联考化学试题四川省成都市实验外国语学校(西区)2020-2021学年高二上学期12月月考化学测试卷福建省泉州市2020-2021学年高二上学期期末教学质量跟踪监测化学试题黑龙江省鹤岗市绥滨县第一中学2020-2021学年高二上学期期中考试化学(理)试题安徽省淮北市树人高级中学2020-2021学年高二上学期第一次联考化学试题陕西省咸阳市泾干中学2021-2022学年高二上学期第二次月考化学试题山西省运城市芮城中学2021-2022学年高二上学期阶段性月考化学试题天津市武清区梅厂中学2021-2022学年高二上学期阶段性练习化学试题河南省新蔡县第一高级中学2021-2022学年高二上学期9月月考化学试题湖南省临澧县第一中学2021-2022学年高二上学期期中段考化学试题(已下线)2.3.3 化学平衡中的图像问题(备作业)-【上好课】2021-2022学年高二化学同步备课系列(苏教版2019选择性必修1)湖南省常德市临澧县第一中学2021-2022学年高二上学期期中考试化学试题黑龙江省大庆市东风中学2021-2022学年高二下学期开学考试化学试题湖南省宁远县第一中学2022-2023学年高二上学期第一次适应性考试化学试题北京市陈经纶中学2022-2023学年高二10月月考化学试题广东省惠州市博罗县2022-2023学年高二上学期期中考试化学试题陕西省渭南市尚德中学2022-2023学年高二上学期第一次质量检测化学试题黑龙江省虎林市高级中学2022-2023学年高二上学期期中考试化学试题青海省西宁市海湖中学2023-2024学年高二下学期开学考试化学试卷
名校
解题方法
3 . 将一定量纯净的氨基甲酸铵置于特制的密闭真空容器中(假设容器体积不变,固体试样体积忽略不计),使其达到分解平衡:NH2COONH4(s)⇌2NH3(g)+CO2(g)。下的平衡数据列下表:下列说法正确的是
| 温度/°C | 15.0 | 20.0 | 25.0 | 30.0 | 35.0 |
| 平衡总压强/kPa | 5.7 | 8.3 | 12.0 | 17.1 | 24.0 |
| 平衡气体总浓度/10-3 molL-1 | 2.4 | 3.4 | 4.8 | 6.8 | 9.4 |
| A.该可逆反应达到平衡的标志之一是混合气体平均相对分子质量不变 |
| B.因该反应熵变(S)大于0,焓变(H)大于0,所以在低温下自发进行 |
| C.达到平衡后,若在恒温下压缩容器体积,氨基甲酸铵固体的质量增加 |
| D.根据表中数据,计算15.0°C时的NH3平衡浓度为1.6 molL-1 |
您最近一年使用:0次
2019-12-16更新
|
265次组卷
|
4卷引用:吉林省长春市东北师范大学附属中学2023-2024学年高二上学期10月期中化学试题
4 . 在一定温度下,向2L体积固定的密闭容器中加入1mol HI,发生反应:2HI⇌H2(g)+I2(g) ∆H>0,测得 的物质的量随时间变化如表,下列说法正确的是
的物质的量随时间变化如表,下列说法正确的是
 的物质的量随时间变化如表,下列说法正确的是
的物质的量随时间变化如表,下列说法正确的是 | 1 | 2 | 3 |
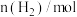 |  |  |  |
A.2 min内的HI的分解速度为  |
B.该温度下,平衡时HI的转化率为1 |
C.该温度下的平衡常数为 ,温度升高10℃后平衡常数为 ,温度升高10℃后平衡常数为 ,则K1>K2 ,则K1>K2 |
D.达平衡后其他条件不变,压缩容器体积,平衡不移动,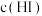 不变 不变 |
您最近一年使用:0次
2019-11-30更新
|
364次组卷
|
3卷引用:新疆阿克苏市实验中学2023-2024学年高二上学期第一次月考化学试题
名校
解题方法
5 . 面对目前世界范围内的能源危机,甲醇作为一种较好的可再生能源,具有广泛的应用前景。
(1)已知在常温常压下反应的热化学方程式:
①CO(g)+2H2(g)⇌CH3OH(g) ΔH1= -90 kJ·mol-1
②CO(g)+H2O(g)⇌CO2(g)+H2(g) ΔH2= -41 kJ·mol-1
写出由二氧化碳、氢气制备甲醇的热化学方程式:_______________________ 。
(2)在容积为VL的容器中充入amol CO与2amol H2,在催化剂作用下反应生成甲醇,平衡时的转化率与温度、压强的关系如图所示。
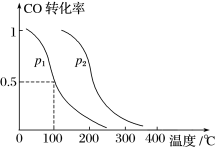
①p1________ p2(填“大于”、“小于”或“等于”);
②在温度、体积不变的情况下,再增加amol CO与2amol H2,达到新平衡时,CO的转化率________ (填“增大”、“减小”或“不变”),平衡常数_____ (填“增大”、“减小”或“不变”)。
(3)已知在T℃时,CO(g)+H2O(g)⇌CO2(g)+H2(g)的平衡常数K=0.32,在该温度下,已知c始(CO)=1 mol·L-1,c始(H2O)=1 mol·L-1,某时刻经测定CO的转化率为10%,则该反应________ (填“已经”或“没有”)达到平衡,此时刻υ正 ______ υ逆 (填“>”、“<”或“=”)。
(1)已知在常温常压下反应的热化学方程式:
①CO(g)+2H2(g)⇌CH3OH(g) ΔH1= -90 kJ·mol-1
②CO(g)+H2O(g)⇌CO2(g)+H2(g) ΔH2= -41 kJ·mol-1
写出由二氧化碳、氢气制备甲醇的热化学方程式:
(2)在容积为VL的容器中充入amol CO与2amol H2,在催化剂作用下反应生成甲醇,平衡时的转化率与温度、压强的关系如图所示。

①p1
②在温度、体积不变的情况下,再增加amol CO与2amol H2,达到新平衡时,CO的转化率
(3)已知在T℃时,CO(g)+H2O(g)⇌CO2(g)+H2(g)的平衡常数K=0.32,在该温度下,已知c始(CO)=1 mol·L-1,c始(H2O)=1 mol·L-1,某时刻经测定CO的转化率为10%,则该反应
您最近一年使用:0次
2019-11-24更新
|
722次组卷
|
5卷引用:章末检测卷(二)化学反应的方向、限度与速率
6 . 下列事实不能用勒夏特列原理解释的是( )
| A.工业制硫酸采用二氧化硫催化氧化,高压可以提高单位时间SO3的产量 |
| B.打开可乐瓶盖后看到有大量气泡冒出 |
| C.用饱和食盐水除去氯气中氯化氢杂质 |
| D.容器中有2HI(g) ⇌ H2(g)+I2(g),增大压强颜色变深 |
您最近一年使用:0次
2019-11-20更新
|
198次组卷
|
4卷引用:作业(九) 温度、催化剂对化学平衡的影响
名校
7 . 在一定条件下,下列可逆反应达到化学平衡:I2(g)+H2(g)⇌2HI(g);△H<0,要使混合气体的颜色加深,可以采取的方法是( )
| A.降低温度 | B.增大H2的浓度 | C.增大压强 | D.减小压强 |
您最近一年使用:0次
2017-12-16更新
|
790次组卷
|
7卷引用:第3课时 压强对化学平衡的影响 勒·夏特列原理
名校
8 . 在一密闭容器中反应aA(g) bB(g)达平衡后,测得c(B)为1mol/L。如保持温度不变,将容器体积变为原来的2倍,重新达到新的平衡时,c(B)变为0.6mol/L,则下列说法不正确的是
bB(g)达平衡后,测得c(B)为1mol/L。如保持温度不变,将容器体积变为原来的2倍,重新达到新的平衡时,c(B)变为0.6mol/L,则下列说法不正确的是
 bB(g)达平衡后,测得c(B)为1mol/L。如保持温度不变,将容器体积变为原来的2倍,重新达到新的平衡时,c(B)变为0.6mol/L,则下列说法不正确的是
bB(g)达平衡后,测得c(B)为1mol/L。如保持温度不变,将容器体积变为原来的2倍,重新达到新的平衡时,c(B)变为0.6mol/L,则下列说法不正确的是| A.平衡向正反应方向移动 | B.物质A的转化率增大 |
| C.物质B的质量分数增大 | D.a>b |
您最近一年使用:0次
2017-02-17更新
|
474次组卷
|
3卷引用:黑龙江省大庆市大庆中学2023-2024学年高二上学期10月月考化学试题



