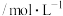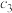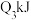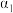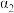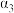1 . 甲烷、二氧化碳重整制合成气CO和H2,是一种有效实现碳达峰、碳中和的关键技术,也是近几年研究的热点之一。回答下列问题:
(1)已知:甲烷、二氧化碳重整工艺的相关反应如下:
①H2(g)+CO2(g)⇌H2O(g)+CO(g) ∆H1=+41kJ·mol−1
②2CO(g)⇌CO2(g)+C(s) ∆H2=−172kJ·mol−1
③CH4(g)⇌C(s)+2H2(g) ∆H3=+75kJ·mol−1
④CO(g)+H2(g)⇌C(s)+H2O(g) ∆H4=−131kJ·mol−1
则甲烷、二氧化碳重整制合成气的热化学方程式为CH4(g)+CO2(g)⇌2CO(g)+2H2(g) ∆H=_______ ;为了提高平衡时合成气的产率,反应条件应选择_______ (填标号)。
A.高压 B.低压 C.低温 D.高温
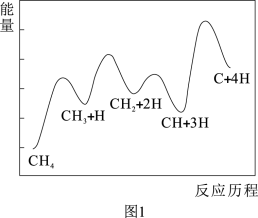
(2)一定条件下,CH4分解生成碳的反应历程如图1所示。该历程分4步进行,其中第_______ 步为放热反应,正反应活化能最大一步的反应方程式为_______ 。
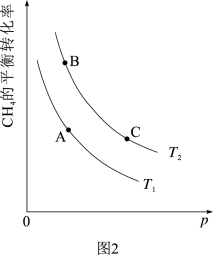
(3)CH4(g)+CO2(g)⇌2CO(g)+2H2(g),一定条件下CH4的平衡转化率与温度、压强的关系如图2所示(不考虑副反应),则T1_______ T2(填“>”或“<”),A、B、C三点处对应平衡常数(KA、KB、KC)的大小关系为_______ 。
(4)在恒压p=100kPa、初始投料n(CO2)/n(CH4)=1的条件下,甲烷、二氧化碳重整制合成气的过程中各平衡组分的物质的量随温度的变化如图3所示。
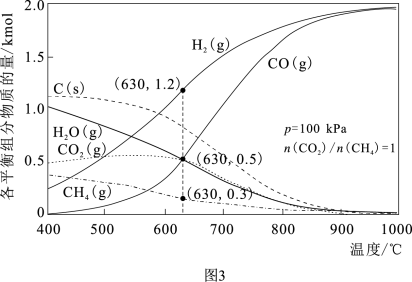
①随温度升高,产率增加,n(H2)/n(CO)减小,积碳含量_______ (填“增大”或“减小”)。
②在630℃时,反应CH4(g)+CO2(g)⇌2CO(g)+2H2(g)的平衡常数Kp=_______ kPa2(Kp是以分压表示的平衡常数,已知分压=总压×物质的量分数)。
(1)已知:甲烷、二氧化碳重整工艺的相关反应如下:
①H2(g)+CO2(g)⇌H2O(g)+CO(g) ∆H1=+41kJ·mol−1
②2CO(g)⇌CO2(g)+C(s) ∆H2=−172kJ·mol−1
③CH4(g)⇌C(s)+2H2(g) ∆H3=+75kJ·mol−1
④CO(g)+H2(g)⇌C(s)+H2O(g) ∆H4=−131kJ·mol−1
则甲烷、二氧化碳重整制合成气的热化学方程式为CH4(g)+CO2(g)⇌2CO(g)+2H2(g) ∆H=
A.高压 B.低压 C.低温 D.高温
(2)一定条件下,CH4分解生成碳的反应历程如图1所示。该历程分4步进行,其中第

(3)CH4(g)+CO2(g)⇌2CO(g)+2H2(g),一定条件下CH4的平衡转化率与温度、压强的关系如图2所示(不考虑副反应),则T1

(4)在恒压p=100kPa、初始投料n(CO2)/n(CH4)=1的条件下,甲烷、二氧化碳重整制合成气的过程中各平衡组分的物质的量随温度的变化如图3所示。

①随温度升高,产率增加,n(H2)/n(CO)减小,积碳含量
②在630℃时,反应CH4(g)+CO2(g)⇌2CO(g)+2H2(g)的平衡常数Kp=
您最近一年使用:0次
名校
2 . 在某容积可变的密闭容器中加入等量的A、B混合气体共4mol,发生反应:mA+nB pC,保持一定温度,改变压强分别达到平衡时,测得不同压强下气体A的物质的量浓度如表:
pC,保持一定温度,改变压强分别达到平衡时,测得不同压强下气体A的物质的量浓度如表:
下列说法一定正确的是
 pC,保持一定温度,改变压强分别达到平衡时,测得不同压强下气体A的物质的量浓度如表:
pC,保持一定温度,改变压强分别达到平衡时,测得不同压强下气体A的物质的量浓度如表:| 压强p/Pa | 2×105 | 5×105 | 1×106 | 3×106 |
| c(A)/mol·L-1 | 0.08 | 0.20 | 0.40 | 0.80 |
| A.保持一定温度,增大压强,平衡正向移动 |
B.当压强为3×106Pa时,此反应的平衡常数表达式:Kp=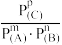 |
| C.反应平衡后若增大压强,则新平衡的逆反应速率大于原平衡的逆反应速率 |
| D.若再向体系中加入bmolB,当重新达到平衡时,体系中A、B、C总物质的量为(4+b)mol |
您最近一年使用:0次
2022-05-11更新
|
530次组卷
|
4卷引用:福建省连城县第一中学2022-2023学年高三上学期第二次月考化学试题
2022·河北·模拟预测
名校
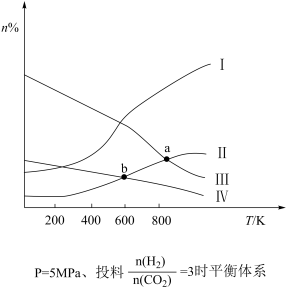
3 . 在固定容积的密闭容器中,按 与
与 的物质的量之比为1∶3进行投料,发生反应
的物质的量之比为1∶3进行投料,发生反应 ,在5MPa下测得不同温度下平衡体系中各种气体物质的量分数(n%)如图所示,已知曲线Ⅰ代表
,在5MPa下测得不同温度下平衡体系中各种气体物质的量分数(n%)如图所示,已知曲线Ⅰ代表 。下列说法正确的是
。下列说法正确的是
 与
与 的物质的量之比为1∶3进行投料,发生反应
的物质的量之比为1∶3进行投料,发生反应 ,在5MPa下测得不同温度下平衡体系中各种气体物质的量分数(n%)如图所示,已知曲线Ⅰ代表
,在5MPa下测得不同温度下平衡体系中各种气体物质的量分数(n%)如图所示,已知曲线Ⅰ代表 。下列说法正确的是
。下列说法正确的是
A.图中曲线交点a、b对应的平衡常数 |
B.图中曲线交点b对应的 转化率为40% 转化率为40% |
| C.平衡时,向体系中加入氢气,氢气转化率变大 |
D.若其他条件相同,甲为恒温恒容,乙为绝热恒容,达到平衡时 产率:甲>乙 产率:甲>乙 |
您最近一年使用:0次
2022-03-24更新
|
589次组卷
|
6卷引用:江西省南昌市第二中学2022-2023学年高三上学期第四次考试化学试题
江西省南昌市第二中学2022-2023学年高三上学期第四次考试化学试题湖南省怀化市沅陵县第二中学2021-2022学年高三下学期四月第一次调研考试化学试题(已下线)2022年河北省新高考测评卷(七)(已下线)2022年湖南卷高考真题变式题(11-14)天津市第二十五中学2022 -2023学年高二上学期期中考试化学试题广东省广州市第二中学2022-2023学年高三 上学期(11月25日)周测化学试题
名校
4 . 将NO2装入带活塞的密闭容器中,当反应2NO2(g) N2O4(g)达到平衡后,改变下列一个条件,其中叙述正确的是
N2O4(g)达到平衡后,改变下列一个条件,其中叙述正确的是
 N2O4(g)达到平衡后,改变下列一个条件,其中叙述正确的是
N2O4(g)达到平衡后,改变下列一个条件,其中叙述正确的是| A.压缩气体体积,平衡向右移动,混合气体颜色变浅 |
| B.恒温恒压时,充入稀有气体,平衡向左移动,混合气体颜色变深 |
| C.恒温恒容时,充入稀有气体,压强增大,平衡向右移动,混合气体的颜色变浅 |
| D.升高温度,气体颜色加深,则此反应为放热反应 |
您最近一年使用:0次
2022-03-22更新
|
461次组卷
|
5卷引用:陕西省渭南高级中学2021-2022学年高一下学期第三阶段考试化学试题
陕西省渭南高级中学2021-2022学年高一下学期第三阶段考试化学试题甘肃省天水市第二中学2023-2024学年高二上学期第一次月考化学试题陕西省宝鸡市长岭中学2021-2022学年高二上学期期中考试化学试题(已下线)【2022】【高二上】【期中考】【高中化学】60(已下线)【2022】【高二化学】【期中考】-179
名校
5 . 某温度下,向容积为10L的恒容密闭容器中充入2molM和4molN,发生反应M(g)十2N(g) P(g)+xR(g) ΔH=-akJ·mol-1(a>0)。反应过程中测得气体N的物质的量浓度变化如图所示。已知反应进行到8min时达到平衡状态,若平衡后降低温度,混合气体的平均相对分子质量将增大(x为正整数),下列说法正确的是
P(g)+xR(g) ΔH=-akJ·mol-1(a>0)。反应过程中测得气体N的物质的量浓度变化如图所示。已知反应进行到8min时达到平衡状态,若平衡后降低温度,混合气体的平均相对分子质量将增大(x为正整数),下列说法正确的是
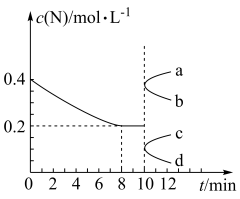
 P(g)+xR(g) ΔH=-akJ·mol-1(a>0)。反应过程中测得气体N的物质的量浓度变化如图所示。已知反应进行到8min时达到平衡状态,若平衡后降低温度,混合气体的平均相对分子质量将增大(x为正整数),下列说法正确的是
P(g)+xR(g) ΔH=-akJ·mol-1(a>0)。反应过程中测得气体N的物质的量浓度变化如图所示。已知反应进行到8min时达到平衡状态,若平衡后降低温度,混合气体的平均相对分子质量将增大(x为正整数),下列说法正确的是
| A.该反应中,化学计量数x=3 |
| B.反应达到平衡后,仅增大压强,平衡常数也增大 |
| C.8min时,该反应的平衡常数K=2.5 |
| D.10min时,仅将容器容积扩大至原来的两倍,则气体N的物质的量浓度的变化曲线为a |
您最近一年使用:0次
2021-12-16更新
|
601次组卷
|
2卷引用:河南省南阳地区 2021-2022学年高二上学期 12 月阶段检测化学试题
名校
6 . 在温度相同、容积均为2L的3个恒容密闭容器中,按不同方式投入反应物,保持恒温,测得反应达到平衡时的有关数据如下。下列说法正确的是
已知
已知
容器 | 甲 | 乙 | 丙 |
反应物投入量 |
|
|
|
|
|
|
|
反应的能量变化 | 放出 | 放出 | 吸收 |
体系压强/Pa | P1 | P2 | P3 |
反应物转化率 |
|
|
|
A.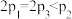 |
B.达到平衡时丙容器中 的体积分数最大 的体积分数最大 |
C.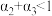 |
D.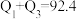 |
您最近一年使用:0次
2021-12-02更新
|
891次组卷
|
9卷引用:吉林省长春汽车经济开发区第六中学2018-2019学年高二上学期第一次月考化学试题
吉林省长春汽车经济开发区第六中学2018-2019学年高二上学期第一次月考化学试题【全国百强校】福建省厦门市双十中学2018-2019学年高二下学期第一次月考化学试题湖南省娄底市双峰县第一中学2020-2021学年高二上学期9月入学考试化学试题选择性必修1(SJ)专题2易错疑难集训(二)山东省滕州第一中学2021-2022学年高二上学期第一学段模块考试(期中)化学试题宁夏六盘山高级中学2021-2022学年高二上学期期中考试化学试题山东省济南市商河县第一中学2021-2022学年高三上学期11月期中考试化学试题浙江省宁波市余姚中学2020-2021学年高二上学期期中考试化学试题山东省威海乳山市第一中学2022-2023学年高二下学期开学考试化学试题
7 . 下列说法正确的是
A.一定条件下,在体积为10 L的密闭容器中充入1 mol X和1 mol Y进行反应:2X(g)+Y(g)⇌Z(g)达到平衡,若将容器体积变为20 L,则Z的平衡浓度等于原来的  |
| B.C(s)+H2O(g)⇌H2(g)+CO(g),碳的质量不再改变说明反应已达平衡 |
| C.若压强不再随时间变化时能说明反应2A(?)+B(g)⇌2C(?)已达平衡,则A、C不能同时是气体 |
| D.1 mol N2和3 mol H2反应达到平衡时H2转化率为10%,放出的热量为Q1;在相同温度和压强下,当2mol NH3分解为N2和H2的转化率为10%时,吸收的热量为Q2,Q2不等于Q1 |
您最近一年使用:0次
2021-10-15更新
|
537次组卷
|
2卷引用:吉林省长春市榆树市实验高级中学校2021-2022学年高二上学期第一次月考化学试题
8 . “绿水青山就是金山银山”,因此研究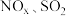 等大气污染物的妥善处理具有重要意义。
等大气污染物的妥善处理具有重要意义。
(1)燃煤发电厂常利用反应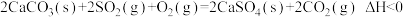 ,对煤进行脱硫处理来减少
,对煤进行脱硫处理来减少 的排放。对于该反应,在
的排放。对于该反应,在 时,借助传感器测得反应在不同时间点上各物质的浓度如表:
时,借助传感器测得反应在不同时间点上各物质的浓度如表:
 内,平均反应速率
内,平均反应速率
_______  ;当升高温度,该反应的平衡常数K
;当升高温度,该反应的平衡常数K_______ (填“增大”“减小”或“不变")。
(2) 主要来自于汽车尾气的排放,包含
主要来自于汽车尾气的排放,包含 和
和 ,有人提出用活性炭对
,有人提出用活性炭对 进行吸附,发生反应
进行吸附,发生反应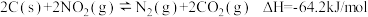 。某实验室模拟该反应,在密闭容器中加入足量的C和一定量的
。某实验室模拟该反应,在密闭容器中加入足量的C和一定量的 气体,维持温度为
气体,维持温度为 ,如图为不同压强下,该反应经过相同时间,
,如图为不同压强下,该反应经过相同时间, 的转化率随压强变化的示意图。
的转化率随压强变化的示意图。
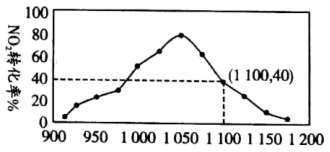
①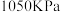 前,反应中
前,反应中 转化率随着压强增大而增大的原因
转化率随着压强增大而增大的原因_______ 。
②用某物质的平衡分压代替其物质的量浓度也可以表示化学平衡常数(记作 )。在
)。在 、
、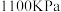 时,该反应的化学平衡常数
时,该反应的化学平衡常数
_______ (计算结果保留小数点后两位)。已知:气体分压(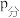 )=气体总压(
)=气体总压(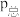 )×体积分数。
)×体积分数。
(3)为避免汽车尾气中的有害气体对大气的污染,需给汽车安装尾气净化装置。在净化装置中 和
和 发生反应
发生反应 ,生成无毒的
,生成无毒的 和
和 。实验测得,
。实验测得,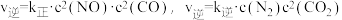 (
( 、
、 为速率常数,只与温度有关)。
为速率常数,只与温度有关)。
①达到平衡后,仅升高温度, 增大的倍数
增大的倍数_______ (填“>”“<”或“=”) 增大的倍数。
增大的倍数。
②若在 的密闭容器中充入
的密闭容器中充入 和
和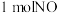 ,在一定温度下达到平衡时,
,在一定温度下达到平衡时, 的转化率为
的转化率为 ,则
,则
_______ 。
 等大气污染物的妥善处理具有重要意义。
等大气污染物的妥善处理具有重要意义。(1)燃煤发电厂常利用反应
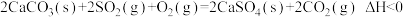 ,对煤进行脱硫处理来减少
,对煤进行脱硫处理来减少 的排放。对于该反应,在
的排放。对于该反应,在 时,借助传感器测得反应在不同时间点上各物质的浓度如表:
时,借助传感器测得反应在不同时间点上各物质的浓度如表: | 0 | 10 | 20 | 30 | 40 | 50 |
 | 1.00 | 0.79 | 0.60 | 0.60 | 0.64 | 0.64 |
 | 0 | 0.42 | 0.80 | 0.80 | 0.88 | 0.88 |
 内,平均反应速率
内,平均反应速率
 ;当升高温度,该反应的平衡常数K
;当升高温度,该反应的平衡常数K(2)
 主要来自于汽车尾气的排放,包含
主要来自于汽车尾气的排放,包含 和
和 ,有人提出用活性炭对
,有人提出用活性炭对 进行吸附,发生反应
进行吸附,发生反应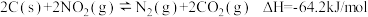 。某实验室模拟该反应,在密闭容器中加入足量的C和一定量的
。某实验室模拟该反应,在密闭容器中加入足量的C和一定量的 气体,维持温度为
气体,维持温度为 ,如图为不同压强下,该反应经过相同时间,
,如图为不同压强下,该反应经过相同时间, 的转化率随压强变化的示意图。
的转化率随压强变化的示意图。
①
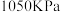 前,反应中
前,反应中 转化率随着压强增大而增大的原因
转化率随着压强增大而增大的原因②用某物质的平衡分压代替其物质的量浓度也可以表示化学平衡常数(记作
 )。在
)。在 、
、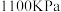 时,该反应的化学平衡常数
时,该反应的化学平衡常数
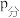 )=气体总压(
)=气体总压(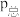 )×体积分数。
)×体积分数。(3)为避免汽车尾气中的有害气体对大气的污染,需给汽车安装尾气净化装置。在净化装置中
 和
和 发生反应
发生反应 ,生成无毒的
,生成无毒的 和
和 。实验测得,
。实验测得,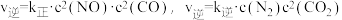 (
( 、
、 为速率常数,只与温度有关)。
为速率常数,只与温度有关)。①达到平衡后,仅升高温度,
 增大的倍数
增大的倍数 增大的倍数。
增大的倍数。②若在
 的密闭容器中充入
的密闭容器中充入 和
和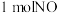 ,在一定温度下达到平衡时,
,在一定温度下达到平衡时, 的转化率为
的转化率为 ,则
,则
您最近一年使用:0次
9 . 将一定量纯净的氨基甲酸铵置于特制的密闭真空容器中(假设容器体积不变,固体试样体积忽略不计),使其达到分解平衡:NH2COONH4(s) ⇌2NH3(g)+CO2(g)。实验测得不同温度下的平衡数据列见表,下列说法错误的是
| 温度/℃ | 15.0 | 20.0 | 25.0 | 30.0 | 35.0 |
| 平衡总压强/kPa | 5.7 | 8.3 | 12.0 | 17.1 | 24.0 |
| 平衡气体总浓度/10-3 mol/L | 2.4 | 3.4 | 4.8 | 6.8 | 9.4 |
| A.达到平衡后,若在恒温下压缩容器体积,氨基甲酸铵固体的质量增大 |
| B.当混合气体平均相对分子质量为26时说明该反应已达平衡 |
| C.根据表中数据,计算25.0 ℃时分解的浓度平衡常数约为1.6×10-8 mol3/L3 |
| D.若保持温度和容器体积不变,平衡后再充入n(NH3)∶n(CO2)=2∶1,则再次达到平衡时c(NH3)不变 |
您最近一年使用:0次
2021-04-07更新
|
440次组卷
|
3卷引用:广西南宁市第三中学2020-2021学年高二下学期第一次月考化学(理)试题
名校
解题方法
10 . 以CO2、H2为原料合成CH3OH涉及的主要反应如下:
①CO2(g)+3H2(g)⇌CH3OH(g)+H2O(g) ∆H1=-49.5 kJ/mol
②CO(g)+2H2(g)⇌CH3OH(g) ∆H2=-90.4 kJ/mol
③CO2(g)+H2(g)⇌CO(g)+H2O(g) ∆H3
不同压强下,按照n(CO2):n(H2)=1:3投料,CO2平衡转化率随温度变化关系如图。下列说法正确的是
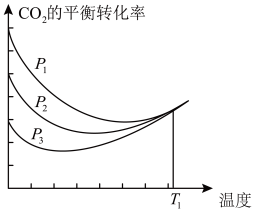
①CO2(g)+3H2(g)⇌CH3OH(g)+H2O(g) ∆H1=-49.5 kJ/mol
②CO(g)+2H2(g)⇌CH3OH(g) ∆H2=-90.4 kJ/mol
③CO2(g)+H2(g)⇌CO(g)+H2O(g) ∆H3
不同压强下,按照n(CO2):n(H2)=1:3投料,CO2平衡转化率随温度变化关系如图。下列说法正确的是

| A.∆H3=-40.9 kJ/mol |
| B.p1 < p2 < p3 |
| C.为同时提高CO2的平衡转化率和CH3OH的平衡产率,反应条件应选择高温、高压 |
| D.T1温度时,三条曲线几乎交于一点的原因是:该温度下,主要发生反应③ |
您最近一年使用:0次
2021-04-04更新
|
1261次组卷
|
10卷引用:河北省武邑中学2021届高考七模化学试题
河北省武邑中学2021届高考七模化学试题湖南省武冈市第一中学2021-2022学年高三下学期5月月考化学试题山东省烟台市龙口市2023-2024学年高二上学期10月统考化学试题北京市丰台区2021届高三一模化学试题(已下线)押山东卷第14题 化学反应速率和平衡-备战2021年高考化学临考题号押题(山东卷)黑龙江省大庆铁人中学2021-2022学年高二上学期开学考试化学试题湖南省邵阳市第二中学2021-2022学年高一下学期期末考试化学试题北京市顺义牛栏山第一中学2022-2023学年高二上学期期中考试化学试题北京市第一七一中学2023-2024学年高二上学期期中考试化学试题云南省保山市腾冲市第八中学2020-2021学年高二下学期期中考试化学试卷

 、
、
 、
、