名校
1 . 在一定温度下,向容积固定不变的密闭容器中充入a mol A,发生反应:2A(g)  B(g) ΔH<0。达平衡后再向容器中充入a mol A,再次达到平衡后,与原平衡比较,下列叙述不正确的是( )
B(g) ΔH<0。达平衡后再向容器中充入a mol A,再次达到平衡后,与原平衡比较,下列叙述不正确的是( )
 B(g) ΔH<0。达平衡后再向容器中充入a mol A,再次达到平衡后,与原平衡比较,下列叙述不正确的是( )
B(g) ΔH<0。达平衡后再向容器中充入a mol A,再次达到平衡后,与原平衡比较,下列叙述不正确的是( )| A.平均相对分子质量增大 |
| B.A的转化率提高 |
| C.A的质量分数增大 |
| D.反应放出的总热量大于原来的2倍 |
您最近一年使用:0次
2019-04-04更新
|
279次组卷
|
2卷引用:【全国百强校】福建省厦门外国语学校2018-2019学年高二下学期第一次月考化学试题
名校
2 . 用活性炭还原法可以处理氮氧化物。某研究小组向2L密闭容器中加入一定量的活性炭和NO,发生反应C(s)+2NO(g) 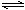 N2(g)+CO2(g) △H<0。在T1℃时,反应进行到不同时间测得各物质的浓度(mol/L)如表所示,则下列说法不正确的是
N2(g)+CO2(g) △H<0。在T1℃时,反应进行到不同时间测得各物质的浓度(mol/L)如表所示,则下列说法不正确的是
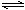 N2(g)+CO2(g) △H<0。在T1℃时,反应进行到不同时间测得各物质的浓度(mol/L)如表所示,则下列说法不正确的是
N2(g)+CO2(g) △H<0。在T1℃时,反应进行到不同时间测得各物质的浓度(mol/L)如表所示,则下列说法不正确的是| 时间/t(min) | 0 | 10 | 20 | 30 | 40 | 50 |
| NO | 1.00 | 0.68 | 0.50 | 0.50 | 0.60 | 0.60 |
| N2 | 0 | 0.16 | 0.25 | 0.25 | 0.30 | 0.30 |
| CO2 | 0 | 0.16 | 0.25 | 0.25 | 0.30 | 0.30 |
| A.10~20 min内,NO的平均反应速率为0.018mol/(L∙min) |
| B.T1℃时,该反应的平衡常数K=0.25 |
| C.保持与前30min的反应条件相同,再向容器中加入2molN2和2molNO,则平衡向左移动 |
| D.30min后,只改变了一个条件,根据上述表格判断,该条件可能为缩小容器体积 |
您最近一年使用:0次
2019-03-07更新
|
473次组卷
|
4卷引用:【全国百强校】福建省厦门双十中学2018-2019学年高二下学期第二次月考化学试题
【全国百强校】福建省厦门双十中学2018-2019学年高二下学期第二次月考化学试题天津汇文中学2022-2023学年高二上学期第一次阶段性测试化学试题【校级联考】江西省南康中学、于都中学2019届高三下学期第二次联考化学试题(已下线)课时35 化学反应速率及影响因素-2022年高考化学一轮复习小题多维练(全国通用)
名校
3 . 一定条件下,体积为2L的密闭容器中,2mol X和3mol Y进行反应:X(g)+Y(g) Z(g),经12s达到平衡,生成0.6molZ。下列说法正确的是
Z(g),经12s达到平衡,生成0.6molZ。下列说法正确的是
 Z(g),经12s达到平衡,生成0.6molZ。下列说法正确的是
Z(g),经12s达到平衡,生成0.6molZ。下列说法正确的是| A.以X浓度变化表示的反应速率为0.05 mol/(L•s) |
| B.其他条件不变,增大X的浓度,平衡右移,X的转化率增大 |
| C.其他条件不变,12s后将容器体积扩大为10L,Z的平衡浓度变为0.06mol/L |
| D.其他条件不变,若移走1molX和1.5molY,再达平衡时Z的物质的量小于0.3mol |
您最近一年使用:0次
2019-02-19更新
|
512次组卷
|
4卷引用:河北省武邑中学2019-2020学年高二下学期3月线上考试化学试题
名校
解题方法
4 . (1)在一定条件下氨气和氧气能发生反应生成氮气和水蒸气:4NH3(g)+3O2(g)=2N2(g)+6H2O(g) △H
查阅资料可得有关的化学键键能数据如下:
由此计算上述反应的反应热△H=___________ kJ·mol-1。
(2)已知:N2(g)+O2(g)=2NO(g) K1
N2(g)+3H2(g)=2NH3(g) K2
2H2(g)+O2(g)=2H2O(g) K3
注:K1、K2、K3分别为上述三个反应的平衡常数
回答下列问题:
①氨催化氧化反应(生成气态水)的平衡常数K为___________ (用K1、K2、K3表示)。
②一定条件下,将4molNH3和5.2molO2混合于容积为4L的恒容密闭容器中发生催化氧化反应,经过10s后达到平衡,测得NO的浓度为0.4mol/L则0到10s内,用NH3表示该反应的平均反应速率为___________ ,O2的转化率为___________ (用百分数表示,且保留小数点后一位),该反应的平衡常数为___________ (列出计算式即可)。
③若上述反应第一次达到平衡时,保持其他条件不变的情况下,只是将容器的体积扩大一倍,假定在25s后达到新的平衡。请在下图中用曲线表示15~30s这个阶段体系中NH3的浓度随时间变化的趋势。__________
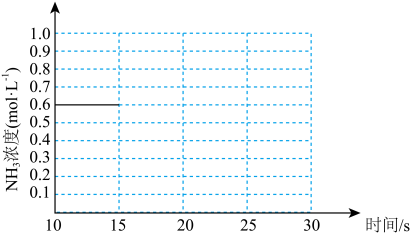
(3)下列有关该反应的说法正确的是___________ (填字母)。
A.恒温恒容,再充入4molNH3和5.2molO2,再次达到平衡时,NH3的转化率增大
B.恒温恒容,当容器内的密度保持不变时,反应达到了平衡
C.当混合气体的平均摩尔质量不变时,反应达到了平衡
D.当2v正(NO)=3v逆(H2O)时,反应达到了平衡
(4)工业上常用氨水吸收SO2,可生成(NH4)2SO3,请判断常温下(NH4)2SO3溶液的酸碱性并通过计算说明判断依据:_______________________________________________________ 。(已知:NH3·H2O的Kb=1.8×10-5;H2SO3的Ka1=1.3×10-2,Ka2=6.3×10-8)
查阅资料可得有关的化学键键能数据如下:
| 化学键 | N≡N | H-O | N-H | O=O |
| E/ (kJ·mol-1) | 946 | 463 | 391 | 496 |
由此计算上述反应的反应热△H=
(2)已知:N2(g)+O2(g)=2NO(g) K1
N2(g)+3H2(g)=2NH3(g) K2
2H2(g)+O2(g)=2H2O(g) K3
注:K1、K2、K3分别为上述三个反应的平衡常数
回答下列问题:
①氨催化氧化反应(生成气态水)的平衡常数K为
②一定条件下,将4molNH3和5.2molO2混合于容积为4L的恒容密闭容器中发生催化氧化反应,经过10s后达到平衡,测得NO的浓度为0.4mol/L则0到10s内,用NH3表示该反应的平均反应速率为
③若上述反应第一次达到平衡时,保持其他条件不变的情况下,只是将容器的体积扩大一倍,假定在25s后达到新的平衡。请在下图中用曲线表示15~30s这个阶段体系中NH3的浓度随时间变化的趋势。

(3)下列有关该反应的说法正确的是
A.恒温恒容,再充入4molNH3和5.2molO2,再次达到平衡时,NH3的转化率增大
B.恒温恒容,当容器内的密度保持不变时,反应达到了平衡
C.当混合气体的平均摩尔质量不变时,反应达到了平衡
D.当2v正(NO)=3v逆(H2O)时,反应达到了平衡
(4)工业上常用氨水吸收SO2,可生成(NH4)2SO3,请判断常温下(NH4)2SO3溶液的酸碱性并通过计算说明判断依据:
您最近一年使用:0次
2019-02-07更新
|
473次组卷
|
3卷引用:四川省泸州市泸县第二中学2020届高三上学期第一次月考理综化学试题
10-11高二下·浙江杭州·期中
5 . 如图所示,甲、乙之间的隔板K可以左右移动,甲中充入2 mol A和1 mol B,乙中充入2 mol C和1 mol He,此时K停在0处。在一定条件下发生可逆反应:2A(g)+B(g) 2C(g),反应达到平衡后,恢复到反应发生前时的温度。下列有关说法不正确的是
2C(g),反应达到平衡后,恢复到反应发生前时的温度。下列有关说法不正确的是
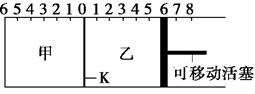
 2C(g),反应达到平衡后,恢复到反应发生前时的温度。下列有关说法不正确的是
2C(g),反应达到平衡后,恢复到反应发生前时的温度。下列有关说法不正确的是
| A.根据隔板K滑动与否可判断左右两边的反应是否达到平衡 |
| B.达到平衡后,隔板K最终停留在左侧刻度0~2之间 |
| C.达到平衡时,甲容器中C的物质的量大于乙容器中C的物质的量 |
| D.若平衡时K停留在左侧1处,则活塞仍停留在右侧6处 |
您最近一年使用:0次
名校
6 . 一定条件下,CH4与H2O(g)发生反应:CH4(g)+ H20(g) C0(g)+ 3H2(g),设起始n(H2O)/n(CH4)=Z,在恒压下,平衡时φ(CH4)的体积分数与Z和T(温度)的关系如图所示。下列说法正确的是
C0(g)+ 3H2(g),设起始n(H2O)/n(CH4)=Z,在恒压下,平衡时φ(CH4)的体积分数与Z和T(温度)的关系如图所示。下列说法正确的是

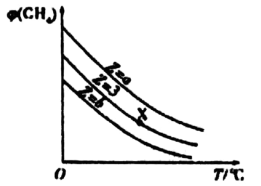
 C0(g)+ 3H2(g),设起始n(H2O)/n(CH4)=Z,在恒压下,平衡时φ(CH4)的体积分数与Z和T(温度)的关系如图所示。下列说法正确的是
C0(g)+ 3H2(g),设起始n(H2O)/n(CH4)=Z,在恒压下,平衡时φ(CH4)的体积分数与Z和T(温度)的关系如图所示。下列说法正确的是 

| A.该反应的焓变△H<0 |
| B.图中X点对应的平衡浪合物中n(H2O)/n(CH4)= 3 |
| C.图中Z的大小为a<3<b |
| D.温度不变时,图中X点对应的平衡在加压后φ(CO)增大 |
您最近一年使用:0次
2018-12-31更新
|
237次组卷
|
2卷引用:【全国百强校】福建省厦门市双十中学2018-2019学年高二下学期第一次月考化学试题
名校
7 . 在一定条件下,体积不变的密闭容器中,发生可逆反应2SO2(g)+O2(g)  2SO3(g) ΔH<0,达到平衡后,当单独改变下列条件后,有关叙述正确的是
2SO3(g) ΔH<0,达到平衡后,当单独改变下列条件后,有关叙述正确的是
 2SO3(g) ΔH<0,达到平衡后,当单独改变下列条件后,有关叙述正确的是
2SO3(g) ΔH<0,达到平衡后,当单独改变下列条件后,有关叙述正确的是| A.增大压强,平衡正向移动,此反应的ΔH仍保持不变 |
| B.增大O2浓度,SO2的平衡转化率减小 |
| C.降低温度,化学平衡常数减小 |
| D.升高温度,SO2的转化率一定增大 |
您最近一年使用:0次
2018-11-03更新
|
229次组卷
|
3卷引用:河北省唐山市第一中学2018-2019学年高二上学期10月月考化学试题
名校
8 . 对于平衡体系mA(g)+nB(g)⇌pC(g)+qD(g) △H=b kJ·mol-1,下列结论中错误的是
| A.若温度不变,将容器的体积缩小到原来的一半,达到新平衡时A的浓度为原来的2.2倍,则m+n<p+q |
| B.若平衡时,A、B的转化率相等,说明反应开始时,A、B的物质的量之比为m:n |
| C.保持其它条件不变,升高温度,D的体积分数增大说明该反应的△H<0。 |
| D.若m+n=p+q,则向含有a mol气体的平衡体系中再加入a mol的B,达到新平衡时,气体的总物质的量等于2a mol |
您最近一年使用:0次
2018-07-25更新
|
284次组卷
|
7卷引用:河北省唐山市第一中学2018-2019学年高二上学期10月月考化学试题
名校
9 . 反应N2O4(g) 2NO2(g) △H=+57 kJ·mol-1,在温度为T1、T2时,平衡体系中NO2的体积分数随压强变化曲线如图所示。下列说法正确的是
2NO2(g) △H=+57 kJ·mol-1,在温度为T1、T2时,平衡体系中NO2的体积分数随压强变化曲线如图所示。下列说法正确的是

 2NO2(g) △H=+57 kJ·mol-1,在温度为T1、T2时,平衡体系中NO2的体积分数随压强变化曲线如图所示。下列说法正确的是
2NO2(g) △H=+57 kJ·mol-1,在温度为T1、T2时,平衡体系中NO2的体积分数随压强变化曲线如图所示。下列说法正确的是
| A.a、c两点的反应速率:a>c |
| B.a、c两点气体的颜色:a深,c浅 |
| C.b、c两点的转化率:b>c |
| D.由b点到a点,可以用加热的方法 |
您最近一年使用:0次
2018-07-25更新
|
3284次组卷
|
11卷引用:吉林省长春汽车经济开发区第六中学2018-2019学年高二上学期第一次月考化学试题
吉林省长春汽车经济开发区第六中学2018-2019学年高二上学期第一次月考化学试题安徽省阜阳市第三中学2018-2019学年高一下学期第二次调研考试化学试题福建省福州第三中学2022-2023学年高二上学期半期考试化学试题福建省漳州市正兴学校2023-2024学年高二上学期10月月考化学试卷【全国校级联考】辽宁省抚顺市六校2017-2018学年高一下学期期末考试化学试题安徽省宣城市郎溪县郎溪中学2018-2019学年高二上学期直升部返校考化学试题四川省成都市外国语学校2019届高三上学期开学考试化学试题福建省莆田市私立一中2019-2020学年高二上学期期中考试化学试题夯基提能2020届高三化学选择题对题专练——选修四化学反应原理——化学反应速率及其影响因素专练(已下线)2.3.3 温度对化学平衡的影响(基础练)——2020-2021学年高二化学上学期十分钟同步课堂专练(苏教版选修4)黑龙江省大庆市东风中学2021-2022学年高二上学期期中考试化学试题
名校
10 . 氮及其化合物在工业生产中有广泛用。
(1)稀硝酸与二价活泼金属M反应制备硝酸盐,当反应物之比n(HNO3)∶n(M)=5∶2时,还原产物为___ (填化学式)。
(2)连二次硝酸(HO-N=N-OH)是一种二元弱酸,向0.1 mol·L-1连二次硝酸钠(Na2N2O2)溶液中滴加酚酞,溶液变红色 ,用离子方程式表示其主要原因:__________________ 。
(3)已知以下热化学方程式: 2N2O5(g) 4NO2(g)+O2(g) ΔH1
4NO2(g)+O2(g) ΔH1
2NO(g)+O2(g)=2NO2(g) ΔH2
3NO2(g) N2O5(g)+NO(g) ΔH3
N2O5(g)+NO(g) ΔH3
①ΔH3=______________________ (用ΔH1、ΔH2表示)。
②一定温度下,在恒容密闭容器中进行反应:3NO2(g) N2O5(g)+NO(g),下列表明反应已达到平衡状态的是
N2O5(g)+NO(g),下列表明反应已达到平衡状态的是________ 。
A.容器内总压强保持不变 B.容器内气体密度保持不变
C.v正(NO2)∶v逆(N2O5)=3∶1 D. 保持不变
保持不变
(4)在密闭容器中充入NO,发生反应2NO(g) N2(g)+O2(g) ΔH,达到平衡之后,升高温度,平衡常数K减小。
N2(g)+O2(g) ΔH,达到平衡之后,升高温度,平衡常数K减小。
①ΔH________ 0。(填“>”“<”或“=”)
②上述反应达到平衡之后,仅缩小容器体积,下列推断正确的是_________ 。
A.NO的浓度不再变化
B.NO的转化率不再变化
C.正、逆反应速率不再变化
D.容器内气体压强不再变化
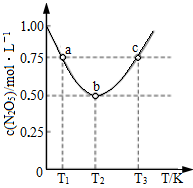
(5)在2 L恒容密闭容器中投入一定量的N2O5(g),发生反应:2N2O5(g) 4NO2(g)+O2(g),测得c(N2O5)与温度关系如图所示。T2 K时,该反应的平衡常数K为
4NO2(g)+O2(g),测得c(N2O5)与温度关系如图所示。T2 K时,该反应的平衡常数K为_________ 。若平衡时温度不变,再向容器中充入少量的N2O5气体,达到新平衡时N2O5的转化率会_________ (填“增大”“减小”或“不变”)。
(1)稀硝酸与二价活泼金属M反应制备硝酸盐,当反应物之比n(HNO3)∶n(M)=5∶2时,还原产物为
(2)连二次硝酸(HO-N=N-OH)是一种二元弱酸,向0.1 mol·L-1连二次硝酸钠(Na2N2O2)溶液中滴加酚酞,溶液变红色 ,用离子方程式表示其主要原因:
(3)已知以下热化学方程式: 2N2O5(g)
 4NO2(g)+O2(g) ΔH1
4NO2(g)+O2(g) ΔH12NO(g)+O2(g)=2NO2(g) ΔH2
3NO2(g)
 N2O5(g)+NO(g) ΔH3
N2O5(g)+NO(g) ΔH3①ΔH3=
②一定温度下,在恒容密闭容器中进行反应:3NO2(g)
 N2O5(g)+NO(g),下列表明反应已达到平衡状态的是
N2O5(g)+NO(g),下列表明反应已达到平衡状态的是A.容器内总压强保持不变 B.容器内气体密度保持不变
C.v正(NO2)∶v逆(N2O5)=3∶1 D.
 保持不变
保持不变(4)在密闭容器中充入NO,发生反应2NO(g)
 N2(g)+O2(g) ΔH,达到平衡之后,升高温度,平衡常数K减小。
N2(g)+O2(g) ΔH,达到平衡之后,升高温度,平衡常数K减小。①ΔH
②上述反应达到平衡之后,仅缩小容器体积,下列推断正确的是
A.NO的浓度不再变化
B.NO的转化率不再变化
C.正、逆反应速率不再变化
D.容器内气体压强不再变化
(5)在2 L恒容密闭容器中投入一定量的N2O5(g),发生反应:2N2O5(g)
 4NO2(g)+O2(g),测得c(N2O5)与温度关系如图所示。T2 K时,该反应的平衡常数K为
4NO2(g)+O2(g),测得c(N2O5)与温度关系如图所示。T2 K时,该反应的平衡常数K为
您最近一年使用:0次



