1 . 一定温度下,向三个容积不等的恒容密闭容器中分别投入2molNOCl,发生反应: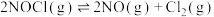 。反应tmin后,三个容器中NOCl的转化率如图中A、B、C三点。下列叙述正确的是
。反应tmin后,三个容器中NOCl的转化率如图中A、B、C三点。下列叙述正确的是
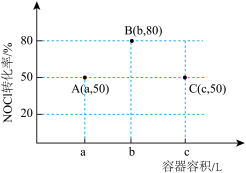
| A.A点加入适当催化剂,可以提高NOCl的转化率 |
| B.容积为aL的容器达到平衡后再投入1molNOCl、1molNO,平衡向左移动 |
| C.A、B两点的压强之比为25:28 |
| D.容积为cL的容器NOCl的平衡转化率大于80% |
您最近一年使用:0次
名校
2 . 以下说法中操作正确、能达到目的且判断正确的是
选项 | 操作 | 目的 | 判断 |
A | 向 | 使 | 错误,根据反应 |
B | 合成氨时在经济性良好的范围内选择尽可能高的压强 | 增加 转化率 转化率 | 正确,压强增大使得反应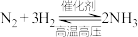 向右进行 向右进行 |
C | 向两支盛有2ml0.2mol/L的乙二酸试管中滴加1ml浓度分别为0.1mol/L和0.2mol/L的 溶液 溶液 | 探究反应物浓度对反应速率的影响 | 正确,浓度越大反应速率越快, 褪色越快 褪色越快 |
D | 向滴有KSCN溶液的 溶液中加入 溶液中加入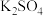 固体 固体 | 探究浓度对平衡的影响 | 正确,增加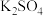 浓度,使 浓度,使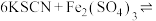 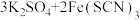 平衡移动 平衡移动 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
名校
解题方法
3 . 近年来,碳中和、碳达峰成为热点。以CO2、H2为原料生产甲醇是一种有效利用二氧化碳的途径。
途径一:涉及的反应有
I.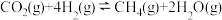
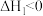
Ⅱ.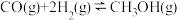
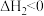
III.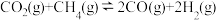
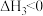
(1)关于反应I,下列描述正确的是___________(填字母序号)。
(2)根据反应I~Ⅲ,计算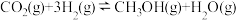 ΔH=
ΔH=___________ 。
(3)工业中,对于反应I,通常同时存在副反应IV: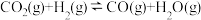 ΔH4。在一定条件下,在合成塔中充入一定量CO2和H2。不同压强时,CO2的平衡转化率如图a所示。当气体总压强恒定为1MPa时,平衡时各物质的物质的量分数如图b所示。
ΔH4。在一定条件下,在合成塔中充入一定量CO2和H2。不同压强时,CO2的平衡转化率如图a所示。当气体总压强恒定为1MPa时,平衡时各物质的物质的量分数如图b所示。

①图a中,相同温度下,压强越大,CO2的平衡转化率越大,其原因是___________ 。
②由图b可知,ΔH4___________ 0(填“>”、“<”或“=”);H2的物质的量分数随温度升高而增大,原因是___________ 。
(4)在一定条件下(温度为T1℃),往恒容密闭容器中充入1.0molCO2和4.0molH2,发生反应I,初始压强为p0,5min达到平衡,压强为0.8p0,则CO2的平衡转化率为___________ 。
途径二:涉及的反应有
I.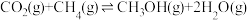
Ⅱ.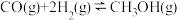
III.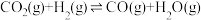
(5)一定条件下,向体积为VL的恒容密闭容器中通入1molCO2和3molH2发生上述反应,达到平行时,容器中CH3OH(g)为amol,CO为bmol,反应Ⅲ的平衡常数为___________ (用含a、b、V的代数式表示)。
途径一:涉及的反应有
I.
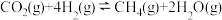
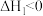
Ⅱ.
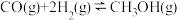
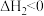
III.
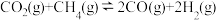
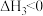
(1)关于反应I,下列描述正确的是___________(填字母序号)。
| A.恒容下达平衡状态时,再充入少量氦气,正逆反应速率不变 |
| B.当混合气体的平均摩尔质量不再发生变化时,反应达平衡状态 |
| C.当反应达平衡状态时,2V正(H2)=V逆(H2O) |
| D.恒温下缩小容器体积,反应物的活化分子百分数增大 |
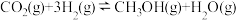 ΔH=
ΔH=(3)工业中,对于反应I,通常同时存在副反应IV:
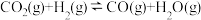 ΔH4。在一定条件下,在合成塔中充入一定量CO2和H2。不同压强时,CO2的平衡转化率如图a所示。当气体总压强恒定为1MPa时,平衡时各物质的物质的量分数如图b所示。
ΔH4。在一定条件下,在合成塔中充入一定量CO2和H2。不同压强时,CO2的平衡转化率如图a所示。当气体总压强恒定为1MPa时,平衡时各物质的物质的量分数如图b所示。
①图a中,相同温度下,压强越大,CO2的平衡转化率越大,其原因是
②由图b可知,ΔH4
(4)在一定条件下(温度为T1℃),往恒容密闭容器中充入1.0molCO2和4.0molH2,发生反应I,初始压强为p0,5min达到平衡,压强为0.8p0,则CO2的平衡转化率为
途径二:涉及的反应有
I.
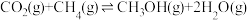
Ⅱ.
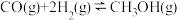
III.
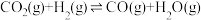
(5)一定条件下,向体积为VL的恒容密闭容器中通入1molCO2和3molH2发生上述反应,达到平行时,容器中CH3OH(g)为amol,CO为bmol,反应Ⅲ的平衡常数为
您最近一年使用:0次
名校
解题方法
4 . 向体积均为1L的两恒容容器中分别充入2molX和1molY发生反应: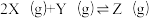
 ,其中甲为绝热过程,乙为恒温过程,两反应体系的压强随时间的变化曲线如图所示。下列说法正确的是
,其中甲为绝热过程,乙为恒温过程,两反应体系的压强随时间的变化曲线如图所示。下列说法正确的是
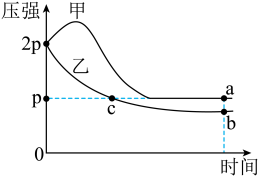
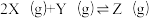
 ,其中甲为绝热过程,乙为恒温过程,两反应体系的压强随时间的变化曲线如图所示。下列说法正确的是
,其中甲为绝热过程,乙为恒温过程,两反应体系的压强随时间的变化曲线如图所示。下列说法正确的是
| A.△H>0 | B.气体的总物质的量:na>nc |
| C.a点平衡常数:K<12 | D.反应速率:Va正>Vb正 |
您最近一年使用:0次
名校
5 . 二氧化碳一甲烷重整反应制备合成气(H2+CO)是一种生产高附加值化学品的低碳过程。该过程存在如下化学反应:
①

②
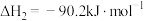
③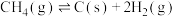
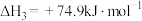
④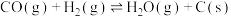
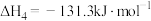
回答下列问题:
(1)
_______ ,反应①_______ 正向自发进行(填标号)。
A.低温下能 B.高温下能 C.任何温度下都能 D.任何温度下都不能
(2)反应体系总压强分别为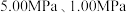 和
和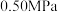 时,
时, 平衡转化率随反应温度变化如图所示,则代表反应体系总压强为
平衡转化率随反应温度变化如图所示,则代表反应体系总压强为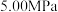 的曲线是
的曲线是_______ (填“Ⅰ”“Ⅱ”或“Ⅲ”),判断依据是_______ 。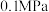 时,平衡时部分组分的物质的量随反应温度变化如图所示。随反应温度的升高,
时,平衡时部分组分的物质的量随反应温度变化如图所示。随反应温度的升高, 的物质的量先增加后减少,主要原因是
的物质的量先增加后减少,主要原因是_______ 。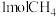 和
和 ,达到平衡时
,达到平衡时 的转化率为
的转化率为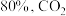 的转化率为
的转化率为 ,碳单质的物质的量为
,碳单质的物质的量为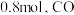 的物质的量为
的物质的量为_______  ,反应①用摩尔分数表示的平衡常数
,反应①用摩尔分数表示的平衡常数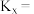
_______ (结果保留两位小数)。
上述平衡时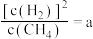 ,向体系通入
,向体系通入 气,重新达到平衡时,
气,重新达到平衡时,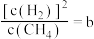 ,则a
,则a_______ b(填“>”“<”或“=”)。(已知反应 的
的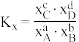 ,物质
,物质 的摩尔分数
的摩尔分数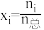 )
)
①


②

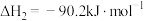
③
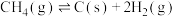
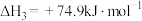
④
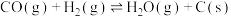
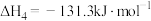
回答下列问题:
(1)

A.低温下能 B.高温下能 C.任何温度下都能 D.任何温度下都不能
(2)反应体系总压强分别为
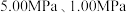 和
和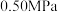 时,
时, 平衡转化率随反应温度变化如图所示,则代表反应体系总压强为
平衡转化率随反应温度变化如图所示,则代表反应体系总压强为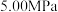 的曲线是
的曲线是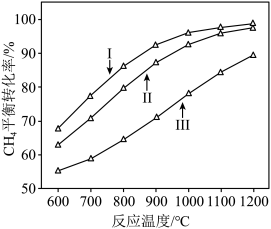
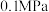 时,平衡时部分组分的物质的量随反应温度变化如图所示。随反应温度的升高,
时,平衡时部分组分的物质的量随反应温度变化如图所示。随反应温度的升高, 的物质的量先增加后减少,主要原因是
的物质的量先增加后减少,主要原因是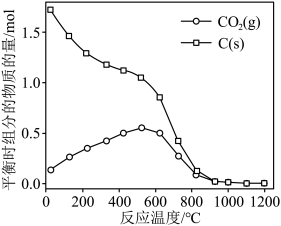
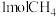 和
和 ,达到平衡时
,达到平衡时 的转化率为
的转化率为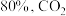 的转化率为
的转化率为 ,碳单质的物质的量为
,碳单质的物质的量为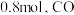 的物质的量为
的物质的量为 ,反应①用摩尔分数表示的平衡常数
,反应①用摩尔分数表示的平衡常数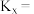
上述平衡时
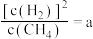 ,向体系通入
,向体系通入 气,重新达到平衡时,
气,重新达到平衡时,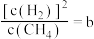 ,则a
,则a 的
的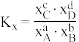 ,物质
,物质 的摩尔分数
的摩尔分数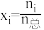 )
)
您最近一年使用:0次
2024-01-20更新
|
1128次组卷
|
4卷引用:湖南省长沙市雅礼中学2023-2024学年高三下学期月考(八)化学试题
湖南省长沙市雅礼中学2023-2024学年高三下学期月考(八)化学试题2024年1月河南普通高等学校招生考试适应性测试化学试题(已下线)T29-原理综合题(已下线)2024年1月“九省联考”河南卷真题完全解读与考后提升
6 .  可作大型船舶的绿色燃料,可由CO或
可作大型船舶的绿色燃料,可由CO或 制备。工业上用
制备。工业上用 制备
制备 的原理如下:
的原理如下:
反应1:
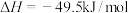
反应2:
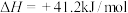 (副反应)
(副反应)
(1) ,该反应的
,该反应的
___________ 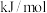 。
。
(2)将 和
和 按
按 通入密闭容器中发生反应1和反应2,分别在
通入密闭容器中发生反应1和反应2,分别在 、
、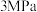 、
、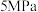 下改变反应温度,测得
下改变反应温度,测得 的平衡转化率(
的平衡转化率( )以及生成
)以及生成 、CO选择性(S)的变化如图(选择性为目标产物在总产物中的比率)。
、CO选择性(S)的变化如图(选择性为目标产物在总产物中的比率)。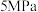 下
下 随温度变化趋势的是曲线
随温度变化趋势的是曲线___________ (填“a”“b”或“c”)。
②随着温度升高,a、b、c三条曲线接近重合的原因是___________ 。
③P点对应的反应2的平衡常数
___________ (保留两位有效数字)。
④分子筛膜反应器可提高反应1的平衡转化率、且实现 选择性100%,原理如图所示。分子筛膜反应器可提高转化率的原因是
选择性100%,原理如图所示。分子筛膜反应器可提高转化率的原因是___________ 。 ,将带来系列技术变革。某小组据此设计了如下装置(如图),以电化学方法进行反应1。
,将带来系列技术变革。某小组据此设计了如下装置(如图),以电化学方法进行反应1。
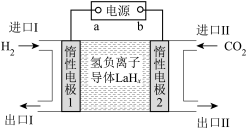
①电极a为电源的___________ (填“正极”或“负极”)。
②生成 的电极反应式为
的电极反应式为___________ 。
③若反应2也同时发生,出口Ⅱ为CO、 、
、 的混合气,且
的混合气,且 ,则惰性电极2的电流效率
,则惰性电极2的电流效率 为
为___________ (
 ×100%)。
×100%)。
 可作大型船舶的绿色燃料,可由CO或
可作大型船舶的绿色燃料,可由CO或 制备。工业上用
制备。工业上用 制备
制备 的原理如下:
的原理如下:反应1:

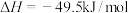
反应2:

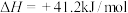 (副反应)
(副反应)(1)
 ,该反应的
,该反应的
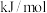 。
。(2)将
 和
和 按
按 通入密闭容器中发生反应1和反应2,分别在
通入密闭容器中发生反应1和反应2,分别在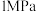 、
、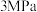 、
、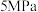 下改变反应温度,测得
下改变反应温度,测得 的平衡转化率(
的平衡转化率( )以及生成
)以及生成 、CO选择性(S)的变化如图(选择性为目标产物在总产物中的比率)。
、CO选择性(S)的变化如图(选择性为目标产物在总产物中的比率)。
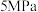 下
下 随温度变化趋势的是曲线
随温度变化趋势的是曲线②随着温度升高,a、b、c三条曲线接近重合的原因是
③P点对应的反应2的平衡常数

④分子筛膜反应器可提高反应1的平衡转化率、且实现
 选择性100%,原理如图所示。分子筛膜反应器可提高转化率的原因是
选择性100%,原理如图所示。分子筛膜反应器可提高转化率的原因是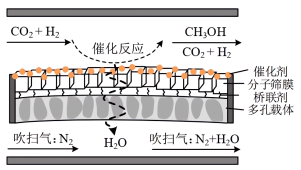
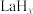 ,将带来系列技术变革。某小组据此设计了如下装置(如图),以电化学方法进行反应1。
,将带来系列技术变革。某小组据此设计了如下装置(如图),以电化学方法进行反应1。
①电极a为电源的
②生成
 的电极反应式为
的电极反应式为③若反应2也同时发生,出口Ⅱ为CO、
 、
、 的混合气,且
的混合气,且 ,则惰性电极2的电流效率
,则惰性电极2的电流效率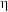 为
为
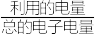 ×100%)。
×100%)。
您最近一年使用:0次
2023-06-03更新
|
703次组卷
|
5卷引用:湖南省宁乡市实验中学等多校联考2024届高三下学期一轮复习总结性考试(月考)化学试题
湖南省宁乡市实验中学等多校联考2024届高三下学期一轮复习总结性考试(月考)化学试题湖南省长沙市雅礼中学2023-2024学年高三上学期1月期末化学试题重庆市巴蜀中学校2023学年高三模拟预测化学试题(已下线)专题14 化学反应原理综合题-2023年高考化学真题题源解密(新高考专用)广西名校2023-2024学年高三上学期仿真卷(一)化学试题
名校
7 . 向 容器中充入
容器中充入 和
和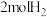 ,发生反应
,发生反应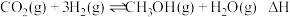 ,测得反应在不同压强、不同温度下,平衡混合物中
,测得反应在不同压强、不同温度下,平衡混合物中 体积分数如图Ⅰ所示,测得反应时逆反应速率与容器中
体积分数如图Ⅰ所示,测得反应时逆反应速率与容器中 关系如图Ⅱ所示。下列说法正确的是
关系如图Ⅱ所示。下列说法正确的是
 容器中充入
容器中充入 和
和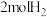 ,发生反应
,发生反应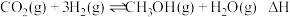 ,测得反应在不同压强、不同温度下,平衡混合物中
,测得反应在不同压强、不同温度下,平衡混合物中 体积分数如图Ⅰ所示,测得反应时逆反应速率与容器中
体积分数如图Ⅰ所示,测得反应时逆反应速率与容器中 关系如图Ⅱ所示。下列说法正确的是
关系如图Ⅱ所示。下列说法正确的是
A. |
B.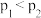 |
C.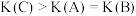 |
| D.图Ⅱ中当x点平衡体系升高至某一温度时,反应可重新达平衡状态,新平衡点可能是d |
您最近一年使用:0次
2023-02-11更新
|
999次组卷
|
5卷引用:湖南省长沙麓山国际实验学校2023-2024学年高二下学期4月份学情检测化学试卷
名校
解题方法
8 . 氙的氟化物是优良的氟化剂,稀有气体Xe和F2混合在催化剂作用下同时存在如下反应:
反应I:
反应Ⅱ: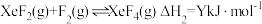
反应Ⅲ: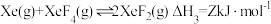
已知:XeF2选择性是指生成XeF2所消耗的Xe的物质的量与初始Xe的物质的量的比值。
回答下列问题:
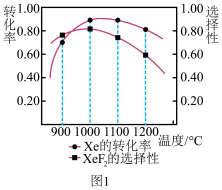
(1)向刚性密闭容器中加入n mol的Xe和4mol的F2,初始压强为106Pa,测得在相同时间内,上述反应Xe的转化率和XeF2的选择性与温度的关系如图1所示,则制取XeF2的最适宜温度为_______ ;当超过1000℃,XeF2选择性随着温度升高而降低的可能原因是_______ 。
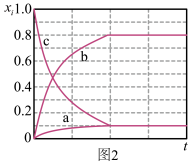
(2)在1000℃时,初始条件同上,xi表示含Xe元素的某物质与含Xe元素各物质的总物质的量之比,xi随时间t变化关系如图2所示。测得平衡时XeF2的选择性为80%,图2中表示XeF4变化的曲线是_______ ,则反应过程能量变化为_______ kJ(用含X、Y的代数式表示),F2的转化率为_______ ,反应I以物质的量分数表示的平衡常数Kx=_______ 。
(3)在1000℃时,反应Ⅲ的平衡常数Kp=_______ ,保持初始其他条件不变,反应达平衡后增大体系压强,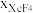 的变化趋势为
的变化趋势为_______ (填“增大”“减小”或“不变”)。
反应I:

反应Ⅱ:
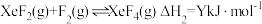
反应Ⅲ:
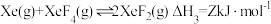
已知:XeF2选择性是指生成XeF2所消耗的Xe的物质的量与初始Xe的物质的量的比值。
回答下列问题:
(1)向刚性密闭容器中加入n mol的Xe和4mol的F2,初始压强为106Pa,测得在相同时间内,上述反应Xe的转化率和XeF2的选择性与温度的关系如图1所示,则制取XeF2的最适宜温度为

(2)在1000℃时,初始条件同上,xi表示含Xe元素的某物质与含Xe元素各物质的总物质的量之比,xi随时间t变化关系如图2所示。测得平衡时XeF2的选择性为80%,图2中表示XeF4变化的曲线是

(3)在1000℃时,反应Ⅲ的平衡常数Kp=
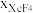 的变化趋势为
的变化趋势为
您最近一年使用:0次
2023-01-15更新
|
530次组卷
|
3卷引用:山东省德州市第一中学2023-2024学年高三上学期1月月考化学试题
山东省德州市第一中学2023-2024学年高三上学期1月月考化学试题山东省潍坊市2022-2023学年高三上学期期末考试化学试题(已下线)化学-2023年高考押题预测卷01(山东卷)(含考试版、全解全析、参考答案、答题卡)
名校
解题方法
9 . 一定温度时,向2.0 L恒容密闭容器中充入2 mol SO2和1 mol O2,发生反应:2SO2(g)+O2(g) 2SO3(g)。经过一段时间后达到平衡。反应过程中测定的部分数据见下表:
2SO3(g)。经过一段时间后达到平衡。反应过程中测定的部分数据见下表:
| t / s | 0 | 2 | 4 | 6 | 8 |
| n(SO3) / mol | 0 | 0.8 | 1.4 | 1.8 | 1.8 |
下列说法正确的是
| A.反应在前2 s 的平均速率v(O2) = 0.4 mol·L-1·s-1 |
| B.保持其他条件不变,体积压缩到1.0 L,平衡常数将增大 |
| C.相同温度下,起始时向容器中充入4 mol SO3,达到平衡时,SO3的转化率小于10% |
D.保持温度不变,向该容器中再充入2 mol SO2、1 mol O2,反应达到新平衡时 减小 减小 |
您最近一年使用:0次
2017-02-17更新
|
717次组卷
|
7卷引用:江苏省锡东高级中学2023-2024学年高二下学期3月月考化学试题

 和生石灰混合体系加压
和生石灰混合体系加压 的K的表达式可知,压强增大不能使
的K的表达式可知,压强增大不能使

