1 . 某温度时,在一个2L的密闭容器中,X、Y、Z三种物质的物质的量随时间的变化曲线如图所示。根据图中数据,试填写下列空白:
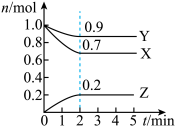
(1)该反应的化学方程式为___________ 。
(2)反应开始至2min,气体Z的平均反应速率为___________ 。
(3)若X、Y、Z均为气体,反应达平衡时:
①此时体系的压强是开始时的___________ 倍;
②若此时只将容器的体积扩大为原来的2倍,达新平衡时,容器内温度将降低(容器不与外界进行热交换),则该反应的正反应为___________ 反应(填“放热”或“吸热”);达新平衡时,容器内混合气体的平均分子量比原平衡时___________ (填增大、减小或相等)。

(1)该反应的化学方程式为
(2)反应开始至2min,气体Z的平均反应速率为
(3)若X、Y、Z均为气体,反应达平衡时:
①此时体系的压强是开始时的
②若此时只将容器的体积扩大为原来的2倍,达新平衡时,容器内温度将降低(容器不与外界进行热交换),则该反应的正反应为
您最近半年使用:0次
名校
解题方法
2 . 已知Ⅰ容器恒压,Ⅱ容器恒容,其它条件相同时,在Ⅰ、Ⅱ中分别加入 ,起始时容积相同,发生反应
,起始时容积相同,发生反应 并达平衡。下列说法正确的是
并达平衡。下列说法正确的是

 ,起始时容积相同,发生反应
,起始时容积相同,发生反应 并达平衡。下列说法正确的是
并达平衡。下列说法正确的是

A.从起始到平衡所需时间:Ⅰ Ⅱ Ⅱ |
B.平衡后若在Ⅱ中再加入 ,则新平衡时 ,则新平衡时 的体积分数变小 的体积分数变小 |
C.平衡时 的转化率:Ⅰ 的转化率:Ⅰ Ⅱ Ⅱ |
D.平衡后若在Ⅰ中再加入 ,则 ,则 的物质的量将减少 的物质的量将减少 |
您最近半年使用:0次
名校
3 . 二甲醚( )是重要的化工原料,可用水煤气(主要成分为CO和
)是重要的化工原料,可用水煤气(主要成分为CO和 )合成。其主要反应原理如下(a、b、c均为正值):
)合成。其主要反应原理如下(a、b、c均为正值):
①
 kJ⋅mol
kJ⋅mol
②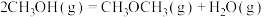
 kJ·mol
kJ·mol
③
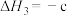 kJ⋅mol
kJ⋅mol
回答下列问题:
(1)总反应的热化学方程式: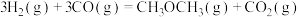

_______ kJ/mol。
(2)以下说法能说明反应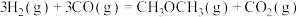 达到化学平衡状态的有
达到化学平衡状态的有_______ 。
a.恒温恒容条件下,气体的密度保持不变
b.恒温恒压条件下,气体的平均摩尔质量保持不变
c.绝热体系中,体系的温度保持不变
(3)生产二甲醚的过程中存在副反应: ,与甲醇脱水反应:
,与甲醇脱水反应: 形成竞争。将水煤气按一定进料比通入反应装置,选择合适的催化剂。在保持温度一定改变压强条件下测得二甲醚的选择性如下图所示。
形成竞争。将水煤气按一定进料比通入反应装置,选择合适的催化剂。在保持温度一定改变压强条件下测得二甲醚的选择性如下图所示。
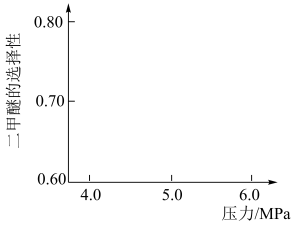
资料:二甲醚的选择性是指转化为二甲醚的CO在全部CO反应物中所占的比例。
分析:温度一定,随压强增大,二甲醚选择性增大的原因是_______ 。
 )是重要的化工原料,可用水煤气(主要成分为CO和
)是重要的化工原料,可用水煤气(主要成分为CO和 )合成。其主要反应原理如下(a、b、c均为正值):
)合成。其主要反应原理如下(a、b、c均为正值):①

 kJ⋅mol
kJ⋅mol
②
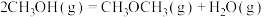
 kJ·mol
kJ·mol
③

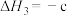 kJ⋅mol
kJ⋅mol
回答下列问题:
(1)总反应的热化学方程式:
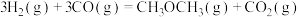

(2)以下说法能说明反应
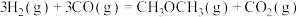 达到化学平衡状态的有
达到化学平衡状态的有a.恒温恒容条件下,气体的密度保持不变
b.恒温恒压条件下,气体的平均摩尔质量保持不变
c.绝热体系中,体系的温度保持不变
(3)生产二甲醚的过程中存在副反应:
 ,与甲醇脱水反应:
,与甲醇脱水反应: 形成竞争。将水煤气按一定进料比通入反应装置,选择合适的催化剂。在保持温度一定改变压强条件下测得二甲醚的选择性如下图所示。
形成竞争。将水煤气按一定进料比通入反应装置,选择合适的催化剂。在保持温度一定改变压强条件下测得二甲醚的选择性如下图所示。
资料:二甲醚的选择性是指转化为二甲醚的CO在全部CO反应物中所占的比例。
分析:温度一定,随压强增大,二甲醚选择性增大的原因是
您最近半年使用:0次
名校
4 . 在一密闭容器中,反应aM(g) bN(g)达到平衡后,保持温度不变,将容器体积增加一倍,当达到新的平衡时,N的浓度变为原来的60%。下列有关判断正确的是
bN(g)达到平衡后,保持温度不变,将容器体积增加一倍,当达到新的平衡时,N的浓度变为原来的60%。下列有关判断正确的是
 bN(g)达到平衡后,保持温度不变,将容器体积增加一倍,当达到新的平衡时,N的浓度变为原来的60%。下列有关判断正确的是
bN(g)达到平衡后,保持温度不变,将容器体积增加一倍,当达到新的平衡时,N的浓度变为原来的60%。下列有关判断正确的是| A.平衡向逆反应方向移动 | B.反应的化学平衡常数变大 |
| C.物质M的转化率变小 | D.a、b的大小关系是:a < b |
您最近半年使用:0次
名校
5 . 制备水煤气的反应C(s)+H2O(g) H2(g)+CO(g) ΔH>0,下列说法正确的是
H2(g)+CO(g) ΔH>0,下列说法正确的是
 H2(g)+CO(g) ΔH>0,下列说法正确的是
H2(g)+CO(g) ΔH>0,下列说法正确的是| A.该反应 ΔS<0 |
| B.升高温度,反应速率增大,平衡正向移动 |
| C.恒温下,增大总压,H2O(g)的平衡转化率不变 |
| D.恒温恒压下,加入催化剂,平衡常数增大 |
您最近半年使用:0次
名校
6 . 完成下列问题
(1)如图中,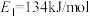 ,
,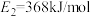 ,根据要求回答问题:
,根据要求回答问题:
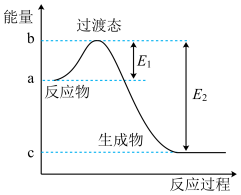
如图是1mol NO2和1molCO反应生成CO2和NO过程中的能量变化示意图,若在反应体系中加入催化剂,反应速率增大, 的变化是
的变化是___________ (填“增大”“减小”或“不变”),请写出NO2和CO反应的热化学方程式:___________ 。
(2)在某温度下,将H2和I2各1mol的气态混合物充入10L的密闭容器中发生反应H2(g)+I2(g) 2HI(g) ΔH<0,达到平衡后,测得c(H2)=0.08mol/L。
2HI(g) ΔH<0,达到平衡后,测得c(H2)=0.08mol/L。
 保持容器容积不变,向其中再加入1molH2,反应速率
保持容器容积不变,向其中再加入1molH2,反应速率___________ (填“增大”、“减小”或“不变”),平衡___________ 移动(填“向正反应方向”、“向逆反应方向”或“不”)。
②保持容器内气体压强不变,向其中加入1molN2(N2不参加反应),反应速率___________ (填“增大”、“减小”或“不变”),平衡___________ 移动(填“向正反应方向”、“向逆反应方向”或“不”)。
③该反应的化学平衡常数K=___________ 。
(1)如图中,
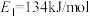 ,
,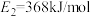 ,根据要求回答问题:
,根据要求回答问题:
如图是1mol NO2和1molCO反应生成CO2和NO过程中的能量变化示意图,若在反应体系中加入催化剂,反应速率增大,
 的变化是
的变化是(2)在某温度下,将H2和I2各1mol的气态混合物充入10L的密闭容器中发生反应H2(g)+I2(g)
 2HI(g) ΔH<0,达到平衡后,测得c(H2)=0.08mol/L。
2HI(g) ΔH<0,达到平衡后,测得c(H2)=0.08mol/L。 保持容器容积不变,向其中再加入1molH2,反应速率
保持容器容积不变,向其中再加入1molH2,反应速率②保持容器内气体压强不变,向其中加入1molN2(N2不参加反应),反应速率
③该反应的化学平衡常数K=
您最近半年使用:0次
7 . 下列方案设计、现象和结论都正确的是
实验 | 目的 | 方案设计 | 现象和结论 |
| A | 探究压强对 (红棕色)与 (红棕色)与 (无色)平衡的影响 (无色)平衡的影响 | 快速压缩装有 、 、 平衡混合气体的针筒 平衡混合气体的针筒 | 如果气体颜色变深,则增大压强,平衡向生成 的方向移动 的方向移动 |
| B | 探究温度对  平衡产生的影响 平衡产生的影响 | 先加热装有 溶液的试管,后置于冷水中,观察溶液颜色变化 溶液的试管,后置于冷水中,观察溶液颜色变化 | 溶液变为黄绿色,后溶液由黄绿色变为蓝绿色,证明温度降低,平衡向生成 的方向移动 的方向移动 |
| C | 验证 溶液中存在水解平衡 溶液中存在水解平衡 | 取2mL 溶液于试管中,加2滴酚酞,再加入少量 溶液于试管中,加2滴酚酞,再加入少量 溶液 溶液 | 如果溶液红色变浅,则 溶液中存在水解平衡 溶液中存在水解平衡 |
| D | 相同温度下,比较 与 与 的酸性强弱 的酸性强弱 | 向等体积的水中分别通入 、 、 至饱和,再用pH计测定两种溶液的pH 至饱和,再用pH计测定两种溶液的pH | 如果通 后所得溶液的pH小,则 后所得溶液的pH小,则 的酸性比 的酸性比 强 强 |
| A.A | B.B | C.C | D.D |
您最近半年使用:0次
名校
8 . 恒温恒压下向密闭容器中充入4mol SO2和2mol O2,反应如下:2SO2(g)+O2(g) 2SO3(g) ΔH<0;2min时反应达到平衡,生成1.4mol SO3,同时放出热量Q kJ。则下列分析
2SO3(g) ΔH<0;2min时反应达到平衡,生成1.4mol SO3,同时放出热量Q kJ。则下列分析不正确 的是
 2SO3(g) ΔH<0;2min时反应达到平衡,生成1.4mol SO3,同时放出热量Q kJ。则下列分析
2SO3(g) ΔH<0;2min时反应达到平衡,生成1.4mol SO3,同时放出热量Q kJ。则下列分析| A.若反应开始时容器体积为2L,则0~2min内v(SO3)>0.35mol/(L·min) |
| B.2min后向容器中再通入一定量的SO3气体,重新达到平衡时,SO2的含量不变 |
| C.若把条件“恒温恒压”改为“绝热恒压”,则平衡后n(SO3)>1.4mol |
| D.若把条件“恒温恒压”改为“恒温恒容”,则平衡时放出热量小于Q kJ |
您最近半年使用:0次
名校
9 . CO、CO2、CH3OH等含碳物质是重要的基础化工原料。回答下列问题:
(1)CH3OH(l)气化时吸收的热量为27 kJ∙mol−1, CH3OH(g)的燃烧热为677 kJ∙mol−1,写出CH3OH(l)完全燃烧的热化学方程式:_________ 。
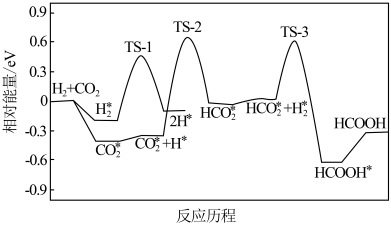
(2)CO2的资源化利用和转化技术的研究对实现碳达峰和碳中和有重要意义。在席夫碱(含“−RC=N−”有机物)修饰的纳米金催化剂上,CO2直接催化加氢生成甲酸。其反应历程如图所示,其中吸附在催化剂表面上的物质用*标注,TS为过渡态。该历程中起决速步骤的化学方程式是_________ 。
(3)在恒温恒容密闭容器中投入足量石墨与CO2进行反应C(s)+CO2(g) 2CO(g),可判定其达到平衡的条件有_______(填序号)。
2CO(g),可判定其达到平衡的条件有_______(填序号)。
(4)CO2与H2在催化剂作用下可转化为CH3OH,主要反应如下:
反应1:CO2(g) +3H2(g) CH3OH(g) +H2O(g) ΔH1
CH3OH(g) +H2O(g) ΔH1
反应2:CO2(g) +H2(g) CO(g) +H2O(g) ΔH2
CO(g) +H2O(g) ΔH2
若起始按 =3投料,测得CO2的平衡转化率(X-CO2)和CH3OH的选择性(S–CH3OH)随温度、压强的变化如图所示[已知:S–CH3OH =
=3投料,测得CO2的平衡转化率(X-CO2)和CH3OH的选择性(S–CH3OH)随温度、压强的变化如图所示[已知:S–CH3OH =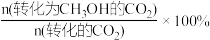 ]
]

①p1_____ (填 “>”或“<”)p2。
②温度高于350°C后,在压强p1和p2下,CO2的平衡转化率几乎交于一点的原因是_____ 。
③250 °C时反应2的压强平衡常数Kp=_______ (结果保留2位有效数字)。
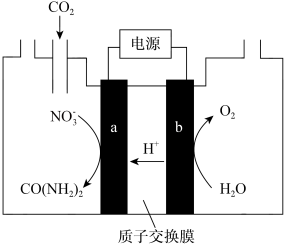
(5)近年研究发现,电催化CO2和含氮物质( 等)在常温常压下合成尿素,有助于实现碳中和及解决含氮废水污染问题。向一定浓度的KNO3溶液通CO2至饱和,在电极上反应生成CO(NH2)2,电解原理如图所示,则电解过程中生成尿素的电极反应式是
等)在常温常压下合成尿素,有助于实现碳中和及解决含氮废水污染问题。向一定浓度的KNO3溶液通CO2至饱和,在电极上反应生成CO(NH2)2,电解原理如图所示,则电解过程中生成尿素的电极反应式是_________ 。
(1)CH3OH(l)气化时吸收的热量为27 kJ∙mol−1, CH3OH(g)的燃烧热为677 kJ∙mol−1,写出CH3OH(l)完全燃烧的热化学方程式:
(2)CO2的资源化利用和转化技术的研究对实现碳达峰和碳中和有重要意义。在席夫碱(含“−RC=N−”有机物)修饰的纳米金催化剂上,CO2直接催化加氢生成甲酸。其反应历程如图所示,其中吸附在催化剂表面上的物质用*标注,TS为过渡态。该历程中起决速步骤的化学方程式是

(3)在恒温恒容密闭容器中投入足量石墨与CO2进行反应C(s)+CO2(g)
 2CO(g),可判定其达到平衡的条件有_______(填序号)。
2CO(g),可判定其达到平衡的条件有_______(填序号)。| A.容器总压保持不变 | B.相同时间内,消耗1molCO2的同时生成2molCO |
| C.CO的体积分数保持不变 | D.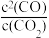 保持不变 保持不变 |
(4)CO2与H2在催化剂作用下可转化为CH3OH,主要反应如下:
反应1:CO2(g) +3H2(g)
 CH3OH(g) +H2O(g) ΔH1
CH3OH(g) +H2O(g) ΔH1反应2:CO2(g) +H2(g)
 CO(g) +H2O(g) ΔH2
CO(g) +H2O(g) ΔH2若起始按
 =3投料,测得CO2的平衡转化率(X-CO2)和CH3OH的选择性(S–CH3OH)随温度、压强的变化如图所示[已知:S–CH3OH =
=3投料,测得CO2的平衡转化率(X-CO2)和CH3OH的选择性(S–CH3OH)随温度、压强的变化如图所示[已知:S–CH3OH =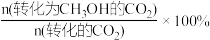 ]
]
①p1
②温度高于350°C后,在压强p1和p2下,CO2的平衡转化率几乎交于一点的原因是
③250 °C时反应2的压强平衡常数Kp=
(5)近年研究发现,电催化CO2和含氮物质(
 等)在常温常压下合成尿素,有助于实现碳中和及解决含氮废水污染问题。向一定浓度的KNO3溶液通CO2至饱和,在电极上反应生成CO(NH2)2,电解原理如图所示,则电解过程中生成尿素的电极反应式是
等)在常温常压下合成尿素,有助于实现碳中和及解决含氮废水污染问题。向一定浓度的KNO3溶液通CO2至饱和,在电极上反应生成CO(NH2)2,电解原理如图所示,则电解过程中生成尿素的电极反应式是
您最近半年使用:0次
2024-01-08更新
|
172次组卷
|
2卷引用:四川省成都石室中学2023-2024学年高二上学期期中考试化学试卷
名校
10 . Ⅰ.在硫酸工业中,通过下列反应使SO2氧化成SO3:2SO2(g)+O2(g) 2SO3(g) ΔH=-196.6 kJ·mol-1。
2SO3(g) ΔH=-196.6 kJ·mol-1。
下表列出了在不同温度和压强下,反应达到平衡时SO2的转化率。
已知:反应条件为催化剂、加热;催化剂是V2O5,在400~500 ℃时催化剂效果最好
(1)一定温度下,在容积不变的密闭容器中发生上述反应,能说明反应达到平衡状态的是_______
(2)分析表格数据,为了使SO2尽可能多地转化为SO3,应选择______ ℃、______ Mpa下进行实验。
(3)在实际生产中,选定的温度为400~500 ℃,原因是___
(4)在实际生产中,采用的压强为常压,原因是______
(5)在实际生产中,通入过量的空气,原因是_____
(6)尾气中SO2必须回收,原因是______
Ⅱ.乙酸甲酯(CH3COOCH3)与氢气制备乙醇主要发生如下反应:CH3COOCH3(g)+2H2(g) CH3OH(g)+CH3CH2OH(g) ,一定温度、1.01 MPa下,在恒容容器中以n(CH3COOCH3)∶n(H2)=1∶10的投料比进行反应,乙酸甲酯转化率与气体总压强的关系如图所示:
CH3OH(g)+CH3CH2OH(g) ,一定温度、1.01 MPa下,在恒容容器中以n(CH3COOCH3)∶n(H2)=1∶10的投料比进行反应,乙酸甲酯转化率与气体总压强的关系如图所示:

已知:对于气相反应,某组分的平衡分压=总压×平衡时某组分的物质的量分数
(7)A点时,CH3COOCH3(g)的平衡分压为_____ ,CH3CH2OH(g)的体积分数为_____ %(保留一位小数)。
(8)此温度下,该反应的化学平衡常数Kp=_____ MPa-1(用平衡分压代替平衡浓度计算,列出计算式,不要求计算结果)。
 2SO3(g) ΔH=-196.6 kJ·mol-1。
2SO3(g) ΔH=-196.6 kJ·mol-1。下表列出了在不同温度和压强下,反应达到平衡时SO2的转化率。
| 温度/℃ | 平衡时SO2的转化率/% | ||||
| 0.1 MPa | 0.5 MPa | 1 MPa | 5 MPa | 10 MPa | |
| 450 | 97.5 | 98.9 | 99.2 | 99.6 | 99.7 |
| 550 | 85.6 | 92.9 | 94.9 | 97.7 | 98.3 |
(1)一定温度下,在容积不变的密闭容器中发生上述反应,能说明反应达到平衡状态的是_______
| A.SO2的体积分数不再变化 | B.混合物的密度不再变化 |
| C.v(SO2)=2v(O2) | D.气体的压强不再变化 |
(3)在实际生产中,选定的温度为400~500 ℃,原因是
(4)在实际生产中,采用的压强为常压,原因是
(5)在实际生产中,通入过量的空气,原因是
(6)尾气中SO2必须回收,原因是
Ⅱ.乙酸甲酯(CH3COOCH3)与氢气制备乙醇主要发生如下反应:CH3COOCH3(g)+2H2(g)
 CH3OH(g)+CH3CH2OH(g) ,一定温度、1.01 MPa下,在恒容容器中以n(CH3COOCH3)∶n(H2)=1∶10的投料比进行反应,乙酸甲酯转化率与气体总压强的关系如图所示:
CH3OH(g)+CH3CH2OH(g) ,一定温度、1.01 MPa下,在恒容容器中以n(CH3COOCH3)∶n(H2)=1∶10的投料比进行反应,乙酸甲酯转化率与气体总压强的关系如图所示:
已知:对于气相反应,某组分的平衡分压=总压×平衡时某组分的物质的量分数
(7)A点时,CH3COOCH3(g)的平衡分压为
(8)此温度下,该反应的化学平衡常数Kp=
您最近半年使用:0次



