名校
解题方法
1 . I.在密闭容器中进行如下反应:CO2(g)+C(s)⇌2CO(g) ΔH>0,达到平衡后,若改变下列条件,则指定物质的浓度及平衡如何变化。
(1)增加C(s),则平衡___________ (填“逆向移动”“正向移动”或“不移动”,下同)
(2)保持温度不变,增大反应容器的容积,则c(CO2)_______ (填“增大”“减小”或“不变”,下同)。
(3)保持反应容器的容积和温度不变,通入He,则平衡___________ 。
(4)保持反应容器的容积不变,升高温度,则平衡时c(CO)___________ 。
II.氢能是一种极具发展潜力的清洁能源。以下反应是目前大规模制取氢气的重要方法之一: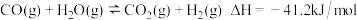
(5)欲提高CO的平衡转化率,理论上可以采取的措施为__________。
(6)800℃时,该反应达到平衡,写出该反应的平衡常数表达式K=___________ 。
(1)增加C(s),则平衡
(2)保持温度不变,增大反应容器的容积,则c(CO2)
(3)保持反应容器的容积和温度不变,通入He,则平衡
(4)保持反应容器的容积不变,升高温度,则平衡时c(CO)
II.氢能是一种极具发展潜力的清洁能源。以下反应是目前大规模制取氢气的重要方法之一:
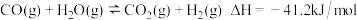
(5)欲提高CO的平衡转化率,理论上可以采取的措施为__________。
| A.增大压强 | B.升高温度 | C.加入催化剂 | D.通入过量水蒸气 |
您最近一年使用:0次
11-12高二上·山东济南·期中
名校
2 . 关于C(s)+H2O(g) CO(g)+H2(g)的平衡常数(K)书写形式,正确的是
CO(g)+H2(g)的平衡常数(K)书写形式,正确的是
 CO(g)+H2(g)的平衡常数(K)书写形式,正确的是
CO(g)+H2(g)的平衡常数(K)书写形式,正确的是A.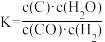 | B.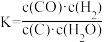 | C.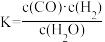 | D.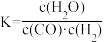 |
您最近一年使用:0次
2022-11-02更新
|
545次组卷
|
29卷引用:宁夏吴忠中学2022-2023学年高二上学期期中考试化学试题
宁夏吴忠中学2022-2023学年高二上学期期中考试化学试题吉林省白城市通榆县毓才高级中学2022-2023学年高二上学期第一次月考化学试题江苏省淮安市淮海中学2022-2023学年高二10月阶段考试化学试题浙江省舟山市舟山中学2022-2023学年高二上学期阶段性质量监测化学试题北京市首都师范大学附属密云中学2022-2023学年高二上学期10月阶段性练习化学试题广东省惠州市博罗县2022-2023学年高二上学期期中考试化学试题吉林市第二中学2022-2023学年高二上学期9月月考化学试题重庆市荣昌永荣中学校2021-2022学年高二上学期期末考试化学试题(已下线)2011-2012学年山东省济南外国语学校高二上学期期中考试化学(理)试卷(已下线)2011—2012学年福建省漳州市芗城中学高二上学期期末考试化学试卷(已下线)2011-2012学年陕西省三原县北城中学高二上学期期中考试化学试卷(已下线)2012-2013学年福建福清东张中学高二上学期期中考试理科化学试卷(已下线)2014—2015学年湖北武汉新洲三中高二10月月考化学(A卷)试卷吉林省长春市第二十九中学2019-2020学年高一下学期期中考试化学试题(理)(已下线)2.2.1 化学平衡状态 化学平衡常数(练习)-2020-2021学年上学期高二化学同步精品课堂(新教材人教版选择性必修1)山东省新泰一中东校2020-2021学年高二上学期第一次月考化学试题青海省西宁市海湖中学2020-2021学年高二上学期第二次阶段测试化学试题吉林省大安市第六中学2020-2021学年高二上学期期中考试化学试题辽宁省大连市普兰店区第一中学2020-2021学年高二上学期第二阶段考试化学试题(已下线)第二章 第三节化学平衡(第3课时 化学平衡常数)(备作业)-【上好课】2021-2022学年高二化学同步备课系列(人教版选修4)(已下线)2.2.3 化学平衡常数-2021-2022学年高二化学课后培优练(苏教版2019选择性必修1)黑龙江省牡丹江市海林市朝鲜族中学2021-2022学年上学期高二10月月考化学试题黑龙江省佳木斯学校(佳木斯市实验中学)2021-2022学年高二上学期第二次月考化学试题云南省弥勒市第二中学2020-2021学年高二下学期期中考试化学试题吉林省汪清县第六中学2021-2022学年高二上学期期中考试化学试题甘肃省武威第七中学2021-2022学年高二上学期期中考试化学试题广东省肇庆市封开县广信中学、四会中学2023-2024学年高二上学期第一次联考化学试题【精品卷】2.2.2 化学平衡常数课堂例题-人教版2023-2024学年选择性必修1福建省龙岩市永定区城关中学2023-2024学年高二上学期期中考试化学试题
3 . 回答下列问题:
(1)已知:Fe(s)+ O2(g)= FeO(s) ΔH= -272.0KJ·mol-1
O2(g)= FeO(s) ΔH= -272.0KJ·mol-1
2Al(s)+ O2(s)= Al2O3(s) ΔH=-1675.7KJ·mol-1
O2(s)= Al2O3(s) ΔH=-1675.7KJ·mol-1
Al和FeO发热反应的热化学方程式是___________ 。
(2)某可逆反应在不同条件下的反应历程分别为A、B,如图所示。

①据图判断:当反应达到平衡后,其他条件不变,升高温度,反应物的转化率___________ (填“增大”“减小”或“不变”);
②其中B历程表明此反应采用的条件为___________ (选 填序号)。
A.升高温度 B.增大反应物的浓度
C. 降低温度 D.使用催化剂
(3)1000°C时,硫酸钠与氢气发生下列反应: Na2SO4(s)+4H2(g)= Na2S(s)+ 4H2O(g)。该反应的平衡常数表达式为K=___________ ;已知K (1000°C ) <K (1200°C) ,若降低体系温度,混合气体的平均相对分子质量将___________ (填“增大”、 “减小”或“不变”)。
(4)常温下,如果取0.1mol·L-1HA溶液与0.1mol ·L-1NaOH溶液等体积混合(混合后溶液体积的变化忽略不计),测得混合液的pH=8。
①混合液中由水电离出的OH—浓度与0.1mol·L-1NaOH溶液中由水电离出的OH—浓度之比为___________ ;
②已知NH4A溶液为中性,又知将HA溶液加到Na2CO3溶液中有气体放出,试推断相同温度下,等物质的量浓度的下列盐溶液按pH由大到小的排列顺序为(填序号)___________ >___________ >___________
a.NH4Cl b. NH4A c. (NH4)2CO3
(1)已知:Fe(s)+
 O2(g)= FeO(s) ΔH= -272.0KJ·mol-1
O2(g)= FeO(s) ΔH= -272.0KJ·mol-12Al(s)+
 O2(s)= Al2O3(s) ΔH=-1675.7KJ·mol-1
O2(s)= Al2O3(s) ΔH=-1675.7KJ·mol-1Al和FeO发热反应的热化学方程式是
(2)某可逆反应在不同条件下的反应历程分别为A、B,如图所示。

①据图判断:当反应达到平衡后,其他条件不变,升高温度,反应物的转化率
②其中B历程表明此反应采用的条件为
A.升高温度 B.增大反应物的浓度
C. 降低温度 D.使用催化剂
(3)1000°C时,硫酸钠与氢气发生下列反应: Na2SO4(s)+4H2(g)= Na2S(s)+ 4H2O(g)。该反应的平衡常数表达式为K=
(4)常温下,如果取0.1mol·L-1HA溶液与0.1mol ·L-1NaOH溶液等体积混合(混合后溶液体积的变化忽略不计),测得混合液的pH=8。
①混合液中由水电离出的OH—浓度与0.1mol·L-1NaOH溶液中由水电离出的OH—浓度之比为
②已知NH4A溶液为中性,又知将HA溶液加到Na2CO3溶液中有气体放出,试推断相同温度下,等物质的量浓度的下列盐溶液按pH由大到小的排列顺序为(填序号)
a.NH4Cl b. NH4A c. (NH4)2CO3
您最近一年使用:0次
4 . 二氧化碳减排和再利用技术是促进社会环保和工业可持续发展的重要措施。将工业废气中的 转化为
转化为 ,可以通过以下途径实现。
,可以通过以下途径实现。
反应Ⅰ:

反应Ⅱ:
反应Ⅲ:

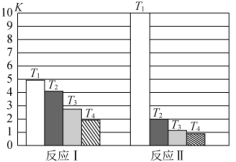
反应Ⅰ和反应Ⅱ的平衡常数K随温度T的变化如图所示。
下列说法错误的是
 转化为
转化为 ,可以通过以下途径实现。
,可以通过以下途径实现。反应Ⅰ:


反应Ⅱ:

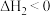
反应Ⅲ:


反应Ⅰ和反应Ⅱ的平衡常数K随温度T的变化如图所示。

下列说法错误的是
| A.反应Ⅰ、Ⅱ都是放热反应 | B.温度: |
C.反应Ⅲ的 | D. 时反应Ⅲ的平衡常数 时反应Ⅲ的平衡常数 |
您最近一年使用:0次
2022-03-22更新
|
147次组卷
|
6卷引用:宁夏石嘴山市第三中学2021-2022学年高二下学期第一次月考化学试题
名校
5 . 反应物和生成物均为气态的平衡体系,平衡常数表达式为
 ,有关该平衡体系的说法正确的是
,有关该平衡体系的说法正确的是

 ,有关该平衡体系的说法正确的是
,有关该平衡体系的说法正确的是| A.升高温度,该反应平衡常数K变大 |
| B.增大压强,W的质量分数增大 |
C.该反应的化学方程式为 ⇌ ⇌ |
| D.增大X气体的浓度平衡向正反应方向移动 |
您最近一年使用:0次
2021-09-08更新
|
658次组卷
|
5卷引用:宁夏吴忠中学2021-2022学年高二上学期期末考试化学试题



