1 . 目前工业上有一种方法是用CO2生产燃料甲醇。一定条件下发生反应:CO2(g)+3H2(g)  CH3OH(g)+H2O(g),如图表示该反应进行过程中能量(单位为kJ·mol-1)的变化。
CH3OH(g)+H2O(g),如图表示该反应进行过程中能量(单位为kJ·mol-1)的变化。___________ 。
(2)温度降低,平衡常数K___________ (填“增大”、“不变”或“减小”)。
(3)为探究反应原理,现进行如下实验:在体积为1L的恒容密闭容器中,充入1molCO2和3molH2,测得CO2和CH3OH(g)的浓度随时间变化如下图所示。从反应开始到平衡,用H2浓度变化表示的平均反应速率 (H2)为
(H2)为____________ mol·L-1·min-1, CO2和H2的转化率比是___________ 。___________ 。
 CH3OH(g)+H2O(g),如图表示该反应进行过程中能量(单位为kJ·mol-1)的变化。
CH3OH(g)+H2O(g),如图表示该反应进行过程中能量(单位为kJ·mol-1)的变化。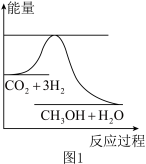
(2)温度降低,平衡常数K
(3)为探究反应原理,现进行如下实验:在体积为1L的恒容密闭容器中,充入1molCO2和3molH2,测得CO2和CH3OH(g)的浓度随时间变化如下图所示。从反应开始到平衡,用H2浓度变化表示的平均反应速率
 (H2)为
(H2)为
您最近一年使用:0次
名校
解题方法
2 . 某可逆反应aA+bB cC在某温度下的平衡常数为K(K≠1),反应热为ΔH.保持温度不变,将化学方程式的书写做如下改变,则ΔH和K数值的相应变化为
cC在某温度下的平衡常数为K(K≠1),反应热为ΔH.保持温度不变,将化学方程式的书写做如下改变,则ΔH和K数值的相应变化为
 cC在某温度下的平衡常数为K(K≠1),反应热为ΔH.保持温度不变,将化学方程式的书写做如下改变,则ΔH和K数值的相应变化为
cC在某温度下的平衡常数为K(K≠1),反应热为ΔH.保持温度不变,将化学方程式的书写做如下改变,则ΔH和K数值的相应变化为A.写成2aA+2bB 2cC,ΔH值、K均扩大了1倍 2cC,ΔH值、K均扩大了1倍 |
B.写成2aA+2bB 2cC,ΔH值扩大了1倍,K保持不变 2cC,ΔH值扩大了1倍,K保持不变 |
C.写成cC aA+bB,ΔH值、K变为原来的相反数 aA+bB,ΔH值、K变为原来的相反数 |
D.写成cC aA+bB,ΔH值变为原来的相反数,K变为原来的倒数 aA+bB,ΔH值变为原来的相反数,K变为原来的倒数 |
您最近一年使用:0次
2023-10-21更新
|
258次组卷
|
12卷引用:新疆乌鲁木齐市第八中学2022-2023学年高二上学期期中考试化学试题
新疆乌鲁木齐市第八中学2022-2023学年高二上学期期中考试化学试题云南省玉溪第三中学2021-2022学年高二上学期期末考试化学试题(已下线)2.2.2 化学平衡计算——同步学习必备知识山东省青岛第二中学2022-2023学年高二上学期10月月考化学试题云南省玉溪市华宁县第二中学2019-2020学年高二上学期期末考试化学试题云南省玉溪市江川区二中2019-2020学年高二上学期期末考试化学试题云南省西双版纳傣族自治州勐腊县第一中学2019-2020学年高二上学期期末考试化学试题(已下线)2.2.2 化学平衡常数(素养提优B练)-2021-2022学年高二化学课时过关提优AB练(人教版2019选择性必修1)(已下线)第七章 化学反应速率与化学平衡 第41练 化学平衡状态 化学平衡常数第二章 第二节 化学平衡 第2课时 化学平衡常数(已下线)第3讲 化学平衡计算 平衡常数云南省昆明师范专科学校附属中学2022-2023学年高二上学期期末考试化学试题
解题方法
3 . Ⅰ.在一定体积的密闭容器中,进行如下化学反应:CO2(g)+H2(g) CO(g)+H2O(g),其化学平衡常数K和温度t的关系如下表:
CO(g)+H2O(g),其化学平衡常数K和温度t的关系如下表:
回答下列问题:
(1)该反应的化学平衡常数表达式为K =_______ 。
(2)该反应为_______ 反应(选填吸热、放热)。
(3)能判断该反应是否达到化学平衡状态的依据是_______。
(4)某温度下,平衡浓度符合下式:c(CO2)·c(H2)=c(CO)·c(H2O),试判断此时的温度为 _______ ℃。
Ⅱ.完成下列填空
(5)Na2CO3的水溶液呈_______ 性,原因是(用离子方程式表示):_______ ;
(6)实验室在配制Na2CO3溶液时,为了抑制水解应向溶液中加入少量的_______ 。
 CO(g)+H2O(g),其化学平衡常数K和温度t的关系如下表:
CO(g)+H2O(g),其化学平衡常数K和温度t的关系如下表:| t℃ | 700 | 800 | 830 | 1000 | 1200 |
| K | 0.6 | 0.9 | 1.0 | 1.7 | 2.6 |
(1)该反应的化学平衡常数表达式为K =
(2)该反应为
(3)能判断该反应是否达到化学平衡状态的依据是_______。
| A.容器中压强不变 | B.混合气体中 c(CO)不变 |
| C.v正(H2)=v逆(H2O) | D.c(CO2)=c(CO) |
Ⅱ.完成下列填空
(5)Na2CO3的水溶液呈
(6)实验室在配制Na2CO3溶液时,为了抑制水解应向溶液中加入少量的
您最近一年使用:0次
4 . 《化学反应原理》模块从不同的视角对化学反应进行了探究、分析。以下观点中不正确的是
①放热反应在常温下均能自发进行;
②电解过程中,化学能转化为电能而“储存”起来;
③原电池工作时所发生的反应一定有氧化还原反应;
④加热时,放热反应的υ(正)会减小;
⑤化学平衡常数的表达式与化学反应方程式的书写无关。
①放热反应在常温下均能自发进行;
②电解过程中,化学能转化为电能而“储存”起来;
③原电池工作时所发生的反应一定有氧化还原反应;
④加热时,放热反应的υ(正)会减小;
⑤化学平衡常数的表达式与化学反应方程式的书写无关。
| A.①②④⑤ | B.①④⑤ | C.②③⑤ | D.①②⑤ |
您最近一年使用:0次
2022-12-11更新
|
120次组卷
|
2卷引用:新疆哈密第十五中学2021-2022学年高二上学期期末考试化学试题
解题方法
5 . 常温下,有0.1 mol∙L−1的四种溶液:①NaOH ②Na2CO3 ③NaHSO4 ④NH4Cl
(1)任选上述一种酸性溶液,用化学用语解释其呈酸性的原因________________________
(2)溶液①中由水电离出的氢氧根浓度为________________
(3)溶液①、③等体积混合后,溶液中c(H+)________________ c(OH-)(填“>”、“<”或“=”)。
(4)溶液④中各离子浓度从大到小的顺序是_____________________________________
(5)反应A(g)+3B(g) 2C(g)在一定温度下达到平衡,该反应的平衡常数表达式
2C(g)在一定温度下达到平衡,该反应的平衡常数表达式_________________
(6)电解精炼铜的阳极为___________ ;铁钥匙上镀铜,镀件为________________ 极;
(7)为保护地下钢管不受腐蚀,可使它与直流电源的_______________ 极相连,该极发生__________ 反应(填“氧化”或“还原”)
(1)任选上述一种酸性溶液,用化学用语解释其呈酸性的原因
(2)溶液①中由水电离出的氢氧根浓度为
(3)溶液①、③等体积混合后,溶液中c(H+)
(4)溶液④中各离子浓度从大到小的顺序是
(5)反应A(g)+3B(g)
 2C(g)在一定温度下达到平衡,该反应的平衡常数表达式
2C(g)在一定温度下达到平衡,该反应的平衡常数表达式(6)电解精炼铜的阳极为
(7)为保护地下钢管不受腐蚀,可使它与直流电源的
您最近一年使用:0次
6 . 对于密闭容器中反应2SO2(g)+O2(g) 2SO3(g),下列说法正确的是
2SO3(g),下列说法正确的是
 2SO3(g),下列说法正确的是
2SO3(g),下列说法正确的是| A.反应的ΔS>0 |
B.反应的平衡常数可表示为K=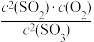 |
| C.增大体系的压强能提高SO2的反应速率和转化率 |
| D.使用催化剂,该反应的反应热 ΔH将减少 |
您最近一年使用:0次
2022-12-10更新
|
163次组卷
|
2卷引用:新疆吐鲁番市高昌区第二中学2021-2022学年高二上学期期末考试化学试题
7 . 完成下列问题:
Ⅰ.将5 mL0.005 mol•L-1的FeCl3溶液与5 mL0.01 mol•L-1的KSCN溶液混合,建立平衡:FeCl3+3KSCN 3KCl+Fe(SCN)3(红色)。
3KCl+Fe(SCN)3(红色)。
(1)若滴加1 mol•L-1KSCN溶液4滴,平衡向___________ 方向移动,溶液红色___________ 。
(2)若加入少量KCl固体,则平衡___________ 移动(填“正向”、“逆向”或“不”)。
Ⅱ.利用反应CO(g)+H2O(g) H2(g)+CO2(g)可得到清洁能源H2。
H2(g)+CO2(g)可得到清洁能源H2。
(3)该反应化学平衡常数表达式K=___________ 。
(4)该反应的平衡常数随温度的变化如表:
从上表可以推断:此反应是___________ (填“吸热”或“放热”)反应。
(5)830℃时,向容积为2L的密闭容器中充入1molCO与1molH2O,2min时CO为0.6mol,2min内v(CO2)=___________ ,此时反应进行的方向是___________ ,(填正向进行或逆向进行)依据是___________ ,可以判断该反应达到平衡的标志是___________ (填字母)。
a.体系的压强不再发生变化 b.混合气体的密度不变
c.CO的消耗速率与CO2的消耗速率相等 d.各组分的物质的量浓度不再改变
Ⅰ.将5 mL0.005 mol•L-1的FeCl3溶液与5 mL0.01 mol•L-1的KSCN溶液混合,建立平衡:FeCl3+3KSCN
 3KCl+Fe(SCN)3(红色)。
3KCl+Fe(SCN)3(红色)。(1)若滴加1 mol•L-1KSCN溶液4滴,平衡向
(2)若加入少量KCl固体,则平衡
Ⅱ.利用反应CO(g)+H2O(g)
 H2(g)+CO2(g)可得到清洁能源H2。
H2(g)+CO2(g)可得到清洁能源H2。(3)该反应化学平衡常数表达式K=
(4)该反应的平衡常数随温度的变化如表:
| 温度/℃ | 400 | 500 | 830 | 1000 |
| 平衡常数K | 10 | 9 | 1 | 0.6 |
(5)830℃时,向容积为2L的密闭容器中充入1molCO与1molH2O,2min时CO为0.6mol,2min内v(CO2)=
a.体系的压强不再发生变化 b.混合气体的密度不变
c.CO的消耗速率与CO2的消耗速率相等 d.各组分的物质的量浓度不再改变
您最近一年使用:0次
名校
8 . I.已知化学反应
①: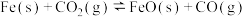 ,其化学平衡常数为
,其化学平衡常数为
②: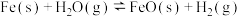 ,其化学平衡常数为
,其化学平衡常数为
K在温度973K和1173K的情况下, 、
、 的值分别如下:
的值分别如下:
(1)通过表格中的数值可以推断:反应②是_______ (填“吸热”或“放热”)反应。
(2)现有反应③: ,请你写出该反应的平衡常数
,请你写出该反应的平衡常数 的表达式:
的表达式:
_______ 。推断出反应③是_______ (填“吸热”或“放热)反应。
(3)要使反应③在一定条件下建立的平衡向正反应方向移动,可采取的措施有_______ (填字母)。
A.缩小反应容器的容积 B.扩大反应容器的容积 C.降低温度
D.使用合适的催化剂 E.设法减小平衡体系中的 的浓度
的浓度
(4)图甲、乙分别表示反应③在 时刻达到平衡,在
时刻达到平衡,在 时刻因改变某个条件而发生变化的情况:(若有多种可能,都需要写上)
时刻因改变某个条件而发生变化的情况:(若有多种可能,都需要写上)

①图甲中 时刻发生改变的条件是
时刻发生改变的条件是_______ 。
②图乙中 时刻发生改变的条件是
时刻发生改变的条件是_______ 。
II.在300℃、 下,将
下,将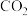 和
和 按物质的量之比为1:3通入恒压密闭容器中发生反应
按物质的量之比为1:3通入恒压密闭容器中发生反应 ,达到平衡时,测得
,达到平衡时,测得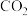 的平衡转化率为50%。
的平衡转化率为50%。
(5)则该反应条件下的压强平衡常数
_______ (用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。
①:
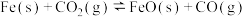 ,其化学平衡常数为
,其化学平衡常数为
②:
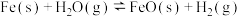 ,其化学平衡常数为
,其化学平衡常数为
K在温度973K和1173K的情况下,
 、
、 的值分别如下:
的值分别如下:K 温度 |  |  |
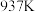 | 1.47 | 2.38 |
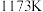 | 2.15 | 1.67 |
(2)现有反应③:
 ,请你写出该反应的平衡常数
,请你写出该反应的平衡常数 的表达式:
的表达式:
(3)要使反应③在一定条件下建立的平衡向正反应方向移动,可采取的措施有
A.缩小反应容器的容积 B.扩大反应容器的容积 C.降低温度
D.使用合适的催化剂 E.设法减小平衡体系中的
 的浓度
的浓度(4)图甲、乙分别表示反应③在
 时刻达到平衡,在
时刻达到平衡,在 时刻因改变某个条件而发生变化的情况:(若有多种可能,都需要写上)
时刻因改变某个条件而发生变化的情况:(若有多种可能,都需要写上)
①图甲中
 时刻发生改变的条件是
时刻发生改变的条件是②图乙中
 时刻发生改变的条件是
时刻发生改变的条件是II.在300℃、
 下,将
下,将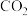 和
和 按物质的量之比为1:3通入恒压密闭容器中发生反应
按物质的量之比为1:3通入恒压密闭容器中发生反应 ,达到平衡时,测得
,达到平衡时,测得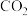 的平衡转化率为50%。
的平衡转化率为50%。(5)则该反应条件下的压强平衡常数

您最近一年使用:0次
名校
9 . 一定温度下,某气态平衡体系的平衡常数表达式为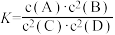 ,有关该平衡体系的说法正确的是
,有关该平衡体系的说法正确的是
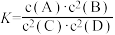 ,有关该平衡体系的说法正确的是
,有关该平衡体系的说法正确的是A.该反应的化学方程式为 |
| B.增大A浓度,平衡向正反应方向移动 |
| C.增大压强,C体积分数增加 |
| D.升高温度,若B的百分含量减少,则正反应是放热反应 |
您最近一年使用:0次
名校
解题方法
10 . 下列说法正确的是
| A.对于同一物质在不同状态时的熵值:气态<液态<固态 |
| B.已知反应H2(g)+I2(g)⇌2HI(g)的平衡常数为K,则2H2(g)+2I2(g)⇌4HI(g)的平衡常数为2K |
| C.ΔH<0、ΔS>0的反应在低温时不能自发进行 |
| D.在其他外界条件不变的情况下,使用催化剂不能改变化学反应进行的方向 |
您最近一年使用:0次
2022-10-08更新
|
353次组卷
|
3卷引用:新疆奇台县第一中学2022-2023学年高二上学期期中考试化学试题



