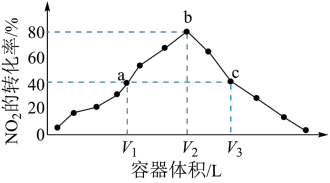
1 . 温度为T℃,向体积不等的恒容密闭容器中分别加入足量活性炭和1molNO2,发生反应:2C(s)+2NO2(g) N2(g)+2CO2(g)。反应相同时间后,测得各容器中NO2的转化率与容器体积的关系如图所示,下列说法正确的是
N2(g)+2CO2(g)。反应相同时间后,测得各容器中NO2的转化率与容器体积的关系如图所示,下列说法正确的是
 N2(g)+2CO2(g)。反应相同时间后,测得各容器中NO2的转化率与容器体积的关系如图所示,下列说法正确的是
N2(g)+2CO2(g)。反应相同时间后,测得各容器中NO2的转化率与容器体积的关系如图所示,下列说法正确的是
| A.T℃时,a、b两点平衡常数Ka<Kb |
B.图中c点所示条件下, (正)= (正)= (逆) (逆) |
| C.容器内的压强:Pa∶Pb>6∶7 |
| D.图中b点所示条件下,再向体系中充入一定量的NO2,达到平衡时,NO2的转化率比原平衡大 |
您最近一年使用:0次
2024-02-21更新
|
89次组卷
|
6卷引用:浙江省宁波五校2022-2023学年高二上学期11月期中考试化学试题
2 . 在一定温度下,将X和Y各0.16mol加入10L恒容密闭容器中,发生下列反应: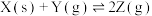
 。一段时间后达到平衡。反应过程中测定的数据如表,下列说法正确的是
。一段时间后达到平衡。反应过程中测定的数据如表,下列说法正确的是
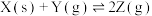
 。一段时间后达到平衡。反应过程中测定的数据如表,下列说法正确的是
。一段时间后达到平衡。反应过程中测定的数据如表,下列说法正确的是| t/min | 2 | 4 | 7 | 9 |
| n(Y)/mol | 0.12 | 0.11 | 0.10 | 0.10 |
A.2min末的反应速率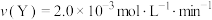 |
| B.7min时该反应恰好达到化学平衡状态 |
C.此反应的平衡常数表达式为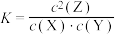 |
| D.其他条件不变,再充入0.1mol X、0.1mol Y、0.2mol Z,此时v(逆)>v(正) |
您最近一年使用:0次
解题方法
3 . 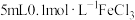 溶液与
溶液与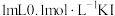 溶液发生反应:
溶液发生反应: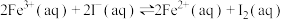 ,达到平衡。下列说法正确的是
,达到平衡。下列说法正确的是
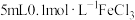 溶液与
溶液与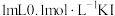 溶液发生反应:
溶液发生反应: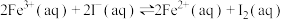 ,达到平衡。下列说法正确的是
,达到平衡。下列说法正确的是| A.加入四氯化碳,振荡,静置分层,下层为紫红色,表明该化学反应存在限度 |
B.经苯2次萃取分离后,在水溶液中加入 ,溶液呈血红色,表明该化学反应存在限度 ,溶液呈血红色,表明该化学反应存在限度 |
| C.加入苯,振荡,平衡正向移动 |
D.该反应的平衡常数 |
您最近一年使用:0次
名校
4 . 完成下面的题。
(1)已知:常温下,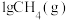 在足量的氧气中完全燃烧时放出55.6kJ热量,请写出该反应燃烧热化学方程式:
在足量的氧气中完全燃烧时放出55.6kJ热量,请写出该反应燃烧热化学方程式:___________ 。
(2)高炉炼铁基本反应: ,其平衡常数表达式为:
,其平衡常数表达式为:___________ 。
(1)已知:常温下,
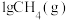 在足量的氧气中完全燃烧时放出55.6kJ热量,请写出该反应燃烧热化学方程式:
在足量的氧气中完全燃烧时放出55.6kJ热量,请写出该反应燃烧热化学方程式:(2)高炉炼铁基本反应:
 ,其平衡常数表达式为:
,其平衡常数表达式为:
您最近一年使用:0次
22-23高二上·浙江·期中
5 . 回答下列问题
(1)反应I2O5(s)+5CO(g) 5CO2(g)+I2(s)的平衡常数表达式为
5CO2(g)+I2(s)的平衡常数表达式为___________ 。
(2)碳酸钠溶液呈碱性的原因是___________ (用离子方程式表示)
(3)已知常温下H2A的Ka1=2.7×10-6,Ka2=6.3×10-10,则NaHA溶液中水的电离程度___________ 纯水中水的电离程度(填“>”“<”或“=”)。
(4)反应3ClO-(aq)
 (aq)+2Cl-(aq)在室温下能自发进行。
(aq)+2Cl-(aq)在室温下能自发进行。
①T°C时,该反应的平衡常数K=3.2×103.若某混合溶液中(Cl-)=0.5mol·L-1,c(ClO-)=0.24mol·L-1,c( )=0.32mol·L-1,则v(正)
)=0.32mol·L-1,则v(正)___________ v(逆)(填“>”“<”或“=”)。
②已知基元反应mA+nB→pC+qD的速率方程为v=kcm(A)cn(B)(k为只与温度有关的速率常数),一般反应的速率由基元反应中的慢反应决定,反应3ClO-(aq)
 (aq)+2Cl-(aq)可能的机理有如下几种:
(aq)+2Cl-(aq)可能的机理有如下几种:
I、3C1O-→ +2Cl-
+2Cl-
II、ClO-→Cl-+O(慢)、O+ClO-→Cl-+O2(快)、C1O-+O2→ (快)
(快)
III、ClO-+ClO-→ +Cl-(慢)、ClO-+
+Cl-(慢)、ClO-+ →
→ +Cl-(快)
+Cl-(快)
则机理II的中间体是___________ 。若反应3ClO-(aq)
 (aq)+2Cl-(aq)的速率方程为v=kc2(ClO-),则该反应的历程可能是
(aq)+2Cl-(aq)的速率方程为v=kc2(ClO-),则该反应的历程可能是___________ (填标号)。
(1)反应I2O5(s)+5CO(g)
 5CO2(g)+I2(s)的平衡常数表达式为
5CO2(g)+I2(s)的平衡常数表达式为(2)碳酸钠溶液呈碱性的原因是
(3)已知常温下H2A的Ka1=2.7×10-6,Ka2=6.3×10-10,则NaHA溶液中水的电离程度
(4)反应3ClO-(aq)

 (aq)+2Cl-(aq)在室温下能自发进行。
(aq)+2Cl-(aq)在室温下能自发进行。①T°C时,该反应的平衡常数K=3.2×103.若某混合溶液中(Cl-)=0.5mol·L-1,c(ClO-)=0.24mol·L-1,c(
 )=0.32mol·L-1,则v(正)
)=0.32mol·L-1,则v(正)②已知基元反应mA+nB→pC+qD的速率方程为v=kcm(A)cn(B)(k为只与温度有关的速率常数),一般反应的速率由基元反应中的慢反应决定,反应3ClO-(aq)

 (aq)+2Cl-(aq)可能的机理有如下几种:
(aq)+2Cl-(aq)可能的机理有如下几种:I、3C1O-→
 +2Cl-
+2Cl-II、ClO-→Cl-+O(慢)、O+ClO-→Cl-+O2(快)、C1O-+O2→
 (快)
(快)III、ClO-+ClO-→
 +Cl-(慢)、ClO-+
+Cl-(慢)、ClO-+ →
→ +Cl-(快)
+Cl-(快)则机理II的中间体是

 (aq)+2Cl-(aq)的速率方程为v=kc2(ClO-),则该反应的历程可能是
(aq)+2Cl-(aq)的速率方程为v=kc2(ClO-),则该反应的历程可能是
您最近一年使用:0次
22-23高二上·浙江杭州·期中
6 . (Ⅰ)甲醇是重要的化学工业基础原料和清洁液体燃料。工业上可利用CO或CO2来生产燃料甲醇。制备甲醇的有关化学反应以及在不同温度下的化学反应平衡常数如下表所示:
(1)据反应①②③可推导出K1、K2与K3之间的关系,则K3=___________ (用K1、K2表示)。
(2)反应③的△H___________0(填“>”或“<”)。
(3)500°C时测得反应③在某时刻H2(g)、CO2(g)、CH3OH(g)、H2O(g)的浓度(mol·L-1)分别为1.0、0.1、0.3、0.15,则此时v正___________ v逆(填“>”“=”或“<”)。
(Ⅱ)工业制硫酸的过程中,SO2(g)转化为SO3(g)是关键的一步,550°C时,在1L的恒温容器中,反应过程中部分数据见下表:
(4)若在起始时总压为p0kPa,反应速率若用单位时间内分压的变化表示,气态物质分压=总压×气态物质的物质的量分数,则10min内SO2(g)的反应速率v(SO2)=___________ kPa·min-1.
| 化学反应 | 平衡常数 | 温度/°C | |
| 500 | 800 | ||
①2H2(g)+CO(g) CH3OH(g) CH3OH(g) | K1 | 2.5 | 0.15 |
②H2(g)+CO2(g) H2O(g)+CO(g) H2O(g)+CO(g) | K2 | 1.0 | 2.50 |
③3H2(g)+CO2(g) CH3OH(g)+H2O(g) CH3OH(g)+H2O(g) | K3 | ||
(2)反应③的△H___________0(填“>”或“<”)。
(3)500°C时测得反应③在某时刻H2(g)、CO2(g)、CH3OH(g)、H2O(g)的浓度(mol·L-1)分别为1.0、0.1、0.3、0.15,则此时v正
(Ⅱ)工业制硫酸的过程中,SO2(g)转化为SO3(g)是关键的一步,550°C时,在1L的恒温容器中,反应过程中部分数据见下表:
| 反应时间/min | SO2(g)/mol | O2(g)/mol | SO3(g)/mol |
| 0 | 4 | 2 | 0 |
| 5 | 1.5 | ||
| 10 | 2 | ||
| 15 | 1 |
您最近一年使用:0次
名校
7 . 下列说法正确的是
| A.一定条件下使用催化剂可以改变化学反应的方向 |
| B.Ba(OH)2•8H2O晶体与NH4Cl固体混合搅拌能发生反应是因为体系向环境吸收了能量 |
C.已知反应H2(g)+I2(g) 2HI(g)的平衡常数为K,则2H2(g)+2I2(g) 2HI(g)的平衡常数为K,则2H2(g)+2I2(g) 4HI(g)的平衡常数为2K 4HI(g)的平衡常数为2K |
| D.2NaHCO3(s)=Na2CO3+H2O(g)+CO2(g) ΔH>0,该反应加热能自发进行,原因是反应的熵增大 |
您最近一年使用:0次
名校
解题方法
8 . 已知反应NH3 ⇌  N2 +
N2 +  H2,在某温度下的平衡常数为0.5,在此条件下,氨的合成反应N2+3H2⇌2NH3的平衡常数为
H2,在某温度下的平衡常数为0.5,在此条件下,氨的合成反应N2+3H2⇌2NH3的平衡常数为
 N2 +
N2 +  H2,在某温度下的平衡常数为0.5,在此条件下,氨的合成反应N2+3H2⇌2NH3的平衡常数为
H2,在某温度下的平衡常数为0.5,在此条件下,氨的合成反应N2+3H2⇌2NH3的平衡常数为| A.0.5 | B.1 | C.2 | D.4 |
您最近一年使用:0次
9 . 某可逆反应平衡常数表达式为K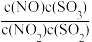 。达到平衡状态时,如果升高温度(其它条件不变),则c(NO)减小。下列说法正确的是
。达到平衡状态时,如果升高温度(其它条件不变),则c(NO)减小。下列说法正确的是
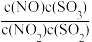 。达到平衡状态时,如果升高温度(其它条件不变),则c(NO)减小。下列说法正确的是
。达到平衡状态时,如果升高温度(其它条件不变),则c(NO)减小。下列说法正确的是A.该反应的化学方程式为NO(g)+SO3(g) NO2(g)+SO2(g) NO2(g)+SO2(g) |
| B.升高温度K增大 |
| C.升高温度,正反应速率增大,逆反应速率减小 |
| D.一定条件下达到平衡后,缩小容器体积,使体系压强增大,气体颜色加深 |
您最近一年使用:0次
2022-11-13更新
|
111次组卷
|
2卷引用:浙江省台州山海协作体2022-2023学年高二上学期期中考试化学试题
10 . 有研究认为,强碱性溶液中反应 分三步进行,其中两步如下:
分三步进行,其中两步如下:
第一步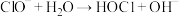
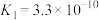
第三步
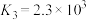
下列说法不正确的是
 分三步进行,其中两步如下:
分三步进行,其中两步如下:第一步
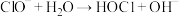
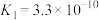
第三步

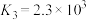
下列说法不正确的是
A. 是该化学反应的中间产物,不是催化剂 是该化学反应的中间产物,不是催化剂 | B.第一步反应为氧化还原反应 |
| C.由K值无法判断第一步与第三步反应的快慢 | D.反应的第二步为 |
您最近一年使用:0次



