1 . 甲醇是重要的化工原料,应用前景广阔。研究表明,二氧化碳与氢气反应可以合成甲醇,反应如下: CO2(g) +3H2(g)  CH3OH(g) +H2O(g)。
CH3OH(g) +H2O(g)。
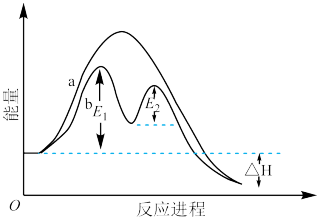
(1)反应过程的能量变化如图所示,起始条件相同,反应过程_______ (填“a”或“b”)达到平衡所需时间短,原因是_______ 。
(2)已知容器体积为2L,起始及反应进行2s时部分物质的物质的量如下表:
用H2表示的该反应的反应速率v (H2)=_______ 。
(3)反应的平衡常数表达式为K=_______ ;升高温度, K值_______ (填“增大”、“减小”或“不变”)。
(4)有利于提高平衡时CO2转化率的措施有_______(填字母)。
 CH3OH(g) +H2O(g)。
CH3OH(g) +H2O(g)。(1)反应过程的能量变化如图所示,起始条件相同,反应过程

(2)已知容器体积为2L,起始及反应进行2s时部分物质的物质的量如下表:
| CO2 | H2 | CH3OH | H2O | |
| 起始(mol) | 1.0 | 3.0 | 0 | 0 |
| 2s时(mol) | 0.4 |
(3)反应的平衡常数表达式为K=
(4)有利于提高平衡时CO2转化率的措施有_______(填字母)。
| A.加压 | B.增大CO2的浓度 |
| C.使用催化剂 | D.及时分离出甲醇 |
您最近一年使用:0次
名校
2 . 下列化学用语表示正确的是
A. 在水中的电离方程式: 在水中的电离方程式: |
B. 在水中的水解方程式: 在水中的水解方程式: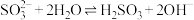 |
C.表示 燃烧热的热化学方程式: 燃烧热的热化学方程式: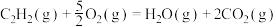  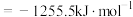 |
D.可逆反应 的平衡常数: 的平衡常数: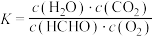 |
您最近一年使用:0次
2022-12-16更新
|
254次组卷
|
5卷引用:天津市南开中学2022-2023学年高二上学期期末考试化学试题
名校
解题方法
3 . 某温度下,若反应 的化学平衡常数
的化学平衡常数 ,则该温度下
,则该温度下
 化学平衡常数
化学平衡常数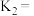
 的化学平衡常数
的化学平衡常数 ,则该温度下
,则该温度下
 化学平衡常数
化学平衡常数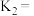
| A.100 | B.50 | C.2500 | D.250 |
您最近一年使用:0次
名校
解题方法
4 . 已知某化学反应的平衡常数表达式为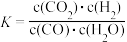 ,在不同温度下该反应的平衡常数如下表。下列有关叙述正确的是
,在不同温度下该反应的平衡常数如下表。下列有关叙述正确的是
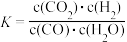 ,在不同温度下该反应的平衡常数如下表。下列有关叙述正确的是
,在不同温度下该反应的平衡常数如下表。下列有关叙述正确的是| T/℃ | 700 | 800 | 830 | 1000 | 1200 |
| K | 1.67 | 1.11 | 1.00 | 0.60 | 0.38 |
A.若平衡浓度符合下列关系式: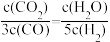 ,则此时的温度为1000℃ ,则此时的温度为1000℃ |
| B.上述反应的逆反应是放热反应 |
C.该反应的化学方程式为CO2(g) + H2(g)  CO(g) + H2O(g) CO(g) + H2O(g) |
| D.若在一定容积的密闭容器中通入CO2和H2各1mol, 5 min后温度升高到830℃,此时得CO为0.4 mol时,该反应达到平衡状态 |
您最近一年使用:0次
2022-10-20更新
|
470次组卷
|
4卷引用:天津市第二十一中学2022-2023学年高二上学期期中调研化学试题
名校
解题方法
5 . 接触法制硫酸工艺中,其主反应在450℃并有催化剂存在下进行: 2SO2(g) + O2(g)  2SO3(g) ΔH =-197kJ/mol,下列说法正确的是
2SO3(g) ΔH =-197kJ/mol,下列说法正确的是
 2SO3(g) ΔH =-197kJ/mol,下列说法正确的是
2SO3(g) ΔH =-197kJ/mol,下列说法正确的是| A.使用催化剂可以提高SO2的转化率 |
| B.增大O2的浓度可以提高反应速率和SO2的转化率 |
| C.反应450℃时的平衡常数小于500℃时的平衡常数 |
| D.2mol SO2(g)和1mol O2(g)所含的总能量小于2mol SO3(g)所含的总能量 |
您最近一年使用:0次
2022-10-20更新
|
145次组卷
|
2卷引用:天津市第二十一中学2022-2023学年高二上学期期中调研化学试题
名校
解题方法
6 . 已知:NO和O2转化为NO2的反应机理如下:
①2NO(g) N2O2(g)(快) △H1<0 平衡常数K1
N2O2(g)(快) △H1<0 平衡常数K1
②N2O2(g)+O2(g) 2NO2(g)(慢) △H2<0 平衡常数K2
2NO2(g)(慢) △H2<0 平衡常数K2
下列说法正确的是
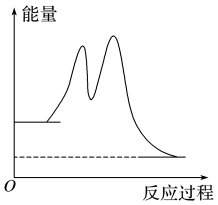
图a
①2NO(g)
 N2O2(g)(快) △H1<0 平衡常数K1
N2O2(g)(快) △H1<0 平衡常数K1②N2O2(g)+O2(g)
 2NO2(g)(慢) △H2<0 平衡常数K2
2NO2(g)(慢) △H2<0 平衡常数K2下列说法正确的是

图a
A.2NO(g)+O2(g)  2NO2(g)的△H= - (△H1+△H2) 2NO2(g)的△H= - (△H1+△H2) |
B.反应②的速率大小决定2NO(g)+O2(g)  2NO2(g)的反应速率 2NO2(g)的反应速率 |
| C.反应过程中的能量变化可用图a表示 |
D.2NO(g)+O2(g)  2NO2(g)的平衡常数 2NO2(g)的平衡常数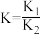 |
您最近一年使用:0次
2022-10-17更新
|
624次组卷
|
12卷引用:天津市宁河区芦台第一中学2022-2023学年高二上学期11月月考化学试题
天津市宁河区芦台第一中学2022-2023学年高二上学期11月月考化学试题天津市静海区四校2021-2022学年高二上学期11月阶段性检测化学试题广东省佛山市第一中学2022-2023学年高二上学期10月月考化学试题陕西省西安市第三中学2022-2023学年高二上学期10月月测评化学试题四川省广安代市中学校2021-2022学年高二上学期9月考化学试题福建省泉州第五中学2022-2023学年高二上学期期中考化学试题安徽省淮北市第一中学2017-2018学年上学期高二年级期末考试化学试题江西省南昌市新建区第二中学2019-2020学年高一下学期“新星计划”体验营7月期终考试化学试题四川省成都石室中学2021-2022学年高二上学期9月测试化学试题安徽省毫州市涡阳第—中学2021-2022学年高二上学期第一次教学质量检测化学试题黑龙江省牡丹江市第三高级中学2021-2022学年高三上学期第四次月考化学试题陕西省渭南市瑞泉中学2023-2024学年高二上学期第一次质量检测化学试题
名校
解题方法
7 . CoCl2可溶。将 溶解于盐酸中可形成
溶解于盐酸中可形成 ,在溶液中存在下面的化学平衡:
,在溶液中存在下面的化学平衡: 。下列说法不正确的是
。下列说法不正确的是
 溶解于盐酸中可形成
溶解于盐酸中可形成 ,在溶液中存在下面的化学平衡:
,在溶液中存在下面的化学平衡: 。下列说法不正确的是
。下列说法不正确的是| A.升高温度,正反应速率、逆反应速率都增大 |
B.该反应的平衡常数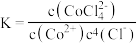 |
C.将盛有 和盐酸混合液的试管置于热水中,试管内溶液为蓝色 和盐酸混合液的试管置于热水中,试管内溶液为蓝色 |
| D.增大Cl-浓度,平衡向正反应方向移动,Co2+、Cl-浓度都减小 |
您最近一年使用:0次
2022-10-08更新
|
505次组卷
|
2卷引用:天津汇文中学2022-2023学年高二上学期第一次阶段性测试化学试题
名校
解题方法
8 . 高温下,某反应达到平衡,平衡常数K= 。恒容时,温度升高,H2浓度减小。下列说法正确的是
。恒容时,温度升高,H2浓度减小。下列说法正确的是
 。恒容时,温度升高,H2浓度减小。下列说法正确的是
。恒容时,温度升高,H2浓度减小。下列说法正确的是| A.该反应的焓变为正值 |
| B.恒温恒容下,通入He,H2浓度一定减小 |
| C.升高温度,逆反应速率减小 |
D.该反应化学方程式为CO+H2O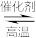 CO2+H2 CO2+H2 |
您最近一年使用:0次
2022-09-15更新
|
583次组卷
|
6卷引用:天津市第八中学2022-2023学年高二上学期期中检测化学试题
名校
9 . 某温度下,在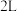 的密闭容器中进行反应
的密闭容器中进行反应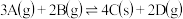 ,若起始时加入
,若起始时加入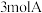 和
和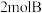 反应一段时间后达到平衡,则下列说法正确的是
反应一段时间后达到平衡,则下列说法正确的是
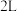 的密闭容器中进行反应
的密闭容器中进行反应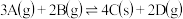 ,若起始时加入
,若起始时加入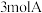 和
和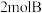 反应一段时间后达到平衡,则下列说法正确的是
反应一段时间后达到平衡,则下列说法正确的是| A.增大该体系的压强,化学平衡常数增大 |
B.A、 的平衡转化率相等 的平衡转化率相等 |
C.该反应的化学平衡常数表达式是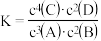 |
| D.当四种物质的物质的量之比等于方程式系数比时,反应达到平衡 |
您最近一年使用:0次
2022-09-02更新
|
515次组卷
|
4卷引用:天津市第八中学2022-2023学年高二上学期期中检测化学试题
10 . 氮氧化物的有效去除和资源的充分利用是当今社会的重要研究课题。
(1)已知:4NH3(g)+5O2(g)=4NO(g) +6H2O(g) ΔH1 = -907.0 kJ•mol-1
4NH3(g) +3O2(g)=2N2(g)+6H2O(g) ΔH2= -1269.0 kJ•mol-1
若4NH3(g) +6NO(g) 5N2(g) +6H2O(g)的逆反应活化能为 E逆 kJ•mol-1,则其正反应活化能为
5N2(g) +6H2O(g)的逆反应活化能为 E逆 kJ•mol-1,则其正反应活化能为_______ kJ•mol-1 (用含E逆的代数式表示)。
(2)已知:①2NO(g)+2ICl(g) 2NOCl (g)+I2(g)
2NOCl (g)+I2(g)
②2NOCl(g) 2NO(g)+Cl2(g)
2NO(g)+Cl2(g)
③I2(g)+Cl2(g) 2ICl(g)
2ICl(g)
若向VL恒容密闭容器中加 2mol NO和 2mol ICl发生上述反应,达到平衡时,容器中 NOCl (g)为amol,Cl2(g)为b mol,此时 I2(g)的浓度为_______ mol•L-1(用含 a、b、V 的代数式表示,下同),反应③的平衡常数为_______ 。
(3)某化工厂排出的尾气(含 CO、N2O)治理的方法为在密闭容器中发生如下反应:CO(g)+N2O(g) CO2(g)+N2(g),CO、N2O在Pt2O+表面进行反应转化为无毒气体,其相对能量与反应历程的关系如下图所示:
CO2(g)+N2(g),CO、N2O在Pt2O+表面进行反应转化为无毒气体,其相对能量与反应历程的关系如下图所示:_______ 。
(4)已知4CO(g) +2NO2(g) 4CO2(g)+N2 (g) ΔH1 = -1200kJ•mol-1 ,该反应在
4CO2(g)+N2 (g) ΔH1 = -1200kJ•mol-1 ,该反应在_______ (填“高温”、“低温”或“任何温度”)下能自发进行,为探究温度及不同催化剂对该反应的影响,保持其它初始条件不变重复实验,在相同时间内测得 N2产率与温度的关系如图所示。在催化剂乙作用下,图中 M 点对应的速率(对应温度400℃)v正_______ (填“>”、“<” 或“=”) v逆,温度高于400℃,N2产率降低的原因可能是_______ 。
(1)已知:4NH3(g)+5O2(g)=4NO(g) +6H2O(g) ΔH1 = -907.0 kJ•mol-1
4NH3(g) +3O2(g)=2N2(g)+6H2O(g) ΔH2= -1269.0 kJ•mol-1
若4NH3(g) +6NO(g)
 5N2(g) +6H2O(g)的逆反应活化能为 E逆 kJ•mol-1,则其正反应活化能为
5N2(g) +6H2O(g)的逆反应活化能为 E逆 kJ•mol-1,则其正反应活化能为(2)已知:①2NO(g)+2ICl(g)
 2NOCl (g)+I2(g)
2NOCl (g)+I2(g) ②2NOCl(g)
 2NO(g)+Cl2(g)
2NO(g)+Cl2(g)③I2(g)+Cl2(g)
 2ICl(g)
2ICl(g)若向VL恒容密闭容器中加 2mol NO和 2mol ICl发生上述反应,达到平衡时,容器中 NOCl (g)为amol,Cl2(g)为b mol,此时 I2(g)的浓度为
(3)某化工厂排出的尾气(含 CO、N2O)治理的方法为在密闭容器中发生如下反应:CO(g)+N2O(g)
 CO2(g)+N2(g),CO、N2O在Pt2O+表面进行反应转化为无毒气体,其相对能量与反应历程的关系如下图所示:
CO2(g)+N2(g),CO、N2O在Pt2O+表面进行反应转化为无毒气体,其相对能量与反应历程的关系如下图所示:
(4)已知4CO(g) +2NO2(g)
 4CO2(g)+N2 (g) ΔH1 = -1200kJ•mol-1 ,该反应在
4CO2(g)+N2 (g) ΔH1 = -1200kJ•mol-1 ,该反应在
您最近一年使用:0次
2022-05-12更新
|
855次组卷
|
5卷引用:天津市和平区2022届高三第二次质量调查化学试题
天津市和平区2022届高三第二次质量调查化学试题湖南省邵东市第三中学2021-2022学年高三下学期5月月考化学试题湖南省祁东县育贤中学2022-2023学年高二上学期第一次月考化学试题(已下线)专题06 化学反应的方向及调控【考点清单】(讲+练)-2023-2024学年高二化学期中考点大串讲(人教版2019选择性必修1)2024届广西桂林市高三下学期4月月考化学试卷



