解题方法
1 . 碳氧化物的资源化利用,对节能减排、保护环境具有重要意义。
(1) 与
与 反应合成甲醇:
反应合成甲醇: 。某条件下,该反应速率
。某条件下,该反应速率 ,
,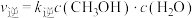 ,该反应的平衡常数
,该反应的平衡常数 ,则x=
,则x=_____ ,y=_____ 。
(2)通过催化剂作用,CO与 反应也可以合成甲醇,反应过程中的能量变化如图:
反应也可以合成甲醇,反应过程中的能量变化如图:
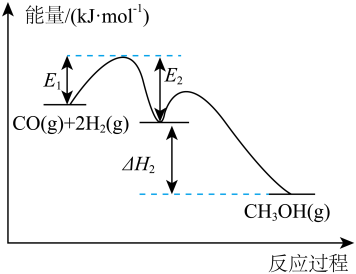
①反应 ,
,
_____  (列式表示)。
(列式表示)。
②为了提高甲醇的平衡产率,应选择的反应条件为_____ 。
A.高温高压 B.高温低压 C.低温高压 D.低温低压
③甲醇可被铱的配合物离子催化发生羰基化反应,反应过程如图所示。下列叙述正确的是________

A.中心离子Ir的配位数、化合价在反应过程中都没有发生变化
B. 是反应中间体,
是反应中间体, 中有
中有 键、
键、 键
键
C.M降低了甲醇羰基化反应的活化能和焓变
D.甲醇羰基化反应的化学方程式为
E.CO分压增大对反应速率没有影响
(3)在催化剂作用下,利用 和
和 合成乙烯,体系中存在反应:
合成乙烯,体系中存在反应:
Ⅰ.

Ⅱ.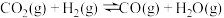

在密闭容器中加入催化剂,通入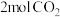 和
和 进行反应,
进行反应, 的平衡转化率随温度和压强的变化如图所示。
的平衡转化率随温度和压强的变化如图所示。
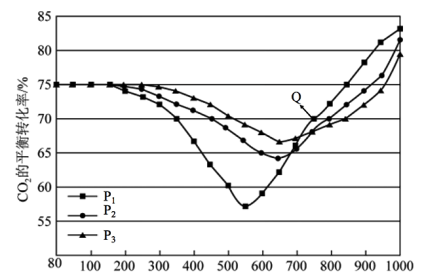
①观察 ,
,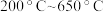 时
时 的平衡转化率随着温度的升高而减小,
的平衡转化率随着温度的升高而减小,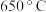 以后
以后 的平衡转化率随着温度的升高而增大的原因是
的平衡转化率随着温度的升高而增大的原因是_____ 。
② 、
、 、
、 的大小关系是
的大小关系是_____ 。
③在Q点对应的条件下,乙烯的选择性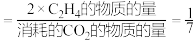 ,则
,则 的转化率为
的转化率为_____ 。该温度下,反应Ⅱ的平衡常数
_____ (用平衡分压代替平衡浓度计算,分压=总压×物质的量分数,保留两位有效数字)。
(1)
 与
与 反应合成甲醇:
反应合成甲醇: 。某条件下,该反应速率
。某条件下,该反应速率 ,
,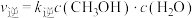 ,该反应的平衡常数
,该反应的平衡常数 ,则x=
,则x=(2)通过催化剂作用,CO与
 反应也可以合成甲醇,反应过程中的能量变化如图:
反应也可以合成甲醇,反应过程中的能量变化如图:
①反应
 ,
,
 (列式表示)。
(列式表示)。②为了提高甲醇的平衡产率,应选择的反应条件为
A.高温高压 B.高温低压 C.低温高压 D.低温低压
③甲醇可被铱的配合物离子催化发生羰基化反应,反应过程如图所示。下列叙述正确的是

A.中心离子Ir的配位数、化合价在反应过程中都没有发生变化
B.
 是反应中间体,
是反应中间体, 中有
中有 键、
键、 键
键C.M降低了甲醇羰基化反应的活化能和焓变
D.甲醇羰基化反应的化学方程式为

E.CO分压增大对反应速率没有影响
(3)在催化剂作用下,利用
 和
和 合成乙烯,体系中存在反应:
合成乙烯,体系中存在反应:Ⅰ.


Ⅱ.

在密闭容器中加入催化剂,通入
 和
和 进行反应,
进行反应, 的平衡转化率随温度和压强的变化如图所示。
的平衡转化率随温度和压强的变化如图所示。
①观察
 ,
, 时
时 的平衡转化率随着温度的升高而减小,
的平衡转化率随着温度的升高而减小,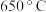 以后
以后 的平衡转化率随着温度的升高而增大的原因是
的平衡转化率随着温度的升高而增大的原因是②
 、
、 、
、 的大小关系是
的大小关系是③在Q点对应的条件下,乙烯的选择性
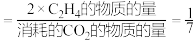 ,则
,则 的转化率为
的转化率为
您最近一年使用:0次
名校
解题方法
2 . 以 、
、 为原料合成
为原料合成 涉及的主要反应如下:
涉及的主要反应如下:
Ⅰ.

Ⅱ.

Ⅲ.
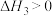
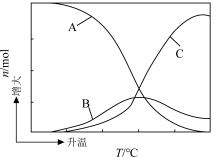
向恒压、密闭容器中通入1mol 和3mol
和3mol 发生上述反应,平衡时
发生上述反应,平衡时 、CO、
、CO、 的物质的量随温度的变化如图所示。下列说法正确的是
的物质的量随温度的变化如图所示。下列说法正确的是
 、
、 为原料合成
为原料合成 涉及的主要反应如下:
涉及的主要反应如下:Ⅰ.


Ⅱ.


Ⅲ.

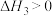
向恒压、密闭容器中通入1mol
 和3mol
和3mol 发生上述反应,平衡时
发生上述反应,平衡时 、CO、
、CO、 的物质的量随温度的变化如图所示。下列说法正确的是
的物质的量随温度的变化如图所示。下列说法正确的是
A.反应Ⅰ平衡常数可表示为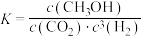 |
| B.图中曲线B表示CO的物质的量随温度的变化 |
C.某时刻 为a mol,CO为b mol,此时 为a mol,CO为b mol,此时 为 为 |
D.为提高 的平衡产率,需要选择低温、低压的反应条件 的平衡产率,需要选择低温、低压的反应条件 |
您最近一年使用:0次
2023-06-24更新
|
230次组卷
|
4卷引用:广东省2022届高三一轮复习第五次联考化学试题
名校
解题方法
3 . 研究发现,在牙膏中添加氟化物能起到预防龋齿的作用,这是因为氟离子能与牙齿表面的釉质层{主要成分是羟基磷灰石[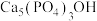 ]}发生反应生成氟磷灰石:
]}发生反应生成氟磷灰石: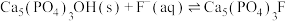
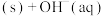 ,下列说法正确的是
,下列说法正确的是
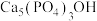 ]}发生反应生成氟磷灰石:
]}发生反应生成氟磷灰石: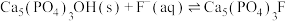
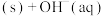 ,下列说法正确的是
,下列说法正确的是A.该反应的平衡常数表达式为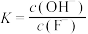 |
B.常温下,氟磷灰石的 比羟基磷灰石的大 比羟基磷灰石的大 |
| C.羟基磷灰石和氟磷灰石相比,羟基磷灰石更能够抵抗有机酸对牙齿的侵蚀 |
| D.羟基磷灰石的溶解速率等于氟磷灰石的生成速率时,反应达到平衡 |
您最近一年使用:0次
2023-06-09更新
|
358次组卷
|
4卷引用:广东省广州市为明学校2023届高三上学期第一次调研考试化学试题
名校
解题方法
4 . 碘及其化合物在合成杀菌剂、药物等方面具有广泛用途。回答下列问题:
(1)已知反应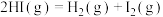
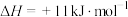 ,1mol
,1mol  (g)、1mol
(g)、1mol  (g)分子中化学键断裂时分别需要吸收436 kJ、151 kJ的能量,则1mol HI(g)分子中化学键断裂时需吸收的能量为
(g)分子中化学键断裂时分别需要吸收436 kJ、151 kJ的能量,则1mol HI(g)分子中化学键断裂时需吸收的能量为_______ kJ。
(2)Bodensteins研究了下列反应: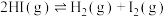 。在716K时,气体混合物中碘化氢的物质的量分数x(HI)与反应时间t的关系如表:
。在716K时,气体混合物中碘化氢的物质的量分数x(HI)与反应时间t的关系如表:
①根据上述实验结果,该反应的平衡常数K的计算式为_______ 。
②上述反应中,正反应速率为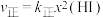 ,逆反应速率为
,逆反应速率为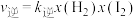 ,其中
,其中 、
、 为速率常数,则
为速率常数,则 为
为_______ (以K和 表示)。
表示)。
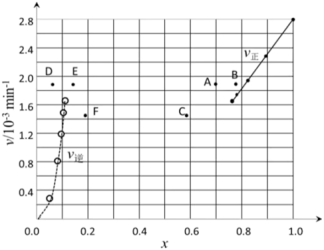
③由上述实验数据计算得到 ~x(HI)和
~x(HI)和 ~
~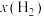 的关系可用下图表示。当升高到某一温度时,反应重新达到平衡,相应的点分别为
的关系可用下图表示。当升高到某一温度时,反应重新达到平衡,相应的点分别为_______ (填字母)。
(1)已知反应
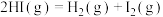
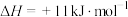 ,1mol
,1mol  (g)、1mol
(g)、1mol  (g)分子中化学键断裂时分别需要吸收436 kJ、151 kJ的能量,则1mol HI(g)分子中化学键断裂时需吸收的能量为
(g)分子中化学键断裂时分别需要吸收436 kJ、151 kJ的能量,则1mol HI(g)分子中化学键断裂时需吸收的能量为(2)Bodensteins研究了下列反应:
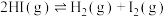 。在716K时,气体混合物中碘化氢的物质的量分数x(HI)与反应时间t的关系如表:
。在716K时,气体混合物中碘化氢的物质的量分数x(HI)与反应时间t的关系如表:| t/min | 0 | 20 | 40 | 60 | 80 | 120 | 160 |
| x(HI) | 1 | 0.91 | 0.85 | 0.815 | 0.795 | 0.784 | 0.784 |
②上述反应中,正反应速率为
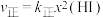 ,逆反应速率为
,逆反应速率为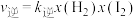 ,其中
,其中 、
、 为速率常数,则
为速率常数,则 为
为 表示)。
表示)。③由上述实验数据计算得到
 ~x(HI)和
~x(HI)和 ~
~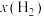 的关系可用下图表示。当升高到某一温度时,反应重新达到平衡,相应的点分别为
的关系可用下图表示。当升高到某一温度时,反应重新达到平衡,相应的点分别为
您最近一年使用:0次
名校
解题方法
5 . 回答下列问题:
(1)研究 之间的转化具有重要意义,下图能表示
之间的转化具有重要意义,下图能表示 之间转化历程。
之间转化历程。

①写出图中所表示的总反应的热化学方程式_______ 。
②上述总反应的决速步骤的活化能是_______ (填写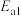 或
或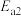 )。
)。
(2) 与
与 在高温下发生反应:
在高温下发生反应: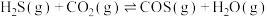
 。在610K时,将0.1mol
。在610K时,将0.1mol  与0.3mol
与0.3mol  充入2.5L的空钢瓶中(体积不变),经过10min,反应达到平衡,反应平衡时水蒸气的物质的量分数为0.125。
充入2.5L的空钢瓶中(体积不变),经过10min,反应达到平衡,反应平衡时水蒸气的物质的量分数为0.125。
①能判断该反应达到化学平衡状态的依据是_______ 。
A.容器中压强不变 B.容器中 的物质的量分数不变
的物质的量分数不变
C. D.容器中混合气体的密度不变
D.容器中混合气体的密度不变
②反应平衡常数K的表达式为_______ , 的平衡转化率α=
的平衡转化率α=_______ 。
③要增大该反应的平衡常数K,可采取的措施是_______ 。
(1)研究
 之间的转化具有重要意义,下图能表示
之间的转化具有重要意义,下图能表示 之间转化历程。
之间转化历程。
①写出图中所表示的总反应的热化学方程式
②上述总反应的决速步骤的活化能是
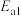 或
或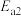 )。
)。(2)
 与
与 在高温下发生反应:
在高温下发生反应: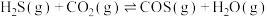
 。在610K时,将0.1mol
。在610K时,将0.1mol  与0.3mol
与0.3mol  充入2.5L的空钢瓶中(体积不变),经过10min,反应达到平衡,反应平衡时水蒸气的物质的量分数为0.125。
充入2.5L的空钢瓶中(体积不变),经过10min,反应达到平衡,反应平衡时水蒸气的物质的量分数为0.125。①能判断该反应达到化学平衡状态的依据是
A.容器中压强不变 B.容器中
 的物质的量分数不变
的物质的量分数不变C.
 D.容器中混合气体的密度不变
D.容器中混合气体的密度不变②反应平衡常数K的表达式为
 的平衡转化率α=
的平衡转化率α=③要增大该反应的平衡常数K,可采取的措施是
您最近一年使用:0次
2023-05-19更新
|
328次组卷
|
2卷引用:广东省华南师范大学附属中学2022-2023学年高二上学期期中考试化学试题
名校
6 . 已知:NO和O2转化为NO2的反应机理如下:
①2NO(g) N2O2(g)(快) △H1<0 平衡常数K1
N2O2(g)(快) △H1<0 平衡常数K1
②N2O2(g)+O2(g) 2NO2(g)(慢) △H2<0 平衡常数K2
2NO2(g)(慢) △H2<0 平衡常数K2

下列说法不正确的是
①2NO(g)
 N2O2(g)(快) △H1<0 平衡常数K1
N2O2(g)(快) △H1<0 平衡常数K1②N2O2(g)+O2(g)
 2NO2(g)(慢) △H2<0 平衡常数K2
2NO2(g)(慢) △H2<0 平衡常数K2
下列说法不正确的是
A.2NO(g)+O2(g)  2NO2(g)的△H= △H1+△H2 2NO2(g)的△H= △H1+△H2 |
B.反应②的速率大小决定2NO(g)+O2(g)  2NO2(g)的反应速率 2NO2(g)的反应速率 |
| C.反应过程中的能量变化可用图a表示 |
D.2NO(g)+O2(g)  2NO2(g)的平衡常数K=K1×K2 2NO2(g)的平衡常数K=K1×K2 |
您最近一年使用:0次
7 . 碳及其化合物在化工生产中有着广泛的应用。
I.合成二甲醚的三步反应如下:
2H2(g)+CO(g) CH3OH(g)ΔH1
CH3OH(g)ΔH1
2CH3OH(g) CH3OCH3(g)+H2O(g)ΔH2
CH3OCH3(g)+H2O(g)ΔH2
CO(g)+H2O(g) CO2(g)+H2(g)ΔH3
CO2(g)+H2(g)ΔH3
(1)3H2(g)+3CO(g) CH3OCH3(g)+CO2(g)的ΔH是_______。
CH3OCH3(g)+CO2(g)的ΔH是_______。
II.在容积固定的密闭容器中,发生反应CO2(g)+H2(g) CO(g)+H2O(g),化学平衡常数K和温度t的关系如下表:
CO(g)+H2O(g),化学平衡常数K和温度t的关系如下表:
请回答下列问题:
(2)该反应的化学平衡常数表达式为K=_______ 。
(3)该反应为_______ 反应(填“吸热”或“放热”)。
(4)不能判断该反应达到化学平衡状态的是_______ (填字母)。
a.容器中总压强不变 b.混合气体中c(CO)不变
c.H2消耗的速率与H2O消耗的速率相等 d.c(CO2)=c(CO)
(5)若1200℃时,在某时刻反应混合物中CO2、H2、CO、H2O的浓度分别为2mol/L、2mol/L、4mol/L、4mol/L,则此时上述反应的平衡移动方向为_______ (填“正反应方向”“逆反应方向”或“不移动”)。
I.合成二甲醚的三步反应如下:
2H2(g)+CO(g)
 CH3OH(g)ΔH1
CH3OH(g)ΔH12CH3OH(g)
 CH3OCH3(g)+H2O(g)ΔH2
CH3OCH3(g)+H2O(g)ΔH2CO(g)+H2O(g)
 CO2(g)+H2(g)ΔH3
CO2(g)+H2(g)ΔH3(1)3H2(g)+3CO(g)
 CH3OCH3(g)+CO2(g)的ΔH是_______。
CH3OCH3(g)+CO2(g)的ΔH是_______。| A.ΔH=2ΔH1+ΔH2+ΔH3 | B.ΔH=ΔH1+ΔH2+ΔH3 |
| C.ΔH=ΔH1+2ΔH2+2ΔH3 | D.ΔH=2ΔH1+ΔH2ΔH3 |
II.在容积固定的密闭容器中,发生反应CO2(g)+H2(g)
 CO(g)+H2O(g),化学平衡常数K和温度t的关系如下表:
CO(g)+H2O(g),化学平衡常数K和温度t的关系如下表:| t/℃ | 700 | 800 | 830 | 1000 | 1200 |
| K | 0.6 | 0.9 | 1.0 | 1.7 | 2.6 |
请回答下列问题:
(2)该反应的化学平衡常数表达式为K=
(3)该反应为
(4)不能判断该反应达到化学平衡状态的是
a.容器中总压强不变 b.混合气体中c(CO)不变
c.H2消耗的速率与H2O消耗的速率相等 d.c(CO2)=c(CO)
(5)若1200℃时,在某时刻反应混合物中CO2、H2、CO、H2O的浓度分别为2mol/L、2mol/L、4mol/L、4mol/L,则此时上述反应的平衡移动方向为
您最近一年使用:0次
名校
8 . 甲烷和氯气都是重要的化工原料。
I.CH4在光照条件下与C12反应,可得到各种氯代甲烷。
(1)CH4氯代的机理为自由基(带有单电子的原子或原子团,如C1·、·CH3)反应,包括以下几步:
写出由CH3Cl生成CH2Cl2过程中链传递的方程式:_______ ,_______ 。
(2)丙烷氯代反应中链传递的一步反应能量变化如下。

推知−CH3中C−H键能比-CH2-中C−H键能_______ (填“大”或“小”)。
II.甲烷重整制合成气,主要反应如下:
i.CH4(g)+H2O(g)=CO(g)+3H2(g) ΔH1
ii.CH4(g)+CO2(g)=2CO(g)+2H2(g) ΔH2
各反应平衡常数与温度的关系如图。
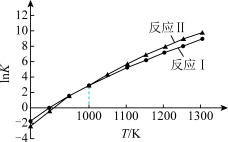
(3)①假设ΔH、ΔS不随温度变化,平衡常数与温度间存在的关系为:lnK1−lnK2= (
( −
− ),R为正常数。则ΔH1
),R为正常数。则ΔH1_______ 0(填“>”或“<”);ΔH1_______ ΔH2(填“>”或“<”)。
②通过调整投料比可调控平衡时合成气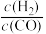 的值。1000K,平衡时
的值。1000K,平衡时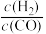 =2,则
=2,则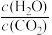 =
=_______ ,应控制投料比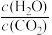 =
=_______ 。
III.氯碱工业是化工产业的重要基础,其装置示意图如图。

(4)X为_______ ,Y为_______ 。(写化学式)
(5)淡盐水中含少量的HClO,阴极区生成NaOH的物质的量小于氢气的两倍,下列关于造成NaOH的物质的量小于氢气的两倍的原因中合理的是_______ (填序号)。
a.Cl-在电极上放电,产生HClO
b.有H+穿过阳离子交换膜
c.阳离子交换膜破损导致OH-向阳极区迁移
d.O2在阴极放电
I.CH4在光照条件下与C12反应,可得到各种氯代甲烷。
(1)CH4氯代的机理为自由基(带有单电子的原子或原子团,如C1·、·CH3)反应,包括以下几步:
| I.链引发 | II.链传递 | III.链终止 |
Cl2 2Cl∙ 2Cl∙ | Cl∙+CH4→∙CH3+HCl ∙CH3+Cl2→CH3Cl+Cl∙ …… | 2Cl∙→Cl2 Cl∙+∙CH3→CH3Cl …… |
写出由CH3Cl生成CH2Cl2过程中链传递的方程式:
(2)丙烷氯代反应中链传递的一步反应能量变化如下。

推知−CH3中C−H键能比-CH2-中C−H键能
II.甲烷重整制合成气,主要反应如下:
i.CH4(g)+H2O(g)=CO(g)+3H2(g) ΔH1
ii.CH4(g)+CO2(g)=2CO(g)+2H2(g) ΔH2
各反应平衡常数与温度的关系如图。

(3)①假设ΔH、ΔS不随温度变化,平衡常数与温度间存在的关系为:lnK1−lnK2=
 (
( −
− ),R为正常数。则ΔH1
),R为正常数。则ΔH1②通过调整投料比可调控平衡时合成气
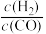 的值。1000K,平衡时
的值。1000K,平衡时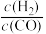 =2,则
=2,则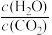 =
=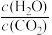 =
=III.氯碱工业是化工产业的重要基础,其装置示意图如图。

(4)X为
(5)淡盐水中含少量的HClO,阴极区生成NaOH的物质的量小于氢气的两倍,下列关于造成NaOH的物质的量小于氢气的两倍的原因中合理的是
a.Cl-在电极上放电,产生HClO
b.有H+穿过阳离子交换膜
c.阳离子交换膜破损导致OH-向阳极区迁移
d.O2在阴极放电
您最近一年使用:0次
名校
解题方法
9 . 已知相同条件下:(1)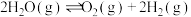
 ;(2)
;(2)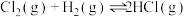
 ;(3)
;(3)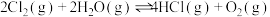
 ,则
,则 、
、 、
、 的关系正确的是
的关系正确的是
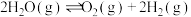
 ;(2)
;(2)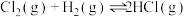
 ;(3)
;(3)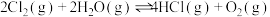
 ,则
,则 、
、 、
、 的关系正确的是
的关系正确的是A.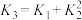 | B.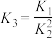 | C.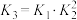 | D.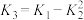 |
您最近一年使用:0次
2022-12-20更新
|
269次组卷
|
5卷引用:广东省佛山市顺德区容山中学2022-2023学年高二上学期期中测试化学试题
广东省佛山市顺德区容山中学2022-2023学年高二上学期期中测试化学试题辽宁省协作校2022-2023学年高二上学期第一次考试化学试题河北省邢台市2022-2023学年高二上学期第一次月考化学试题 广东省江门市棠下中学2023-2024学年高二上学期10月月考化学试题(已下线)第04讲 化学平衡状态 化学平衡常数-【暑假自学课】2023年新高二化学暑假精品课(人教版2019选择性必修1)
名校
10 . 下列化学用语表示正确的是
A. 在水中的电离方程式: 在水中的电离方程式: |
B. 在水中的水解方程式: 在水中的水解方程式: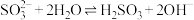 |
C.表示 燃烧热的热化学方程式: 燃烧热的热化学方程式: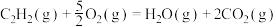  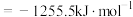 |
D.可逆反应 的平衡常数: 的平衡常数: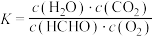 |
您最近一年使用:0次
2022-12-16更新
|
254次组卷
|
5卷引用:广东省佛山市龙江中学、勒流中学、北滘中学等十五校2022-2023学年高二上学期12月联考化学试题



