名校
1 . 一定条件下,通过下列反应可以制备特种陶瓷的原料 MgO, MgSO4(s) + CO(g) ⇌ MgO(s) + CO2(g) + SO2(g) ΔH > 0。该反应在恒容的密闭容器中达到平衡后(A 点),若仅改变图中横坐标 x 的值, 重新达到平衡后,纵坐标 y 随 x 变化趋势合理的是( )(忽略固体物质所占有的体积)
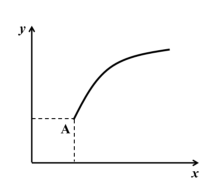

| A.x 为温度,y 为容器内混合气体的密度 |
| B.x 为 MgSO4的质量,y 为 CO 的平衡转化率 |
| C.x 为 CO2的物质的量,y 为 CO 的平衡转化率 |
| D.x 为 SO2的浓度,y 为 CO2的平衡浓度 |
您最近一年使用:0次
2020-10-28更新
|
344次组卷
|
4卷引用:安徽涡阳县育萃中学2020-2021学年高二上学期第三次月考化学试题
名校
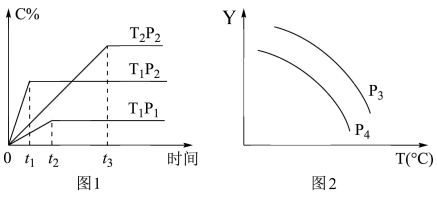
2 . 在某容积一定的密闭容器中,有下列可逆反应xA(g)+B(g) 2C(g),反应曲线(T表示温度,p表示压强,C%表示C的体积分数)如图所示,试判断对图的说法中一定正确的是( )
2C(g),反应曲线(T表示温度,p表示压强,C%表示C的体积分数)如图所示,试判断对图的说法中一定正确的是( )

 2C(g),反应曲线(T表示温度,p表示压强,C%表示C的体积分数)如图所示,试判断对图的说法中一定正确的是( )
2C(g),反应曲线(T表示温度,p表示压强,C%表示C的体积分数)如图所示,试判断对图的说法中一定正确的是( )

| A.若p3>p4,则Y轴可表示C物质在平衡体积中的百分含量 |
| B.若p3<p4,则Y轴可表示混合气体的相对分子质量 |
| C.x=2 |
| D.该反应是吸热反应 |
您最近一年使用:0次
名校
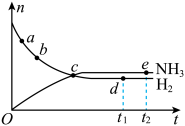
3 . 合成氨工业对国民经济和社会发展具有重要的意义。对于密闭容器中的反应:N2(g)+3H2(g) 2NH3(g)(正反应为放热反应),673 K,30 MPa下,n(NH3)和n(H2)随时间t变化的关系示意图如图所示。下列叙述中正确的是( )
2NH3(g)(正反应为放热反应),673 K,30 MPa下,n(NH3)和n(H2)随时间t变化的关系示意图如图所示。下列叙述中正确的是( )
 2NH3(g)(正反应为放热反应),673 K,30 MPa下,n(NH3)和n(H2)随时间t变化的关系示意图如图所示。下列叙述中正确的是( )
2NH3(g)(正反应为放热反应),673 K,30 MPa下,n(NH3)和n(H2)随时间t变化的关系示意图如图所示。下列叙述中正确的是( )
| A.c点处正反应速率和逆反应速率相等 |
| B.a点处正反应速率比b点处的大 |
| C.d点(t1时刻)和e点(t2时刻)处n(N2)不同 |
| D.t2点时刻,正反应速率大于逆反应速率 |
您最近一年使用:0次
2020-10-19更新
|
432次组卷
|
19卷引用:安徽省蚌埠第三中学2019-2020学年高二上学期开学考试化学试题
安徽省蚌埠第三中学2019-2020学年高二上学期开学考试化学试题2014-2015学年广东省深圳市高级中学高一下期末化学试卷江苏省徐州市第一中学2016-2017学年高一下学期期中考试化学试题浙江省金华市东阳中学2016-2017学年高一6月月考化学试题浙江省东阳中学2016-2017学年高一5月月考化学试题黑龙江省佳木斯市第一中学2016-2017学年高一下学期期末考试化学试题(已下线)2019年3月30日 《每日一题》 必修2 周末培优第2章 第3节 化学反应的快慢和限度第2章 第2节 化学反应的快慢和限度四川省攀枝花市第十五中学2019-2020学年高二上学期第一次月考化学试题鲁科版(2019)高一必修第二册 第2章 化学键 反应规律 第三节 化学反应的快慢和限度 方法帮天津市蓟县擂鼓台中学2020-2021学年高二上学期第一次月考化学试题(已下线)练习7 化学平衡(二)-2020-2021学年【补习教材·寒假作业】高二化学(人教版)(已下线)6.2.2 化学反应的限度(练好题)(能力提升)-2020-2021学年高一化学新教材新理念新设计同步课堂(人教2019必修第二册)(已下线)6.2.1 化学平衡(第1课时 可逆反应和化学平衡状态)-【帮课堂】2021-2022学年高一化学同步精品讲义(沪科版2020必修第二册)天津市实验中学滨海学校2021-2022学年高二上学期期中质量监测化学试题湖南省郴州市2022-2023学年高一下学期期末考试(选择考)化学试题江西省宜春市丰城市第九中学2023-2024学年高二上学期开学考试化学(B卷)试题广东省深圳市宝安中学高中部2020-2021学年高一下学期期中考试化学试卷
名校
解题方法
4 . 对于反应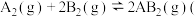 正反应为放热反应
正反应为放热反应 ,下列各图所表示的变化符合勒夏特列原理的是
,下列各图所表示的变化符合勒夏特列原理的是
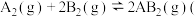 正反应为放热反应
正反应为放热反应 ,下列各图所表示的变化符合勒夏特列原理的是
,下列各图所表示的变化符合勒夏特列原理的是A. | B. | C. | D. |
您最近一年使用:0次
2020-10-19更新
|
137次组卷
|
2卷引用:安徽省宣城二中2020-2021学年高二上学期第一次月考化学试题
解题方法
5 . 可逆反应 aA(s) + bB(g)⇌cC(g) + dD(g)进行过程中,当其他条件不变时,C 的体积分数 C%与温度(T)、压强(P)的关系如图所示。下列叙述正确的是( )


| A.化学方程式中,b > c + d |
| B.达到平衡后,加入催化剂,C 的体积分数增大 |
| C.达到平衡后,升高温度,平衡向左移动 |
| D.在P1时化学平衡常数大于P2时化学平衡常数 |
您最近一年使用:0次
2020-10-16更新
|
192次组卷
|
4卷引用:安徽省蚌埠田家炳中学、蚌埠五中2020-2021学年高二上学期期中考试化学试题
名校
解题方法
6 . 将Ce(SO4)2·4H2O(摩尔质量为404 g·mol-1)在空气中加热,样品的固体残留率(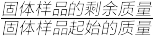 ×100%)随温度的变化如下图所示。
×100%)随温度的变化如下图所示。
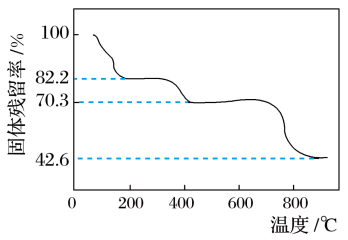
当固体残留率为70.3%时,所得固体可能为
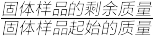 ×100%)随温度的变化如下图所示。
×100%)随温度的变化如下图所示。
当固体残留率为70.3%时,所得固体可能为
| A.Ce(SO4)2 | B.Ce2(SO4)3 | C.CeOSO4 | D.无法计算 |
您最近一年使用:0次
2020-10-08更新
|
162次组卷
|
3卷引用:安徽省太和第一中学2021届高三上学期第一次校本教材反馈测试化学试题
安徽省太和第一中学2021届高三上学期第一次校本教材反馈测试化学试题(已下线)专题讲座(三) 热重分析中的物质成分的判断(精练)-2022年高考化学一轮复习讲练测黑龙江省齐齐哈尔市普高联谊校2022-2023学年高三上学期期中考试化学试题
名校
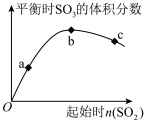
7 . 在一定温度下,只改变起始时反应物中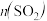 ,对反应
,对反应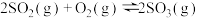 的影响如图所示,下列说法正确的是( )
的影响如图所示,下列说法正确的是( )
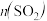 ,对反应
,对反应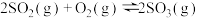 的影响如图所示,下列说法正确的是( )
的影响如图所示,下列说法正确的是( )
A.a、b、c点均为平衡点,且b点时 的转化率最大 的转化率最大 |
B.b点时 与 与 的物质的量之比约为2∶1 的物质的量之比约为2∶1 |
C.平衡常数: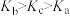 |
D.反应速率: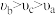 |
您最近一年使用:0次
2020-10-05更新
|
310次组卷
|
9卷引用:安徽省蚌埠第三中学2019-2020学年高二上学期期中考试化学试题
安徽省蚌埠第三中学2019-2020学年高二上学期期中考试化学试题安徽省滁州市定远县育才学校2021-2022学年高二上学期期中考试(实验班)化学试题浙江省“七彩阳光”新高考研究联盟2018-2019学年高二下学期期中化学试题辽宁省沈阳铁路实验中学2020届高三11月月考化学试题夯基提能2020届高三化学选择题对题专练——选修4化学反应原理—— 化学平衡的图像分析人教版(2019)高二选择性必修第一册 第二章 化学反应速率与化学平衡 第二节 化学平衡 方法帮天津市静海区第一中学2020-2021学年高二11月考化学试题(已下线)2.4 化学反应的调控-2021-2022学年高二化学课后培优练(人教版2019选择性必修1) 天津市武清区杨村第一中学2023-2024学年高二上学期第一次月考化学试题
名校
解题方法
8 . 反应2AB3(g) A2(g)+3B2(g)(正反应为吸热反应)的平衡体系中,下列关系中
A2(g)+3B2(g)(正反应为吸热反应)的平衡体系中,下列关系中正确 的是( )(图中AB3%为体积百分数,v为反应速率)
 A2(g)+3B2(g)(正反应为吸热反应)的平衡体系中,下列关系中
A2(g)+3B2(g)(正反应为吸热反应)的平衡体系中,下列关系中A.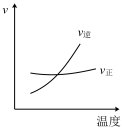 | B. |
C.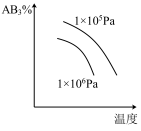 | D.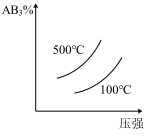 |
您最近一年使用:0次
2020-09-24更新
|
191次组卷
|
3卷引用:安徽省淮北市孙疃中学2020-2021学年高二上学期第一次月考化学(实验班)试题
名校
解题方法
9 . 在容积均为1 L的a、 b、c三个密闭容器中,分别放入铁粉并充入1 mol CO,控制在不同温度下发生反应:5CO(g) + Fe(s)  Fe(CO)5(g),当反应进行到5 min时,测得CO的体积分数与温度的关系如图所示。下列说法一定正确的是
Fe(CO)5(g),当反应进行到5 min时,测得CO的体积分数与温度的关系如图所示。下列说法一定正确的是
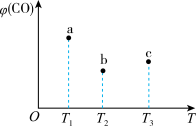
 Fe(CO)5(g),当反应进行到5 min时,测得CO的体积分数与温度的关系如图所示。下列说法一定正确的是
Fe(CO)5(g),当反应进行到5 min时,测得CO的体积分数与温度的关系如图所示。下列说法一定正确的是
A.正反应为吸热反应,平衡常数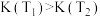 |
B.反应进行到5 min时,a容器中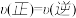 |
C.b中 大于a中 大于a中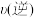 |
| D.达到平衡时,a、b、c中CO的转化率:b > c >a |
您最近一年使用:0次
2020-09-15更新
|
1121次组卷
|
19卷引用:安徽省安庆市第七中学2023-2024学年高二上学期期中考试化学试题
安徽省安庆市第七中学2023-2024学年高二上学期期中考试化学试题2017届湖南省郴州市高三第三次质量检测理科综合化学试卷河北省石家庄市第二中学2018届高三12月月考理综化学试题北京市第161中学2017-2018学年高二上学期期中适应性训练化学试题(已下线)黄金30题系列 高二化学(选修4) 小题好拿分【提升版】湖南省衡阳市第八中学2018届高三上学期第五次月考化学试题云南省临沧市第一中学2018届高三上学期期末考试化学试题江西省南昌市新建县第一中学2019-2020学年高二上学期期末考试化学试题鲁科版(2019)选择性必修1第2章 化学反应的方向、限度与速率 专题3 化学平衡图像分析湖南省娄底市双峰县第一中学2020-2021学年高二上学期9月入学考试化学试题高中必刷题高二选择性必修1第二章 化学反应速率与化学平衡 专题2 化学平衡图像分析(已下线)【南昌新东方】1. 新建二中 李莹 梁莎鲁科版(2019)高二选择性必修第一册第2章 化学反应的方向、限度与速率 高考挑战区 过模拟江西省南昌市新建区第二中学2020-2021学年高二上学期10月份考试化学试题(已下线)专题2.2.4 化学平衡图像(备作业)-【上好课】2021-2022学年高二化学同步备课系列(人教版2019选择性必修1)山东省实验中学2022届高三第一次诊断考试化学试题山东省济南外国语学校2021-2022学年高三上学期11月月考化学试题陕西省咸阳市实验中学2021-2022学年高二上学期第二次月考化学试题山东省滕州市第一中学2023-2024学年高二上学期10月月考化学试题
解题方法
10 . 甲醇与水蒸气重整制氢可直接用于燃料电池。回答下列问题:
(1)已知甲醇分解反应I:CH3OH(g) CO(g)+2H2(g) △H1=+91.6 kJ·mol–1
CO(g)+2H2(g) △H1=+91.6 kJ·mol–1
水煤气变换反应II:CO(g)+H2O(g) CO2(g)+H2(g) △H2= – 41.1 kJ·mol–1
CO2(g)+H2(g) △H2= – 41.1 kJ·mol–1
则CH3OH(g)+H2O(g) CO2(g)+3H2(g) △H3=
CO2(g)+3H2(g) △H3=________ kJ·mol–1
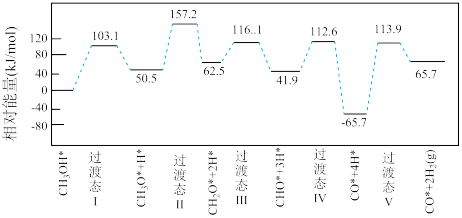
(2)我国学者采用量子力学方法,通过计算机模拟,研究了在钯基催化剂表面上甲醇分解反应I的历程,得到甲醇在钯基催化剂表面发生解离时五个路径与相对能量关系如下图所示,其中吸附在钯催化剂表面上的物种用*标注。该历程中最小能垒(活化能)E正=_______ kJ·mol–1,写出该步骤的化学方程式____________________ 。
(3)在100kPa下,将总进料量1mol且n(CH3OH):n(H2O)=1:1.3的混合气体充入已放有催化剂的刚性密闭容器中反应。
①实验测得水煤气变换反应II的速率随温度的升高明显下降,原因是__________ 。
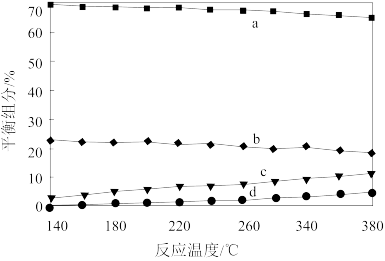
②平衡时,测得CH3OH的含量在给定温度范围内极小,H2、H2O(g)、CO、CO2四种组分含量与反应温度关系如图所示,b、d曲线对应物质的化学式分别为________ 、________ 。
(4)353K时,在刚性容器中充入CH3OH(g),发生反应:CH3OH(g) CO(g)+2H2(g)。体系的总压强p随时间t的变化如表所示(t=∞时,该反应达到平衡):
CO(g)+2H2(g)。体系的总压强p随时间t的变化如表所示(t=∞时,该反应达到平衡):
则0~5min内v(CH3OH)=______ kPa·min-1。该反应的平衡常数KP=__________ (kPa)2(KP为以分压表示的平衡常数,计算结果保留1位小数)。
(1)已知甲醇分解反应I:CH3OH(g)
 CO(g)+2H2(g) △H1=+91.6 kJ·mol–1
CO(g)+2H2(g) △H1=+91.6 kJ·mol–1水煤气变换反应II:CO(g)+H2O(g)
 CO2(g)+H2(g) △H2= – 41.1 kJ·mol–1
CO2(g)+H2(g) △H2= – 41.1 kJ·mol–1则CH3OH(g)+H2O(g)
 CO2(g)+3H2(g) △H3=
CO2(g)+3H2(g) △H3=(2)我国学者采用量子力学方法,通过计算机模拟,研究了在钯基催化剂表面上甲醇分解反应I的历程,得到甲醇在钯基催化剂表面发生解离时五个路径与相对能量关系如下图所示,其中吸附在钯催化剂表面上的物种用*标注。该历程中最小能垒(活化能)E正=

(3)在100kPa下,将总进料量1mol且n(CH3OH):n(H2O)=1:1.3的混合气体充入已放有催化剂的刚性密闭容器中反应。
①实验测得水煤气变换反应II的速率随温度的升高明显下降,原因是
②平衡时,测得CH3OH的含量在给定温度范围内极小,H2、H2O(g)、CO、CO2四种组分含量与反应温度关系如图所示,b、d曲线对应物质的化学式分别为

(4)353K时,在刚性容器中充入CH3OH(g),发生反应:CH3OH(g)
 CO(g)+2H2(g)。体系的总压强p随时间t的变化如表所示(t=∞时,该反应达到平衡):
CO(g)+2H2(g)。体系的总压强p随时间t的变化如表所示(t=∞时,该反应达到平衡):t/min | 0 | 5 | 10 | 15 | 20 | ∞ |
p/kPa | 100.0 | 107.4 | 112.6 | 116.4 | 118.6 | 120.0 |
则0~5min内v(CH3OH)=
您最近一年使用:0次



