1 . 国家主席习近平提出了中国应对气候变化的两个目标:二氧化碳排放力争于2030年前达到峰值,于2060年前实现碳中和。杭州亚运会火炬使用的燃料为“零碳甲醇”,是利用焦炉气中的H2与从工业尾气中捕集的二氧化碳反应合成,实现废碳再生、循环内零碳排放。
(1)已知:某温度下物质的相对能量如下图1所示,在In2O3催化下用CO2(g)和H2(g)制备CH3OH(g)的反应原理如图2。___________ 。
①该反应在___________ (填“高温”或“低温”)下能自发进行。
②向一绝热恒容密闭容器中充入等物质的量的H2和CO2进行反应,下面不能判断该反应已达到平衡状态的是___________ 。
A混合气体的密度保持不变 B.总压强不变
C.平衡常数不变 D.H2的转化率保持不变
(2)煤制甲醇的生产工艺中,由合成气(组成为H2、CO和少量的CO2)可直接制备甲醇,主要包括以下三个反应:
ⅰ.CO2(g)+H2(g) CO(g)+H2O(g) △H1=+41.1kJ/mol
CO(g)+H2O(g) △H1=+41.1kJ/mol
ⅱ.CO(g)+2H2(g) CH3OH(g) △H1=+90.1kJ/mol
CH3OH(g) △H1=+90.1kJ/mol
ⅲ.CO2(g)+3H2(g) CH3OH(g)+H2O(g) △H3
CH3OH(g)+H2O(g) △H3
t℃、100kPa下,将3molH2(g)、1molCO2(g)和6molKr(g)投入一恒容密闭容器中发生反应。反应达到平衡时,测得容器中CH3OH(g)为0.5mol、CO(g)为0.2mol。
①CO2的平衡转化率为___________ 。
②反应ⅱ的平衡常数Kx=___________ (保留位小数)[对于反应aM(g)+bN(g) cZ(g)+dQg),Kx=
cZ(g)+dQg),Kx=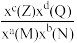 ,x为物质的量分数]。
,x为物质的量分数]。
(3)2023年11月20日,福岛核电站第三批次核污水排放结束,从8月24日正式开启排污,不到三个月的时间,己有超2.3万吨核污水流入太平洋,引发了国际社会的广泛关注和担忧。铀(U)可用作核燃料,核废料中+6价的铀[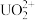 ]可以通过电化学还原法处理,+6价的铀被还原为U4+的电化学装置如图所示:
]可以通过电化学还原法处理,+6价的铀被还原为U4+的电化学装置如图所示:___________ 。
②阴极上可能发生副反应: +3H++2e-=HNO2+H2O、2HNO2+U4+=
+3H++2e-=HNO2+H2O、2HNO2+U4+=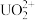 +2NO↑+2H+,为了减少副反应造成的影响,可向阴极区溶液中加入N2H5NO3,发生的反应为:2HNO2+
+2NO↑+2H+,为了减少副反应造成的影响,可向阴极区溶液中加入N2H5NO3,发生的反应为:2HNO2+ =N2O↑+N2↑+3H2O+H+,溶液中加入N2H5NO3的具体作用是
=N2O↑+N2↑+3H2O+H+,溶液中加入N2H5NO3的具体作用是___________ 。
③电还原处理+6价的铀转移1rnole-,阴极区H+减少___________ mol(不考虑副反应)。
(1)已知:某温度下物质的相对能量如下图1所示,在In2O3催化下用CO2(g)和H2(g)制备CH3OH(g)的反应原理如图2。

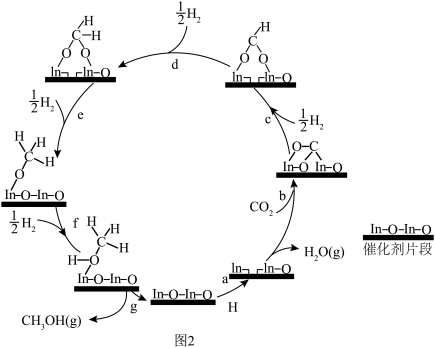
①该反应在
②向一绝热恒容密闭容器中充入等物质的量的H2和CO2进行反应,下面不能判断该反应已达到平衡状态的是
A混合气体的密度保持不变 B.总压强不变
C.平衡常数不变 D.H2的转化率保持不变
(2)煤制甲醇的生产工艺中,由合成气(组成为H2、CO和少量的CO2)可直接制备甲醇,主要包括以下三个反应:
ⅰ.CO2(g)+H2(g)
 CO(g)+H2O(g) △H1=+41.1kJ/mol
CO(g)+H2O(g) △H1=+41.1kJ/molⅱ.CO(g)+2H2(g)
 CH3OH(g) △H1=+90.1kJ/mol
CH3OH(g) △H1=+90.1kJ/mol ⅲ.CO2(g)+3H2(g)
 CH3OH(g)+H2O(g) △H3
CH3OH(g)+H2O(g) △H3t℃、100kPa下,将3molH2(g)、1molCO2(g)和6molKr(g)投入一恒容密闭容器中发生反应。反应达到平衡时,测得容器中CH3OH(g)为0.5mol、CO(g)为0.2mol。
①CO2的平衡转化率为
②反应ⅱ的平衡常数Kx=
 cZ(g)+dQg),Kx=
cZ(g)+dQg),Kx=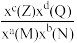 ,x为物质的量分数]。
,x为物质的量分数]。(3)2023年11月20日,福岛核电站第三批次核污水排放结束,从8月24日正式开启排污,不到三个月的时间,己有超2.3万吨核污水流入太平洋,引发了国际社会的广泛关注和担忧。铀(U)可用作核燃料,核废料中+6价的铀[
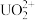 ]可以通过电化学还原法处理,+6价的铀被还原为U4+的电化学装置如图所示:
]可以通过电化学还原法处理,+6价的铀被还原为U4+的电化学装置如图所示: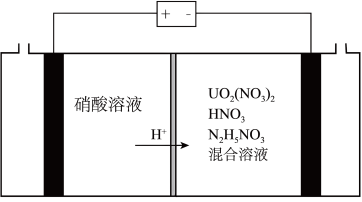
②阴极上可能发生副反应:
 +3H++2e-=HNO2+H2O、2HNO2+U4+=
+3H++2e-=HNO2+H2O、2HNO2+U4+=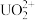 +2NO↑+2H+,为了减少副反应造成的影响,可向阴极区溶液中加入N2H5NO3,发生的反应为:2HNO2+
+2NO↑+2H+,为了减少副反应造成的影响,可向阴极区溶液中加入N2H5NO3,发生的反应为:2HNO2+ =N2O↑+N2↑+3H2O+H+,溶液中加入N2H5NO3的具体作用是
=N2O↑+N2↑+3H2O+H+,溶液中加入N2H5NO3的具体作用是③电还原处理+6价的铀转移1rnole-,阴极区H+减少
您最近一年使用:0次
名校
解题方法
2 . 已知“凡气体分子总数增加的反应都是熵增大的反应”。下列反应在任何温度下都不自发进行的是
A.2O3(g)=3O2(g)  H<0 H<0 |
B.2CO(g)=2C(s)+O2(g)  H>0 H>0 |
C.N2(g)+3H2(g)=2NH3(g)  H<0 H<0 |
D.CaCO3(s)=CaO(s)+CO2(g)  H>0 H>0 |
您最近一年使用:0次
2024-04-21更新
|
46次组卷
|
2卷引用:江苏省徐州市沛县湖西中学2023-2024学年高二下学期第一次调研考试化学试题
3 . 为了实现“碳中和”,研发 的利用技术成为热点。
的利用技术成为热点。
反应I:
反应Ⅱ:
请回答:
(1)反应I能够自发进行的条件是__________ 。
(2)向 的恒容密闭容器中充入
的恒容密闭容器中充入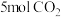 和
和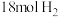 (起始压强为
(起始压强为 ),在不同温度下同时发生上述反应I和反应Ⅱ,得到平衡时各含碳物质的物质的量
),在不同温度下同时发生上述反应I和反应Ⅱ,得到平衡时各含碳物质的物质的量 与温度
与温度 的关系如下图所示。
的关系如下图所示。
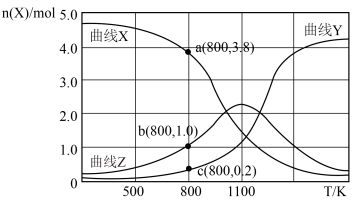
①写出曲线Y表示的含碳元素物质的化学式__________ 。
② 时,反应Ⅱ的平衡常数
时,反应Ⅱ的平衡常数
__________ [对于气相反应,用某组分 的平衡压强
的平衡压强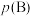 代替物质的量浓度
代替物质的量浓度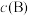 也可表示平衡常数,记作
也可表示平衡常数,记作 ,如
,如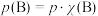 ,
, 为平衡总压强,
为平衡总压强,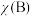 为平衡系统中
为平衡系统中 的物质的量分数]。
的物质的量分数]。
(3)可用 与
与 催化加氢制乙醇,反应原理为:
催化加氢制乙醇,反应原理为: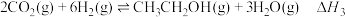 。经实验测定在不同投料比
。经实验测定在不同投料比 、
、 、
、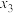 时
时 的平衡转化率与温度的关系如图所示
的平衡转化率与温度的关系如图所示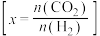 :
:

①上述反应的活化能 (正)
(正)__________  (逆)(填“
(逆)(填“ ”、“
”、“ ”或“
”或“ ”)。
”)。
② 、
、 、
、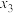 由大到小的顺序是
由大到小的顺序是__________ 。
③从平衡角度分析,随温度升高,不同投料比时 的平衡转化率趋于相近的原因
的平衡转化率趋于相近的原因__________ 。
(4)科学家提出由 制取
制取 的太阳能工艺如图。已知“重整系统”发生的反应中
的太阳能工艺如图。已知“重整系统”发生的反应中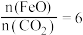 ,则
,则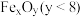 的化学式为
的化学式为__________ 。

(5)水系可逆 电池可吸收利用
电池可吸收利用 ,将两组阴离子、阳离子复合膜反向放置分隔两室电解液充、放电时,复合膜间的
,将两组阴离子、阳离子复合膜反向放置分隔两室电解液充、放电时,复合膜间的 解离成
解离成 和
和 ,工作原理如图所示:
,工作原理如图所示:

①放电时复合膜中向 极移动的离子是
极移动的离子是__________ 。
②充电时多孔 纳米片电极的电极反应式为
纳米片电极的电极反应式为__________ 。
 的利用技术成为热点。
的利用技术成为热点。反应I:

反应Ⅱ:

请回答:
(1)反应I能够自发进行的条件是
(2)向
 的恒容密闭容器中充入
的恒容密闭容器中充入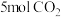 和
和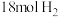 (起始压强为
(起始压强为 ),在不同温度下同时发生上述反应I和反应Ⅱ,得到平衡时各含碳物质的物质的量
),在不同温度下同时发生上述反应I和反应Ⅱ,得到平衡时各含碳物质的物质的量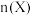 与温度
与温度 的关系如下图所示。
的关系如下图所示。
①写出曲线Y表示的含碳元素物质的化学式
②
 时,反应Ⅱ的平衡常数
时,反应Ⅱ的平衡常数
 的平衡压强
的平衡压强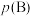 代替物质的量浓度
代替物质的量浓度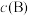 也可表示平衡常数,记作
也可表示平衡常数,记作 ,如
,如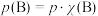 ,
, 为平衡总压强,
为平衡总压强,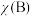 为平衡系统中
为平衡系统中 的物质的量分数]。
的物质的量分数]。(3)可用
 与
与 催化加氢制乙醇,反应原理为:
催化加氢制乙醇,反应原理为: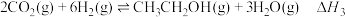 。经实验测定在不同投料比
。经实验测定在不同投料比 、
、 、
、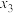 时
时 的平衡转化率与温度的关系如图所示
的平衡转化率与温度的关系如图所示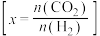 :
:
①上述反应的活化能
 (正)
(正) (逆)(填“
(逆)(填“ ”、“
”、“ ”或“
”或“ ”)。
”)。②
 、
、 、
、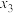 由大到小的顺序是
由大到小的顺序是③从平衡角度分析,随温度升高,不同投料比时
 的平衡转化率趋于相近的原因
的平衡转化率趋于相近的原因(4)科学家提出由
 制取
制取 的太阳能工艺如图。已知“重整系统”发生的反应中
的太阳能工艺如图。已知“重整系统”发生的反应中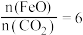 ,则
,则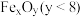 的化学式为
的化学式为
(5)水系可逆
 电池可吸收利用
电池可吸收利用 ,将两组阴离子、阳离子复合膜反向放置分隔两室电解液充、放电时,复合膜间的
,将两组阴离子、阳离子复合膜反向放置分隔两室电解液充、放电时,复合膜间的 解离成
解离成 和
和 ,工作原理如图所示:
,工作原理如图所示:
①放电时复合膜中向
 极移动的离子是
极移动的离子是②充电时多孔
 纳米片电极的电极反应式为
纳米片电极的电极反应式为
您最近一年使用:0次
4 . 随着温室效应越来越严重,降低空气中二氧化碳含量成为研究热点,回答下列问题。
将二氧化碳转化为甲醇是目前重要的碳中和方法,体系中发生如下反应:
主反应:①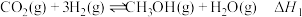
副反应:②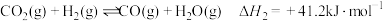
已知: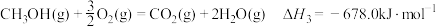

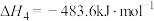
(1)反应①的
___________ (用含 、
、 的代数式表示),该反应在
的代数式表示),该反应在___________ (填“高温”“低温”或“任何温度下”)下有利于自发进行。
(2)密闭容器中通入CO2和H2仅发生反应①,仅改变以下一个条件,能提高H2平衡转化率的措施有___________(填正确答案的编号)。
(3)某温度下,1L恒容密闭容器中加入1molCO2(g)和3molH2(g),发生反应①和反应②,平衡时CO2的转化率为α,CO(g)的物质的量为bmol,计算反应①的平衡常数K=___________ (用含有α、b的计算式表示)。
(4)副反应②在Cu催化时,反应历程如下(*表示吸附在催化剂表面),请写出步骤iv的方程式。
i: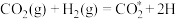
ii: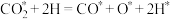
iii:
iv:___________
v: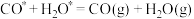
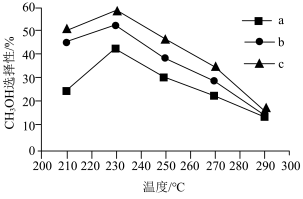
(5)选择不同的温度和催化剂(a、b、c)都对甲醇产率有影响,根据下图,最佳反应条件为___________ 。
(6)电解还原二氧化碳也能实现碳中和,图2为电解还原CO2制备CO,同时获得两种副产物的装置:
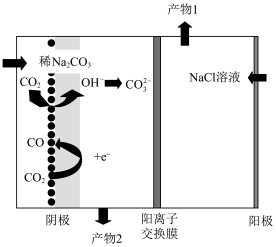
①请写出阳极的电极反应式:___________ 。
②产物2为___________ 。
将二氧化碳转化为甲醇是目前重要的碳中和方法,体系中发生如下反应:
主反应:①
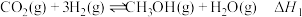
副反应:②
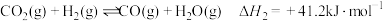
已知:
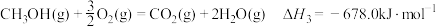

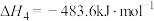
(1)反应①的

 、
、 的代数式表示),该反应在
的代数式表示),该反应在(2)密闭容器中通入CO2和H2仅发生反应①,仅改变以下一个条件,能提高H2平衡转化率的措施有___________(填正确答案的编号)。
| A.恒温恒容时增加CO2(g)用量 | B.恒温恒压下通入惰性气体 |
| C.升高温度 | D.加入催化剂 |
(3)某温度下,1L恒容密闭容器中加入1molCO2(g)和3molH2(g),发生反应①和反应②,平衡时CO2的转化率为α,CO(g)的物质的量为bmol,计算反应①的平衡常数K=
(4)副反应②在Cu催化时,反应历程如下(*表示吸附在催化剂表面),请写出步骤iv的方程式。
i:
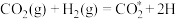
ii:
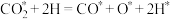
iii:

iv:
v:
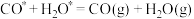
(5)选择不同的温度和催化剂(a、b、c)都对甲醇产率有影响,根据下图,最佳反应条件为

(6)电解还原二氧化碳也能实现碳中和,图2为电解还原CO2制备CO,同时获得两种副产物的装置:

①请写出阳极的电极反应式:
②产物2为
您最近一年使用:0次
5 . Ⅰ.铁触媒催化合成氨经历下图所示①至⑥步基元反应(从状态Ⅰ至状态Ⅶ):
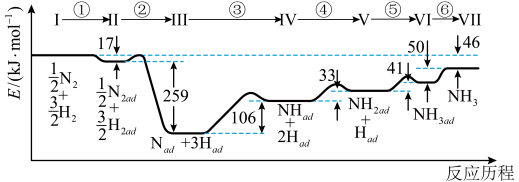
上图中“ad”表示吸附在催化剂表面的物质。
回答下列问题:
(1)根据上图计算合成氨反应的焓变:N2(g)+3H2(g) 2NH3(g) ΔH=
2NH3(g) ΔH=___________ 。
(2)上述反应的ΔS___ 0(填“>”“<”或“=”)。已知:反应N2(g)+3H2(g) 2NH3(g)的|ΔS|=199J/(mol·K),则下列温度中,合成氨反应能自发进行的是
2NH3(g)的|ΔS|=199J/(mol·K),则下列温度中,合成氨反应能自发进行的是____ (填标号)。
A.25℃ B.125℃ C.225℃ D.325℃
Ⅱ.高锰酸钾是一种常用的消毒剂和氧化剂。回答下列问题:
实验(一):电解法制备KMnO4。
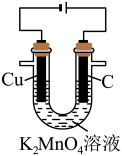
以石墨、铜为电极,电解K2MnO4溶液制备KMnO4溶液,装置如图所示。
(3)电解过程中,Cu极附近电解质溶液的pH______ (填“升高”“降低”或“不变”)。
(4)铜极、石墨极能否互换并简述理由:___________ 。
实验(二):探究K2FeO4和KMnO4氧化性强弱。装置如图所示。

关闭开关K,观察到左烧杯中紫红色溶液变为浅黄色,右烧杯中无色溶液变为紫红色。
(5)关闭K,盐桥中_______ (填离子符号)向左烧杯迁移。
(6)石墨极的电极反应式为_______ 。实验结论是氧化性:
___  (填>”“<”或“=”)。
(填>”“<”或“=”)。

上图中“ad”表示吸附在催化剂表面的物质。
回答下列问题:
(1)根据上图计算合成氨反应的焓变:N2(g)+3H2(g)
 2NH3(g) ΔH=
2NH3(g) ΔH=(2)上述反应的ΔS
 2NH3(g)的|ΔS|=199J/(mol·K),则下列温度中,合成氨反应能自发进行的是
2NH3(g)的|ΔS|=199J/(mol·K),则下列温度中,合成氨反应能自发进行的是A.25℃ B.125℃ C.225℃ D.325℃
Ⅱ.高锰酸钾是一种常用的消毒剂和氧化剂。回答下列问题:
实验(一):电解法制备KMnO4。

以石墨、铜为电极,电解K2MnO4溶液制备KMnO4溶液,装置如图所示。
(3)电解过程中,Cu极附近电解质溶液的pH
(4)铜极、石墨极能否互换并简述理由:
实验(二):探究K2FeO4和KMnO4氧化性强弱。装置如图所示。

关闭开关K,观察到左烧杯中紫红色溶液变为浅黄色,右烧杯中无色溶液变为紫红色。
(5)关闭K,盐桥中
(6)石墨极的电极反应式为

 (填>”“<”或“=”)。
(填>”“<”或“=”)。
您最近一年使用:0次
2024-02-02更新
|
144次组卷
|
2卷引用:湖南省长沙市长郡中学2023-2024学年高二上学期12月阶段性检测化学试题
名校
解题方法
6 . 工业上 加氢制
加氢制 ,为
,为 的减排与再利用提供了一种新策略,该过程中存在如下反应:
的减排与再利用提供了一种新策略,该过程中存在如下反应:
反应Ⅰ:
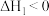
反应Ⅱ:

回答下列问题:
(1)已知: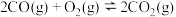
 ,则反应
,则反应

________ (用含 、
、 、
、 的代数式表示)。
的代数式表示)。
(2)关于反应Ⅰ,下列说法正确的有___________(填标号)。
(3)向恒压(p)密闭装置中充入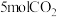 和
和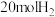 ,在不同温度下同时发生反应Ⅰ和Ⅱ,达平衡时,测得
,在不同温度下同时发生反应Ⅰ和Ⅱ,达平衡时,测得 和
和 的物质的量
的物质的量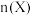 随温度
随温度 变化关系如图所示。
变化关系如图所示。

①曲线 对应物质为
对应物质为____ (填化学式)。
② 达平衡时,反应Ⅰ的平衡常数Kp=
达平衡时,反应Ⅰ的平衡常数Kp=____ (列计算式即可)。
③结合图像分析,达平衡时装置中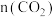 随温度升高的变化趋势为
随温度升高的变化趋势为____ (填标号)。
A.减小 B.增大 C.先减小后增大 D.先增大后减小
④工业制备 通常控制温度在
通常控制温度在 ℃之间的原因是
℃之间的原因是____ 。
(4)通过NOx传感器可监测NOx的含量,其工作原理示意图如下:
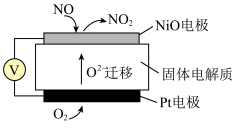
①Pt电极上发生的是______ 反应(填“氧化”或“还原”)。
②写出NiO电极的电极反应式:________ 。
 加氢制
加氢制 ,为
,为 的减排与再利用提供了一种新策略,该过程中存在如下反应:
的减排与再利用提供了一种新策略,该过程中存在如下反应:反应Ⅰ:

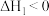
反应Ⅱ:


回答下列问题:
(1)已知:
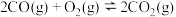
 ,则反应
,则反应

 、
、 、
、 的代数式表示)。
的代数式表示)。(2)关于反应Ⅰ,下列说法正确的有___________(填标号)。
| A.反应物的键能之和高于生成物的键能之和 |
| B.低温条件有利于该反应自发进行 |
| C.混合气体的平均摩尔质量不再改变,说明反应已达平衡 |
D.恒容条件下,充入更多的 能提高单位体积活化分子的百分数 能提高单位体积活化分子的百分数 |
(3)向恒压(p)密闭装置中充入
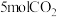 和
和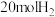 ,在不同温度下同时发生反应Ⅰ和Ⅱ,达平衡时,测得
,在不同温度下同时发生反应Ⅰ和Ⅱ,达平衡时,测得 和
和 的物质的量
的物质的量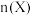 随温度
随温度 变化关系如图所示。
变化关系如图所示。
①曲线
 对应物质为
对应物质为②
 达平衡时,反应Ⅰ的平衡常数Kp=
达平衡时,反应Ⅰ的平衡常数Kp=③结合图像分析,达平衡时装置中
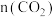 随温度升高的变化趋势为
随温度升高的变化趋势为A.减小 B.增大 C.先减小后增大 D.先增大后减小
④工业制备
 通常控制温度在
通常控制温度在 ℃之间的原因是
℃之间的原因是(4)通过NOx传感器可监测NOx的含量,其工作原理示意图如下:

①Pt电极上发生的是
②写出NiO电极的电极反应式:
您最近一年使用:0次
名校
解题方法
7 . 乙醇是一种绿色能源,也是一种化工原料。
(1)已知几种热化学方程式如下:
①
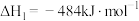
②
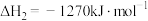
③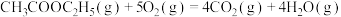

(ⅰ)上述反应中,在任意温度下都能自发进行的是___________ (填序号)。
(ⅱ)我国科学家开发新型催化剂利用乙醇直接制备乙酸乙酯: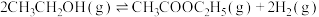

___________  。
。
(2)乙醇是一种储氢材料。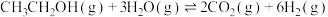
 ,Akande对其动力学机理的研究(*代表物种吸附在催化剂表面上)如图所示:
,Akande对其动力学机理的研究(*代表物种吸附在催化剂表面上)如图所示:
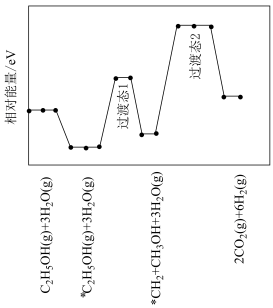
①
___________ 0(填“>”“<”或“=”),总反应分___________ 步反应进行。
②速控反应的方程式为___________ 。
(3)一定温度下,向恒容密闭容器中充入适量乙醇蒸气,发生反应: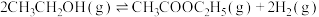 ,下列叙述正确的是___________(填标号)。
,下列叙述正确的是___________(填标号)。
(4)保持总压为 ,向反应器中充入乙醇
,向反应器中充入乙醇 和氮气(不参与反应),发生反应:
和氮气(不参与反应),发生反应: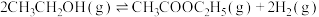 ,测得乙醇的平衡转化率与投料比
,测得乙醇的平衡转化率与投料比 、温度
、温度 的关系如图所示:
的关系如图所示:
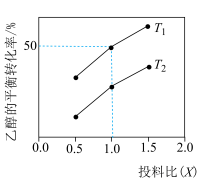
①其他条件不变时,随着 增大,乙醇的平衡转化率增大的原因是
增大,乙醇的平衡转化率增大的原因是_______ ,
_____  (填“>”或“<”)。
(填“>”或“<”)。
② 温度下,投料比为1.0时,平衡常数
温度下,投料比为1.0时,平衡常数 为
为________  (提示:用分压计算的平衡常数为
(提示:用分压计算的平衡常数为 ,分压
,分压 总压
总压 物质的显分数)。
物质的显分数)。
(5)我国科学家开发复合催化剂,实现了在酸性条件下电还原 制备乙醇,阴极反应式为
制备乙醇,阴极反应式为___________ 。
(1)已知几种热化学方程式如下:
①

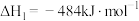
②

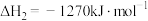
③
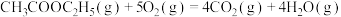

(ⅰ)上述反应中,在任意温度下都能自发进行的是
(ⅱ)我国科学家开发新型催化剂利用乙醇直接制备乙酸乙酯:
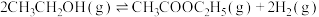

 。
。(2)乙醇是一种储氢材料。
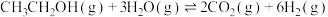
 ,Akande对其动力学机理的研究(*代表物种吸附在催化剂表面上)如图所示:
,Akande对其动力学机理的研究(*代表物种吸附在催化剂表面上)如图所示:
①

②速控反应的方程式为
(3)一定温度下,向恒容密闭容器中充入适量乙醇蒸气,发生反应:
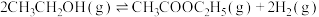 ,下列叙述正确的是___________(填标号)。
,下列叙述正确的是___________(填标号)。| A.当气体总压强不变时,达到平衡状态 |
| B.平衡时升温,正反应速率大于逆反应速率 |
| C.平衡时,充入氩气,平衡向左移动 |
D.平衡时,充入少量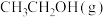 ,其平衡转化率减小 ,其平衡转化率减小 |
(4)保持总压为
 ,向反应器中充入乙醇
,向反应器中充入乙醇 和氮气(不参与反应),发生反应:
和氮气(不参与反应),发生反应: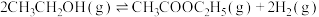 ,测得乙醇的平衡转化率与投料比
,测得乙醇的平衡转化率与投料比 、温度
、温度 的关系如图所示:
的关系如图所示:
①其他条件不变时,随着
 增大,乙醇的平衡转化率增大的原因是
增大,乙醇的平衡转化率增大的原因是
 (填“>”或“<”)。
(填“>”或“<”)。②
 温度下,投料比为1.0时,平衡常数
温度下,投料比为1.0时,平衡常数 为
为 (提示:用分压计算的平衡常数为
(提示:用分压计算的平衡常数为 ,分压
,分压 总压
总压 物质的显分数)。
物质的显分数)。(5)我国科学家开发复合催化剂,实现了在酸性条件下电还原
 制备乙醇,阴极反应式为
制备乙醇,阴极反应式为
您最近一年使用:0次
名校
解题方法
8 . 硫酸有着广泛的用途。硫酸工业在国民经济中占有重要地位。
(1)实验室可用铜与浓硫酸反应制备少量 :
: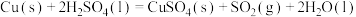
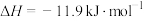 。判断该反应的自发性并说明理由
。判断该反应的自发性并说明理由___________ 。
(2)我国古籍记载了硫酸的制备方法—“炼石胆( )取精华法”。
)取精华法”。
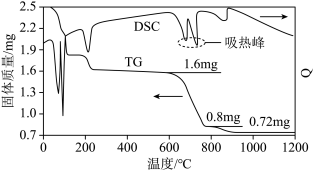
①借助现代仪器分析,该制备过程中 分解的TG曲线(热重曲线,即受热分解过程中固体质量变化曲线)及DSC曲线(反映体系热量变化情况,数值已省略)如图所示。700℃左右有两个吸热峰,则此时分解生成的氧化物有
分解的TG曲线(热重曲线,即受热分解过程中固体质量变化曲线)及DSC曲线(反映体系热量变化情况,数值已省略)如图所示。700℃左右有两个吸热峰,则此时分解生成的氧化物有___________ 、___________ (填化学式)和 。
。
②已知下列热化学方程式:
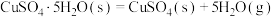



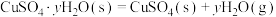

则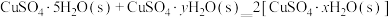 的△H=
的△H=__________  。
。
(3)接触法制硫酸的关键反应为 的催化氧化:
的催化氧化: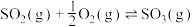
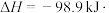

①为寻求固定投料比下不同反应阶段的最佳生产温度,绘制不同转化率( )下反应速率(数值已略去)与温度的关系如图,下列说法正确的是
)下反应速率(数值已略去)与温度的关系如图,下列说法正确的是__________ 。
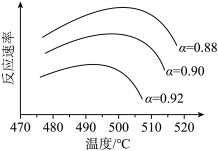
A.温度越高,反应速率越大 B.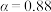 的曲线代表平衡转化率
的曲线代表平衡转化率
C. 越大,反应速率最大值对应温度越低 D.可根据不同
越大,反应速率最大值对应温度越低 D.可根据不同 下的最大速率,选择最佳生产温度
下的最大速率,选择最佳生产温度
②固定投料比,在压强分别为0.5MPa、2.5MPa和5.0MPa下,得到 的平衡转化率随温度的变化如图所示。则在5.0MPa、550℃时,该反应的平衡转化率=
的平衡转化率随温度的变化如图所示。则在5.0MPa、550℃时,该反应的平衡转化率=__________ 。
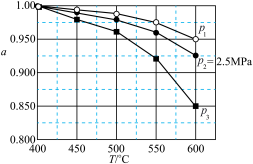
③对于气体参与的反应,可用气体组分(B)的平衡压强p(B)代替该气体物质的量浓度c(B)来表示平衡常数 。设
。设 的平衡分压为p,
的平衡分压为p, 的平衡转化率为
的平衡转化率为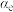 ,则上述催化氧化反应
,则上述催化氧化反应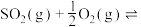
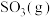 的
的
_____________ (用含p和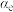 的代数式表示)。
的代数式表示)。
(1)实验室可用铜与浓硫酸反应制备少量
 :
: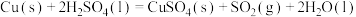
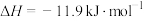 。判断该反应的自发性并说明理由
。判断该反应的自发性并说明理由(2)我国古籍记载了硫酸的制备方法—“炼石胆(
 )取精华法”。
)取精华法”。①借助现代仪器分析,该制备过程中
 分解的TG曲线(热重曲线,即受热分解过程中固体质量变化曲线)及DSC曲线(反映体系热量变化情况,数值已省略)如图所示。700℃左右有两个吸热峰,则此时分解生成的氧化物有
分解的TG曲线(热重曲线,即受热分解过程中固体质量变化曲线)及DSC曲线(反映体系热量变化情况,数值已省略)如图所示。700℃左右有两个吸热峰,则此时分解生成的氧化物有 。
。
②已知下列热化学方程式:
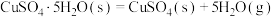



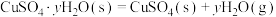

则
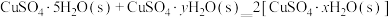 的△H=
的△H= 。
。(3)接触法制硫酸的关键反应为
 的催化氧化:
的催化氧化: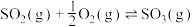
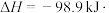

①为寻求固定投料比下不同反应阶段的最佳生产温度,绘制不同转化率(
 )下反应速率(数值已略去)与温度的关系如图,下列说法正确的是
)下反应速率(数值已略去)与温度的关系如图,下列说法正确的是
A.温度越高,反应速率越大 B.
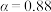 的曲线代表平衡转化率
的曲线代表平衡转化率C.
 越大,反应速率最大值对应温度越低 D.可根据不同
越大,反应速率最大值对应温度越低 D.可根据不同 下的最大速率,选择最佳生产温度
下的最大速率,选择最佳生产温度②固定投料比,在压强分别为0.5MPa、2.5MPa和5.0MPa下,得到
 的平衡转化率随温度的变化如图所示。则在5.0MPa、550℃时,该反应的平衡转化率=
的平衡转化率随温度的变化如图所示。则在5.0MPa、550℃时,该反应的平衡转化率=
③对于气体参与的反应,可用气体组分(B)的平衡压强p(B)代替该气体物质的量浓度c(B)来表示平衡常数
 。设
。设 的平衡分压为p,
的平衡分压为p, 的平衡转化率为
的平衡转化率为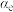 ,则上述催化氧化反应
,则上述催化氧化反应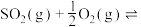
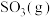 的
的
 的代数式表示)。
的代数式表示)。
您最近一年使用:0次
名校
解题方法
9 . Ⅰ.工业合成氨是人类科学技术的一项重大突破,目前已有三位科学家因其获得诺贝尔奖,反应为N2 (g)+3H2(g) 2NH3(g) △H =−92.4kJ·mol−1, △S=−200J·mol−1·K−1。请回答下列问题:
2NH3(g) △H =−92.4kJ·mol−1, △S=−200J·mol−1·K−1。请回答下列问题:
(1)常温下,合成氨反应________ (填“能”或“不能”)自发进行,其平衡常数表达式K=_______ 。
(2)______ 温(填“高”或“低”)有利于提高反应速率,______ 温(填“高”或“低”)有利于提高平衡转化率,综合考虑催化剂活性等因素,工业常采用400~500℃。
(3)针对反应速率与平衡产率的矛盾,我国科学家提出了解决方案:双温—双控—双催化剂。使用Fe-TiO2∙xHy双催化剂,通过光辐射产生温差(如体系温度为495℃时,Fe的温度为 547℃,而TiO2∙xHy的温度为415℃)。

该方案的优势:___________ 。
Ⅱ.合成氨工艺可以进一步优化,实现尿素的合成,简易流程图如下:
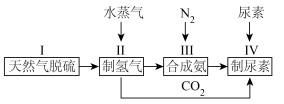
(4)步骤Ⅱ中制氢气原理如下:CH4(g)+H2O(g) CO(g)+3H2(g) ,CO(g)+H2O(g)
CO(g)+3H2(g) ,CO(g)+H2O(g) CO2(g)+H2(g),恒容容器中,对于以上反应,能加快反应速率的是___________。
CO2(g)+H2(g),恒容容器中,对于以上反应,能加快反应速率的是___________。
(5)已知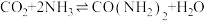 ,若合成尿素的流程中转化率为 80%时,100吨甲烷为原料能够合成
,若合成尿素的流程中转化率为 80%时,100吨甲烷为原料能够合成___________ 吨尿素。
Ⅲ.盐酸肼(N2H6Cl2)是一种重要的化工原料,属于离子化合物,易溶于水,溶液呈酸性,水解原理与 NH4Cl类似。
(6)写出盐酸肼第一步水解反应的离子方程式___________ 。
(7)盐酸肼水溶液中离子浓度的排列顺序正确的是___________。
 2NH3(g) △H =−92.4kJ·mol−1, △S=−200J·mol−1·K−1。请回答下列问题:
2NH3(g) △H =−92.4kJ·mol−1, △S=−200J·mol−1·K−1。请回答下列问题:(1)常温下,合成氨反应
(2)
(3)针对反应速率与平衡产率的矛盾,我国科学家提出了解决方案:双温—双控—双催化剂。使用Fe-TiO2∙xHy双催化剂,通过光辐射产生温差(如体系温度为495℃时,Fe的温度为 547℃,而TiO2∙xHy的温度为415℃)。

该方案的优势:
Ⅱ.合成氨工艺可以进一步优化,实现尿素的合成,简易流程图如下:

(4)步骤Ⅱ中制氢气原理如下:CH4(g)+H2O(g)
 CO(g)+3H2(g) ,CO(g)+H2O(g)
CO(g)+3H2(g) ,CO(g)+H2O(g) CO2(g)+H2(g),恒容容器中,对于以上反应,能加快反应速率的是___________。
CO2(g)+H2(g),恒容容器中,对于以上反应,能加快反应速率的是___________。| A.升高温度 | B.充入 He | C.加入催化剂 | D.降低压强 |
(5)已知
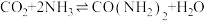 ,若合成尿素的流程中转化率为 80%时,100吨甲烷为原料能够合成
,若合成尿素的流程中转化率为 80%时,100吨甲烷为原料能够合成Ⅲ.盐酸肼(N2H6Cl2)是一种重要的化工原料,属于离子化合物,易溶于水,溶液呈酸性,水解原理与 NH4Cl类似。
(6)写出盐酸肼第一步水解反应的离子方程式
(7)盐酸肼水溶液中离子浓度的排列顺序正确的是___________。
A.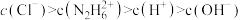 |
B.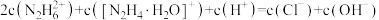 |
C.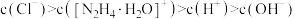 |
D.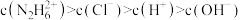 |
您最近一年使用:0次
名校
解题方法
10 . 二甲醚( )被称为“21世纪的清洁燃料”。以
)被称为“21世纪的清洁燃料”。以 、
、 为原料制备二甲醚涉及的主要反应如下:
为原料制备二甲醚涉及的主要反应如下:
Ⅰ.
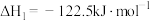
Ⅱ.

回答下列问题:
(1)反应Ⅰ自发进行的条件是_____ (填“高温”或“低温”)。
(2)已知 、
、 下,
下, 、
、 的燃烧热分别为:
的燃烧热分别为: 、
、 ,
,
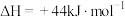 ,则
,则
_____  。
。
(3)保持压强为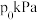 ,按
,按 投料,发生反应Ⅰ、Ⅱ,实验测得
投料,发生反应Ⅰ、Ⅱ,实验测得 平衡转化率和平衡时
平衡转化率和平衡时 的选择性随温度的变化如图所示。
的选择性随温度的变化如图所示。
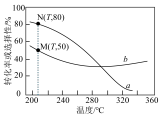
已知: 的选择性
的选择性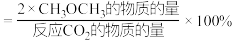
① 时向平衡体系中充入一定量的Ar,M点位置
时向平衡体系中充入一定量的Ar,M点位置_____ (填“上移”“下移”或“不变”),原因是_____ 。
② 时,反应Ⅰ、Ⅱ经4min达到平衡;反应Ⅱ的
时,反应Ⅰ、Ⅱ经4min达到平衡;反应Ⅱ的
_____ 。则该时间段 的平均速率为
的平均速率为_____  (保留小数点后两位)。
(保留小数点后两位)。
③表示平衡时 的选择性的是曲线
的选择性的是曲线_____ (填“a”或“b”);温度低于 时,曲线b随温度升高而降低的原因是
时,曲线b随温度升高而降低的原因是_____ ;
 )被称为“21世纪的清洁燃料”。以
)被称为“21世纪的清洁燃料”。以 、
、 为原料制备二甲醚涉及的主要反应如下:
为原料制备二甲醚涉及的主要反应如下:Ⅰ.

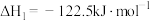
Ⅱ.


回答下列问题:
(1)反应Ⅰ自发进行的条件是
(2)已知
 、
、 下,
下, 、
、 的燃烧热分别为:
的燃烧热分别为: 、
、 ,
,
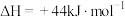 ,则
,则
 。
。(3)保持压强为
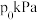 ,按
,按 投料,发生反应Ⅰ、Ⅱ,实验测得
投料,发生反应Ⅰ、Ⅱ,实验测得 平衡转化率和平衡时
平衡转化率和平衡时 的选择性随温度的变化如图所示。
的选择性随温度的变化如图所示。已知:
 的选择性
的选择性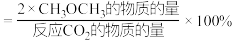
①
 时向平衡体系中充入一定量的Ar,M点位置
时向平衡体系中充入一定量的Ar,M点位置
②
 时,反应Ⅰ、Ⅱ经4min达到平衡;反应Ⅱ的
时,反应Ⅰ、Ⅱ经4min达到平衡;反应Ⅱ的
 的平均速率为
的平均速率为 (保留小数点后两位)。
(保留小数点后两位)。③表示平衡时
 的选择性的是曲线
的选择性的是曲线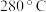 时,曲线b随温度升高而降低的原因是
时,曲线b随温度升高而降低的原因是
您最近一年使用:0次



