名校
1 . 硫酸镍一般用于电镀印染媒染剂、金属着色剂等。电镀污泥中主要含有 、
、 、
、 、
、 、
、 和
和 等化合物。一种从电镀污泥中回收金属铜和制备硫酸镍的工艺流程如图1,回答下列问题:
等化合物。一种从电镀污泥中回收金属铜和制备硫酸镍的工艺流程如图1,回答下列问题:

已知:①焙烧时 和
和 ,分别转化为
,分别转化为 、
、 。
。
②几种金属离子开始沉淀和沉淀完全的 如表:
如表:
(1)镍具有优良的物理和化学特性。羰基法提纯粗镍涉及反应:
 。已知
。已知 (忽略
(忽略 、
、 随温度的变化),当
随温度的变化),当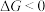 时,反应可以自发进行。若要提高反应中
时,反应可以自发进行。若要提高反应中 的产率且使反应自发进行,采取的反应条件为_______。
的产率且使反应自发进行,采取的反应条件为_______。
(2)“焙烧”时, 参与反应的化学方程式为
参与反应的化学方程式为_______ 。
(3)“滤液”的主要成分是含有少量重金属阳离子的 溶液,除杂装置如图2所示,
溶液,除杂装置如图2所示,
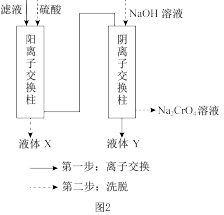
离子交换柱原理为: ;
;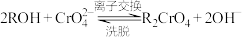
液体X的溶质主要是_______ (填化学式),液体Y是_______ (填名称)。
(4)“沉铁”时_______ (填“能”或“不能”)一并除去含铝杂质,理由是_______ 。
(5)下列金属的冶炼原理与本工艺流程中制Cu的方法相似的是_______(填标号)。
 、
、 、
、 、
、 、
、 和
和 等化合物。一种从电镀污泥中回收金属铜和制备硫酸镍的工艺流程如图1,回答下列问题:
等化合物。一种从电镀污泥中回收金属铜和制备硫酸镍的工艺流程如图1,回答下列问题:
已知:①焙烧时
 和
和 ,分别转化为
,分别转化为 、
、 。
。②几种金属离子开始沉淀和沉淀完全的
 如表:
如表:| 金属离子 |  |  |  |  |
开始沉淀的 | 1.1 | 4.1 | 6.7 | 4.2 |
完全沉淀的 | 3.2 | 5.4 | 9.5 | 6.7 |

 。已知
。已知 (忽略
(忽略 、
、 随温度的变化),当
随温度的变化),当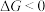 时,反应可以自发进行。若要提高反应中
时,反应可以自发进行。若要提高反应中 的产率且使反应自发进行,采取的反应条件为_______。
的产率且使反应自发进行,采取的反应条件为_______。| A.高温高压 | B.低温高压 | C.低温低压 | D.高温低压 |
 参与反应的化学方程式为
参与反应的化学方程式为(3)“滤液”的主要成分是含有少量重金属阳离子的
 溶液,除杂装置如图2所示,
溶液,除杂装置如图2所示,
离子交换柱原理为:
 ;
;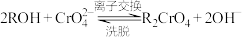
液体X的溶质主要是
(4)“沉铁”时
(5)下列金属的冶炼原理与本工艺流程中制Cu的方法相似的是_______(填标号)。
| A.加热氧化银制银 | B.四氯化钛中加镁冶炼钛 |
| C.焙烧辰砂(HgS)制汞 | D.电解硫酸锰制锰 |
您最近一年使用:0次
2022-12-12更新
|
123次组卷
|
2卷引用:湖南省岳阳教研联盟2022-2023学年高二上学期期中联考化学试题
名校
解题方法
2 . 甲醇既是绿色能源,也是重要的化工产品。
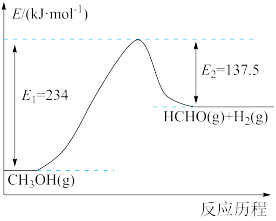
Ⅰ.我国科学家开发新型催化剂高选择性实现 脱氢制甲醛。
脱氢制甲醛。
(1)根据下图,写出反应的热化学方程式:_______ ,该反应在_______ (填“较高温度”或“较低温度”)下能自发进行。
(2)在密闭容器中充入 蒸气,发生上述反应生成甲醛,下列叙述正确的是_______(填序号)。
蒸气,发生上述反应生成甲醛,下列叙述正确的是_______(填序号)。
Ⅱ.工业上用合成气(CO和 )合成甲醇:
)合成甲醇:
 。在体积可变的密闭容器中充入1molCO和
。在体积可变的密闭容器中充入1molCO和 发生上述反应,测得平衡时
发生上述反应,测得平衡时 的体积分数与温度、压强的关系如图所示。
的体积分数与温度、压强的关系如图所示。

(3)温度 、
、 、
、 由大到小的顺序为
由大到小的顺序为_______ ,判断依据是_______ 。
(4) 温度下,经过10min反应到达M点,则0~10min内
温度下,经过10min反应到达M点,则0~10min内 的平均反应速率为
的平均反应速率为_______  ;若M点时体积为1L,保持体积不变,再向体系中充入1molCO、
;若M点时体积为1L,保持体积不变,再向体系中充入1molCO、 ,平衡
,平衡_______ (填“向正反应方向”“向逆反应方向”或“不”)移动。
Ⅰ.我国科学家开发新型催化剂高选择性实现
 脱氢制甲醛。
脱氢制甲醛。(1)根据下图,写出反应的热化学方程式:

(2)在密闭容器中充入
 蒸气,发生上述反应生成甲醛,下列叙述正确的是_______(填序号)。
蒸气,发生上述反应生成甲醛,下列叙述正确的是_______(填序号)。| A.达到平衡后HCHO的体积分数小于50% |
| B.升高温度,活化分子百分率增大 |
C.增大 浓度,活化分子百分率增大 浓度,活化分子百分率增大 |
D.平衡后增大压强,反应速率和 的平衡转化率都增大 的平衡转化率都增大 |
Ⅱ.工业上用合成气(CO和
 )合成甲醇:
)合成甲醇:
 。在体积可变的密闭容器中充入1molCO和
。在体积可变的密闭容器中充入1molCO和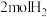 发生上述反应,测得平衡时
发生上述反应,测得平衡时 的体积分数与温度、压强的关系如图所示。
的体积分数与温度、压强的关系如图所示。
(3)温度
 、
、 、
、 由大到小的顺序为
由大到小的顺序为(4)
 温度下,经过10min反应到达M点,则0~10min内
温度下,经过10min反应到达M点,则0~10min内 的平均反应速率为
的平均反应速率为 ;若M点时体积为1L,保持体积不变,再向体系中充入1molCO、
;若M点时体积为1L,保持体积不变,再向体系中充入1molCO、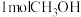 ,平衡
,平衡
您最近一年使用:0次
2022-11-11更新
|
107次组卷
|
2卷引用:河南省安阳市2022-2023学年高二上学期期中考试化学试题
22-23高二上·浙江·期末
解题方法
3 . 工业合成氨是人类科技的一项重大突破,其反应为:3H2(g)+N2(g)  2NH3(g) ΔH= -92.4 kJ/mol。
2NH3(g) ΔH= -92.4 kJ/mol。
(1)判断该反应的自发性并说明理由_______ 。
(2)在一定温度下,NH3溶于水的过程及其平衡常数为:
NH3(g) NH3(aq) K1=
NH3(aq) K1=
NH3(aq)+H2O(l) NH3·H2O(aq) K2
NH3·H2O(aq) K2
NH3·H2O (aq)
 (aq)+OH-(aq) K3
(aq)+OH-(aq) K3
忽略H2O的电离,NH3 在水中的溶解度(以物质的量浓度表示)为c,用平衡压强p和上述平衡常数表示,则c=_______ 。
(3)工业合成氨流程示意图如图1:
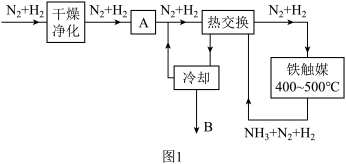
①工业上通常在400~500℃下进行合成氨反应,用碰撞理论解释为什么不在常温下进行反应_______ 。
②干燥净化的目的是_______ ,装置 A的作用为_______ ,B处的物质主要是_______ (写出物质并注明状态)。
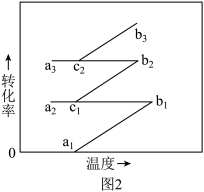
③工业上N2和H2混合气反应后经过图1中的过程再及时补充N2和H2进入合成塔反应,以一定量的N2和H2为研究对象,计算转化率时不考虑新补充进入的N2和H2,循环过程中转化率随温度变化曲线如图2所示,图2所示进程中表示热交换过程的是_______ 。
A. a1→b1 B. b1→c1 C. c1→a2 D. a2→c1 E. c1→b2 F. b2→c2 G. c2→a3 H.a3→c2
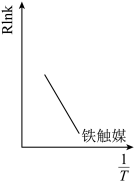
(4)已知Arrhenius经验公式为Rlnk=- +C(Ea为活化能,k为速率常数,R和C为常数),假设使用现有合成氨催化剂铁触媒时的图象如图所示,2016 年我国科学家研制出一种新型催化剂,合成氨条件降为350℃、1MPa,在图中画出在使用该高效催化剂下Rlnk与
+C(Ea为活化能,k为速率常数,R和C为常数),假设使用现有合成氨催化剂铁触媒时的图象如图所示,2016 年我国科学家研制出一种新型催化剂,合成氨条件降为350℃、1MPa,在图中画出在使用该高效催化剂下Rlnk与 的关系图。
的关系图。______
 2NH3(g) ΔH= -92.4 kJ/mol。
2NH3(g) ΔH= -92.4 kJ/mol。(1)判断该反应的自发性并说明理由
(2)在一定温度下,NH3溶于水的过程及其平衡常数为:
NH3(g)
 NH3(aq) K1=
NH3(aq) K1=
NH3(aq)+H2O(l)
 NH3·H2O(aq) K2
NH3·H2O(aq) K2NH3·H2O (aq)

 (aq)+OH-(aq) K3
(aq)+OH-(aq) K3忽略H2O的电离,NH3 在水中的溶解度(以物质的量浓度表示)为c,用平衡压强p和上述平衡常数表示,则c=
(3)工业合成氨流程示意图如图1:

①工业上通常在400~500℃下进行合成氨反应,用碰撞理论解释为什么不在常温下进行反应
②干燥净化的目的是
③工业上N2和H2混合气反应后经过图1中的过程再及时补充N2和H2进入合成塔反应,以一定量的N2和H2为研究对象,计算转化率时不考虑新补充进入的N2和H2,循环过程中转化率随温度变化曲线如图2所示,图2所示进程中表示热交换过程的是

A. a1→b1 B. b1→c1 C. c1→a2 D. a2→c1 E. c1→b2 F. b2→c2 G. c2→a3 H.a3→c2
(4)已知Arrhenius经验公式为Rlnk=-
 +C(Ea为活化能,k为速率常数,R和C为常数),假设使用现有合成氨催化剂铁触媒时的图象如图所示,2016 年我国科学家研制出一种新型催化剂,合成氨条件降为350℃、1MPa,在图中画出在使用该高效催化剂下Rlnk与
+C(Ea为活化能,k为速率常数,R和C为常数),假设使用现有合成氨催化剂铁触媒时的图象如图所示,2016 年我国科学家研制出一种新型催化剂,合成氨条件降为350℃、1MPa,在图中画出在使用该高效催化剂下Rlnk与 的关系图。
的关系图。
您最近一年使用:0次
4 . 氯气是重要的化工原料,随着氯气用量的日益增大,将涉氯行业产生的氯化氢转化为氯气具有重要的现实意义。工业上常采用的转化原理为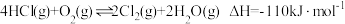 。
。
回答下列问题:
(1)研究表明,在CuO作催化剂时, 氧化HCl的反应分两步进行:
氧化HCl的反应分两步进行:
氯化反应: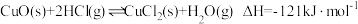 ;
;
氧化反应: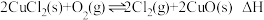 。
。
①氧化反应的
_______  ,该反应中正反应活化能
,该反应中正反应活化能_______ 逆反应活化能(填“>”或“<”)。
②氯化反应在低温条件下进行的趋势很大,原因为_______ 。
(2)在某刚性密闭容器中发生反应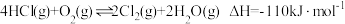 。测得初始投料比
。测得初始投料比 分别为1∶1、4∶1、6∶1、8∶1时,温度对HCl平衡转化率的影响如图甲所示:
分别为1∶1、4∶1、6∶1、8∶1时,温度对HCl平衡转化率的影响如图甲所示:

①代表初始投料比 分别为1∶1和6∶1时的曲线分别为
分别为1∶1和6∶1时的曲线分别为_______ 、_______ 。
②初始投料比 为4∶1时,升高温度导致HCl的平衡转化率降低的原因为
为4∶1时,升高温度导致HCl的平衡转化率降低的原因为_______ ;在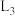 所对应的初始投料比条件下,P点对应的HCl的正逆反应速率
所对应的初始投料比条件下,P点对应的HCl的正逆反应速率
_______ (填“>”“<”或“=”) 。
。
(3)我国科学家设计的一种将HCl转化为 的装置如图乙所示,该制备
的装置如图乙所示,该制备 的方法具有占地面积小、原料利用率高等优点。
的方法具有占地面积小、原料利用率高等优点。

①该装置工作时,发生的能量变化除化学能→热能外,还有_______ 。
②通入HCl(g)的电极为原电池的_______ 极,该电极的电极反应式为_______ 。
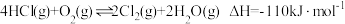 。
。回答下列问题:
(1)研究表明,在CuO作催化剂时,
 氧化HCl的反应分两步进行:
氧化HCl的反应分两步进行:氯化反应:
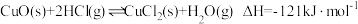 ;
;氧化反应:
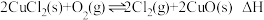 。
。①氧化反应的

 ,该反应中正反应活化能
,该反应中正反应活化能②氯化反应在低温条件下进行的趋势很大,原因为
(2)在某刚性密闭容器中发生反应
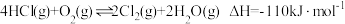 。测得初始投料比
。测得初始投料比 分别为1∶1、4∶1、6∶1、8∶1时,温度对HCl平衡转化率的影响如图甲所示:
分别为1∶1、4∶1、6∶1、8∶1时,温度对HCl平衡转化率的影响如图甲所示:
①代表初始投料比
 分别为1∶1和6∶1时的曲线分别为
分别为1∶1和6∶1时的曲线分别为②初始投料比
 为4∶1时,升高温度导致HCl的平衡转化率降低的原因为
为4∶1时,升高温度导致HCl的平衡转化率降低的原因为 所对应的初始投料比条件下,P点对应的HCl的正逆反应速率
所对应的初始投料比条件下,P点对应的HCl的正逆反应速率
 。
。(3)我国科学家设计的一种将HCl转化为
 的装置如图乙所示,该制备
的装置如图乙所示,该制备 的方法具有占地面积小、原料利用率高等优点。
的方法具有占地面积小、原料利用率高等优点。
①该装置工作时,发生的能量变化除化学能→热能外,还有
②通入HCl(g)的电极为原电池的
您最近一年使用:0次
2022-09-29更新
|
210次组卷
|
2卷引用:河南名校2022-2023学年高二上学期(9月)联考化学试题
名校
5 . 已知凡气体分子总数增多的反应一定是熵增大的反应。一定条件下,下列反应不能自发进行的是
| A.3O2(g)=2O3(g) △H>0 | B.2C(s)+O2(g)=2CO(g) △H<0 |
C.N2(g)+3H2(g) 2NH3(g) △H<0 2NH3(g) △H<0 | D.CaCO3(s)=CaO(s)+CO2(g) △H>0 |
您最近一年使用:0次
2022-09-27更新
|
403次组卷
|
4卷引用:河南省开封五县联考 2022-2023学年高二上学期9月月考化学试题
解题方法
6 . 某市对大气进行监测,发现该市首要污染物为可吸入颗粒物PM2.5(直径小于等于2.5 um的悬浮颗粒物)其主要来源为燃煤、机动车尾气等。因此,对PM2.5、SO2、CO、NOx等进行研究具有重要意义。请回答下列问题:
(1)关于PM2.5的研究:
常温下用蒸馏水处理PM2.5样本制成待测试样。若测得该试样所含水溶性无机离子的化学组分及其平均浓度如下表:
根据表中数据判断PM2.5试样显___________ (填“酸性”、“碱性”或“中性”),其pH=___________ 。
(2)关于SO2的研究:
①为减少SO2的排放,常采取的措施之一是将煤转化为清洁气体燃料。
已知:H2(g)+ O2(g)=H2O(g) △H=—241.8kJ/mol
O2(g)=H2O(g) △H=—241.8kJ/mol
C(s)+ O2(g)=CO(g) △H=—110.5kJ/mol
O2(g)=CO(g) △H=—110.5kJ/mol
写出焦炭与水蒸气反应的热化学方程式___________ ;
②SO2是工业制硫酸的重要中间产物。通过下列反应:2SO2(g)+O2(g) 2SO3(g) ΔH=—198 kJ·mol-1(催化剂在400~500℃时效果最好)。
2SO3(g) ΔH=—198 kJ·mol-1(催化剂在400~500℃时效果最好)。
结合信息与下表数据,根据化学理论与生产实际综合分析,为了使二氧化硫尽可能转化为三氧化硫,应选择的生产条件是___________ 。在生产中,还可以通入过量空气,其目的是___________ 。某温度下不同压强下SO2的转化率(%):
③某人设想以如图所示装置用电化学原理将二氧化硫转化为硫酸:
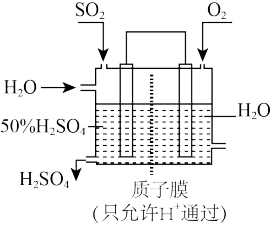
写出通入SO2的电极的电极反应式______ 。
(3)关于NOx和CO的研究:
①已知气缸中生成NO的反应为:N2(g)+O2(g) 2NO(g),若1 mol空气含有0.8 mol N2和0.2 mol O2,1300 ℃时在密闭容器内反应达到平衡。测得NO为8×10 - 4 mol。计算该温度下的平衡常数K=
2NO(g),若1 mol空气含有0.8 mol N2和0.2 mol O2,1300 ℃时在密闭容器内反应达到平衡。测得NO为8×10 - 4 mol。计算该温度下的平衡常数K= ___________ (计算过程中可进行合理近似处理 ),汽车启动后,气缸温度越高,单位时间内NO排放量越大,原因是_______
②汽车燃油不完全燃烧时产生CO,有人设想按下列反应除去CO:2CO(g)=2C(s)+O2(g)。已知该反应的△H>0,该设想能否实现?___________ (填“能”或“否”)。
(1)关于PM2.5的研究:
常温下用蒸馏水处理PM2.5样本制成待测试样。若测得该试样所含水溶性无机离子的化学组分及其平均浓度如下表:
| 离子 | K+ | Na+ | NH | SO | NO | Cl— |
| 浓度(mol/L) | 4×10-6 | 6×10-6 | 2×10-5 | 4×10-5 | 3×10-5 | 2×10-5 |
(2)关于SO2的研究:
①为减少SO2的排放,常采取的措施之一是将煤转化为清洁气体燃料。
已知:H2(g)+
 O2(g)=H2O(g) △H=—241.8kJ/mol
O2(g)=H2O(g) △H=—241.8kJ/molC(s)+
 O2(g)=CO(g) △H=—110.5kJ/mol
O2(g)=CO(g) △H=—110.5kJ/mol写出焦炭与水蒸气反应的热化学方程式
②SO2是工业制硫酸的重要中间产物。通过下列反应:2SO2(g)+O2(g)
 2SO3(g) ΔH=—198 kJ·mol-1(催化剂在400~500℃时效果最好)。
2SO3(g) ΔH=—198 kJ·mol-1(催化剂在400~500℃时效果最好)。结合信息与下表数据,根据化学理论与生产实际综合分析,为了使二氧化硫尽可能转化为三氧化硫,应选择的生产条件是
| 1×105Pa | 1×106Pa | 5×106Pa | 1×107Pa | |
| 转化率 | 97.5% | 99.2% | 99.6% | 99.7% |

写出通入SO2的电极的电极反应式
(3)关于NOx和CO的研究:
①已知气缸中生成NO的反应为:N2(g)+O2(g)
 2NO(g),若1 mol空气含有0.8 mol N2和0.2 mol O2,1300 ℃时在密闭容器内反应达到平衡。测得NO为8×10 - 4 mol。计算该温度下的平衡常数K=
2NO(g),若1 mol空气含有0.8 mol N2和0.2 mol O2,1300 ℃时在密闭容器内反应达到平衡。测得NO为8×10 - 4 mol。计算该温度下的平衡常数K= ②汽车燃油不完全燃烧时产生CO,有人设想按下列反应除去CO:2CO(g)=2C(s)+O2(g)。已知该反应的△H>0,该设想能否实现?
您最近一年使用:0次
名校
解题方法
7 . 一定条件下HCOOH在Pd催化剂表面脱氢的反应机理、反应历程与能量的关系如图所示:
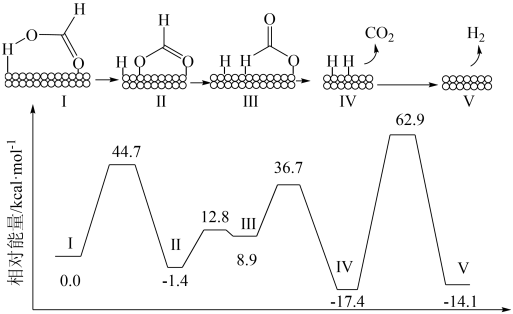
下列说法错误的是

下列说法错误的是
| A.HCOOH催化脱氢反应在该温度下能自发进行 |
| B.在历程Ⅰ~Ⅴ中,由Ⅳ到Ⅴ的反应为决速步骤 |
| C.由反应历程可得出HCOOH中第2个H原子更易脱去 |
| D.在该反应历程中,HCOOH所有的化学键均发生断裂 |
您最近一年使用:0次
2022-04-16更新
|
1057次组卷
|
6卷引用:山东省青岛莱西市2022-2023学年高二上学期期中考试化学试题
山东省青岛莱西市2022-2023学年高二上学期期中考试化学试题山东省枣庄市2022届高三第二次模拟化学试题山东省枣庄市2022届高三下学期4月模拟考试化学试题(已下线)专项10 化学反应与能量-备战2022年高考化学阶段性新题精选专项特训(全国卷)(4月期)山东省潍坊市2022届高三下学期5月模拟考试(二)化学试题湖南省长沙市望城区第一中学2022届高三下学期期中考试化学试题
名校
解题方法
8 . NO是大气污染物之一,NO的转化技术对大气污染防治意义深远。回答下列问题:
(1)炽热的活性炭可以处理NO,发生的反应为C(s)+2NO(g) CO2(g)+N2(g)ΔH。
CO2(g)+N2(g)ΔH。
①已知:C(s)+O2(g)=CO2(g) ΔH1=—393.5kJ·mol-1,N2(g)+O2(g)=2NO(g) ΔH2=+180.5kJ·mol-1,则ΔH=_______ kJ·mol-1。
②一定温度下,将一定量的活性炭和NO加入一恒容密闭容器中发生上述反应,0~2min内,气体密度增大1.2g·L-1,则v(N2)=_______ 。下列能表示该反应达到平衡状态的是_______ (填字母)。
A.容器内混合气体的密度保持不变 B.容器内混合气体的平均相对分子质量保持不变
C.NO和N2的消耗速率之比为1:2 D.容器内压强不再改变
(2)利用高效催化剂处理汽车尾气中的NO的反应为2NO(g)+2CO(g) N2(g)+2CO2(g)。
N2(g)+2CO2(g)。
①该反应在低温下能自发进行,则该反应的ΔH_______ 0(填“>”“<”或“= ”),提高NO平衡转化率的措施有_______ (写出一条即可)。
②一定温度下,在体积为1L的恒容密闭容器中加入1molCO和1molNO发生上述反应,部分物质的体积分数φ随时间t变化如图所示。
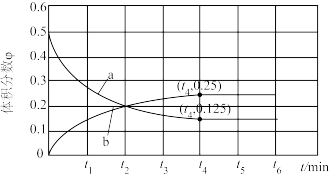
曲线b表示物质的φ~t关系,正反应速率v(t3)_______ v(t4)(填“>”“<”或“= ”),若起始压强为po,则该反应温度下Kp=_______ (分压= 物质的量分数×总压,用含po的式子表示)。
(1)炽热的活性炭可以处理NO,发生的反应为C(s)+2NO(g)
 CO2(g)+N2(g)ΔH。
CO2(g)+N2(g)ΔH。①已知:C(s)+O2(g)=CO2(g) ΔH1=—393.5kJ·mol-1,N2(g)+O2(g)=2NO(g) ΔH2=+180.5kJ·mol-1,则ΔH=
②一定温度下,将一定量的活性炭和NO加入一恒容密闭容器中发生上述反应,0~2min内,气体密度增大1.2g·L-1,则v(N2)=
A.容器内混合气体的密度保持不变 B.容器内混合气体的平均相对分子质量保持不变
C.NO和N2的消耗速率之比为1:2 D.容器内压强不再改变
(2)利用高效催化剂处理汽车尾气中的NO的反应为2NO(g)+2CO(g)
 N2(g)+2CO2(g)。
N2(g)+2CO2(g)。①该反应在低温下能自发进行,则该反应的ΔH
②一定温度下,在体积为1L的恒容密闭容器中加入1molCO和1molNO发生上述反应,部分物质的体积分数φ随时间t变化如图所示。

曲线b表示物质的φ~t关系,正反应速率v(t3)
您最近一年使用:0次
2022-03-30更新
|
961次组卷
|
8卷引用:云南省昆明市寻甸县2022-2023学年高二上学期期中考试化学试题
云南省昆明市寻甸县2022-2023学年高二上学期期中考试化学试题安徽省合肥一六八中学2022-2023学年高二上学期化学学科学情调研试题云南省昆明市2022届高三”三诊一模“3月复习教学质量检测理综化学试题(已下线)专题14化学反应原理综合-2022年高考真题+模拟题汇编(全国卷)(已下线)专题15化学反应原理综合-三年(2020~2022)高考真题汇编(全国卷)(已下线)专题15化学反应原理综合-五年(2018~2022)高考真题汇编(全国卷)海南省海口市海南中学,文昌中学,海口一中,嘉积中学2023届高三第一次模拟考试化学试题四川省射洪中学校2023-2024学年高三补习班上学期10月月考理综化学试题
名校
9 . 下列说法错误的是
| A.某吸热反应能自发进行,因此该反应是熵增反应 |
B. 水溶液中含有 水溶液中含有 ,因此 ,因此 溶液不能存放于玻璃试剂瓶中 溶液不能存放于玻璃试剂瓶中 |
C.反应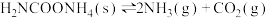 在恒温恒容密闭容器中进行,当混合气体的平均相对分子质量不变时,该反应达到化学平衡状态 在恒温恒容密闭容器中进行,当混合气体的平均相对分子质量不变时,该反应达到化学平衡状态 |
D.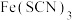 溶液中加入固体 溶液中加入固体 后颜色变深的原因可用勒夏特列原理来解释 后颜色变深的原因可用勒夏特列原理来解释 |
您最近一年使用:0次
2022-01-21更新
|
258次组卷
|
2卷引用:山东省聊城市2021-2022学年高二上学期期末考试化学试题
10 . 下列说法正确的是
| A.电解、电离、电镀、电化学腐蚀这些过程都需要通电后才能进行 |
B.298K时,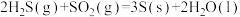 能自发进行,则其△H<0 能自发进行,则其△H<0 |
| C.镀锌铁板是利用了外加电流的阴极保护法来达到防止腐蚀的目的 |
| D.将纯水加热至较高温度,Kw变大、pH变小、呈酸性 |
您最近一年使用:0次



