1 . 化学是与生活联系十分紧密的一门学科,化学知识可以体现在生活各个方面,下面说法中正确的
| A.“煮豆燃豆萁”,这个过程中能量变化为化学能全部转化为热能 |
B.“白毛浮绿水”,“白毛”为烃的衍生物,不溶于水,密度比水小,燃烧生成 和 和 |
| C.“烈火焚烧若等闲”,说明反应物很稳定,没有发生化学变化 |
| D.“唯有暗香来”,是一个熵增的过程 |
您最近一年使用:0次
2024-02-24更新
|
66次组卷
|
2卷引用:湖北省新高考联考协作体2023-2024学年高二下学期2月收心考试化学试题
名校
解题方法
2 . Ⅰ.完成下列问题
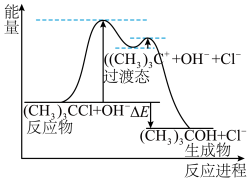
(1)叔丁基氯与碱溶液经两步反应得到叔丁基醇,反应(CH3)3CCl+OH-→(CH3)3COH+Cl-的能量与反应进程如图所示。下列说法正确的是______
(2)下列有关热化学方程式的叙述正确的是_______
(3)已知反应:2NO(g)+2CO(g)=N₂(g)+2CO₂(g),在298K、100kPa的条件下,其中ΔH=-113.0kJ·mol-1,ΔS=-145.3J·mol-1·K-1,该反应___________ (填“能”或“不能”)用于消除汽车尾气中的NO,理由为___________ 。实际上,如果不采取一定措施,汽车尾气并不会自动消除,原因是___________ ;
Ⅱ.CH4和CO2在催化剂作用下可以转化为合成气(主要含H2、CO和少量H2O的混合气体)。
主反应为:I.CH4(g)+CO2(g) 2CO(g)+2H2(g),ΔH1=+247kJ·mol-1
2CO(g)+2H2(g),ΔH1=+247kJ·mol-1
主要副反应有:Ⅱ.CO2(g)+H2(g) CO(g)+H2O(g),ΔH2=+41.2kJ·mol-1
CO(g)+H2O(g),ΔH2=+41.2kJ·mol-1
Ⅲ.CH4(g) C(s)+2H2(g),ΔH3=+74.8kJ·mol-1
C(s)+2H2(g),ΔH3=+74.8kJ·mol-1
Ⅳ.CO(g)+H2(g) C(s)+H2O(g),ΔH4=-131kJ·mol-1
C(s)+H2O(g),ΔH4=-131kJ·mol-1
完成下列填空:
(4)写出CH4和水蒸气反应生成CO和H2的热化学方程式___________ 。
(5)对于反应Ⅰ,有利于提高CH4平衡转化率的措施是___________ 、___________ (任写两条)。
(6)反应Ⅰ温度控制在550~750℃之间,从反应速率角度分析,选择该温度范围的可能原因:___________ 。
(7)某温度下,反应Ⅰ的平衡常数K=0.16,该温度下,测得容器中CH4、CO2、CO和H2的浓度分别为0.5mol/L、0.5mol/L、0.25mol/L、0.25mol/L,此时,反应Ⅰ是否处于平衡状态?若不是,预测反应的方向。___________ 。
(8)CH4和CO2各1mol充入密闭容器中,发生反应I。
①300℃,100kPa,反应达到平衡时CO2体积分数与温度的关系如图中曲线所示。则n(平衡时气体):n(初始气体)=___________ 。
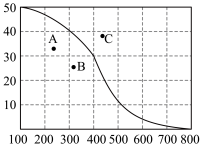
②若A、B、C三点表示不同温度和压强下已达平衡时CO2体积分数___________ 点对应的平衡常数最小,理由是:___________ ;___________ 点对应压强最大,理由是:___________ 。
(1)叔丁基氯与碱溶液经两步反应得到叔丁基醇,反应(CH3)3CCl+OH-→(CH3)3COH+Cl-的能量与反应进程如图所示。下列说法正确的是______

| A.该反应为吸热反应 |
| B.(CH3)3C+比(CH3)3CCl稳定 |
| C.第一步反应一定比第二步反应快 |
| D.增大碱的浓度和升高温度均可加快反应速率 |
(2)下列有关热化学方程式的叙述正确的是_______
A.已知C(石墨,s) C(金刚石,s)ΔH>0,则金刚石比石墨稳定 C(金刚石,s)ΔH>0,则金刚石比石墨稳定 |
| B.含20.0gNaOH的稀溶液与稀盐酸完全中和,放出28.7kJ的热量,则该反应的热化学方程式为NaOH(aq)+HCl(aq)=NaCl(aq)+H2O(l);ΔH=-57.4kJ·mol-1 |
| C.等质量的硫蒸气和硫固体分别完全燃烧,后者放出的热量多 |
D.N2(g)+3H2(g) 2NH3(g);ΔH=-akJ·mol-1,则将14gN2(g)和足量H2置于一密闭容器中,充分反应后放出0.5akJ的热量 2NH3(g);ΔH=-akJ·mol-1,则将14gN2(g)和足量H2置于一密闭容器中,充分反应后放出0.5akJ的热量 |
(3)已知反应:2NO(g)+2CO(g)=N₂(g)+2CO₂(g),在298K、100kPa的条件下,其中ΔH=-113.0kJ·mol-1,ΔS=-145.3J·mol-1·K-1,该反应
Ⅱ.CH4和CO2在催化剂作用下可以转化为合成气(主要含H2、CO和少量H2O的混合气体)。
主反应为:I.CH4(g)+CO2(g)
 2CO(g)+2H2(g),ΔH1=+247kJ·mol-1
2CO(g)+2H2(g),ΔH1=+247kJ·mol-1主要副反应有:Ⅱ.CO2(g)+H2(g)
 CO(g)+H2O(g),ΔH2=+41.2kJ·mol-1
CO(g)+H2O(g),ΔH2=+41.2kJ·mol-1Ⅲ.CH4(g)
 C(s)+2H2(g),ΔH3=+74.8kJ·mol-1
C(s)+2H2(g),ΔH3=+74.8kJ·mol-1Ⅳ.CO(g)+H2(g)
 C(s)+H2O(g),ΔH4=-131kJ·mol-1
C(s)+H2O(g),ΔH4=-131kJ·mol-1完成下列填空:
(4)写出CH4和水蒸气反应生成CO和H2的热化学方程式
(5)对于反应Ⅰ,有利于提高CH4平衡转化率的措施是
(6)反应Ⅰ温度控制在550~750℃之间,从反应速率角度分析,选择该温度范围的可能原因:
(7)某温度下,反应Ⅰ的平衡常数K=0.16,该温度下,测得容器中CH4、CO2、CO和H2的浓度分别为0.5mol/L、0.5mol/L、0.25mol/L、0.25mol/L,此时,反应Ⅰ是否处于平衡状态?若不是,预测反应的方向。
(8)CH4和CO2各1mol充入密闭容器中,发生反应I。
①300℃,100kPa,反应达到平衡时CO2体积分数与温度的关系如图中曲线所示。则n(平衡时气体):n(初始气体)=

②若A、B、C三点表示不同温度和压强下已达平衡时CO2体积分数
您最近一年使用:0次
名校
3 . 下列过程属于熵减的是
| A.-10℃的液态水自动结冰成为固态 | B.常温下,H2O2分解成H2O和O2 |
| C.NaCl晶体溶于水 | D.一盒粉笔无序散落一地 |
您最近一年使用:0次
4 . 下列说法正确的是
| A.冰在室温下自动熔化成水,是ΔS<0的过程 |
| B.霓虹灯发光与原子核外电子跃迁有关,属于化学变化 |
| C.任何化学反应的反应热均可以通过实验直接进行测定 |
| D.FeCl3溶液和Fe2(SO4)3溶液分别蒸干,所得固体的成分不同 |
您最近一年使用:0次
5 . 分别在催化剂a和b的催化下发生反应 ,反应历程如图所示。下列说法正确的是
,反应历程如图所示。下列说法正确的是
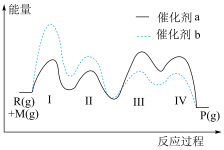
 ,反应历程如图所示。下列说法正确的是
,反应历程如图所示。下列说法正确的是
| A.在催化剂a或b的作用下,第Ⅱ步反应均为决速步骤 |
| B.反应达到平衡时,升高温度,P的平衡浓度增大 |
| C.低温条件有利于该反应自发进行 |
| D.其他条件相同时,与催化剂a相比,催化剂b能使反应更快达到平衡 |
您最近一年使用:0次
名校
解题方法
6 . 2023年9月23日晚,杭州亚运会采用了废碳再生的“绿色甲醇”作为燃料,点亮了主火炬。工业上利用二氧化碳加氢制甲醇的总反应可表示为:
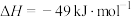 。
。
(1)在下图的坐标系中,画出能体现上述反应特点的大致图像:___________ 。
(2)在一体积为2L的密闭容器中投入1mol CO和3mol 模拟反应的过程。可以判断反应达到平衡状态的是___________。
模拟反应的过程。可以判断反应达到平衡状态的是___________。
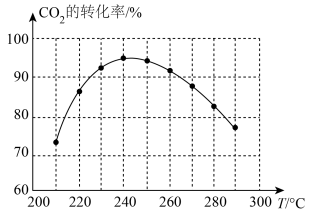
(3)为探究该反应合适的反应温度,某小组进行了一系列测试,保证每次初始的原料气组成及反应时间一致,测得 的转化率如图所示。试解释
的转化率如图所示。试解释 的转化率先增后降的原因
的转化率先增后降的原因___________ 。

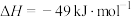 。
。(1)在下图的坐标系中,画出能体现上述反应特点的大致图像:

(2)在一体积为2L的密闭容器中投入1mol CO和3mol
 模拟反应的过程。可以判断反应达到平衡状态的是___________。
模拟反应的过程。可以判断反应达到平衡状态的是___________。A.断裂1.5 个H—H键的同时,有 个H—H键的同时,有 个O—H键生成 个O—H键生成 |
| B.容器内压强不再变化 |
C. 和 和 的体积分数之比保持不变 的体积分数之比保持不变 |
| D.混合气体的平均相对分子质量不再变化 |
(3)为探究该反应合适的反应温度,某小组进行了一系列测试,保证每次初始的原料气组成及反应时间一致,测得
 的转化率如图所示。试解释
的转化率如图所示。试解释 的转化率先增后降的原因
的转化率先增后降的原因
您最近一年使用:0次
解题方法
7 . “碳中和”目标如期实现的关键技术之一是 的再资源化利用。
的再资源化利用。
(1)氨的饱和食盐水捕获 是其利用的方法之一,反应原理为:
是其利用的方法之一,反应原理为: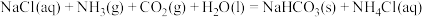 。该反应常温下能自发进行的原因是
。该反应常温下能自发进行的原因是___________ 。
(2)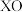 基掺杂
基掺杂 形成
形成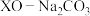 (
(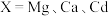 等),能用于捕获
等),能用于捕获 ,原理如下图所示。已知阳离子电荷数越高、半径越小,阴离子越易受其影响而分解。
,原理如下图所示。已知阳离子电荷数越高、半径越小,阴离子越易受其影响而分解。
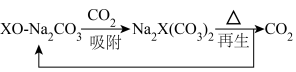
①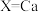 时,再生的化学方程式为
时,再生的化学方程式为___________ 。
②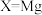 相比
相比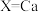 ,其优点有
,其优点有___________ 。
(3)催化电解吸收 的
的 溶液可将
溶液可将 转化为有机物。
转化为有机物。
① 在阴极放电生成
在阴极放电生成 的电极反应式为
的电极反应式为___________ 。
②碱性溶液有利于抑制阴极上副产物的产生,该副产物的化学式为___________ 。
(4)在催化剂作用下,以 和
和 为原料合成
为原料合成 ,主要反应为:
,主要反应为:
反应Ⅰ: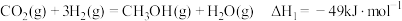
反应Ⅱ:
保持压强 ,将起始
,将起始 的混合气体匀速通过装有催化剂的反应管,测得出口处
的混合气体匀速通过装有催化剂的反应管,测得出口处 的转化率和甲醇的选择性
的转化率和甲醇的选择性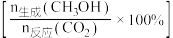 与温度的关系如题图1、题图2所示。
与温度的关系如题图1、题图2所示。
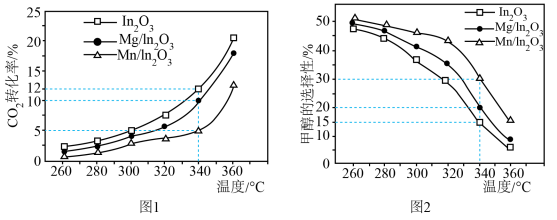
①随着温度的升高, 转化率增大、但甲醇选择性降低的原因是
转化率增大、但甲醇选择性降低的原因是___________ 。
②假设定义催化剂催化效率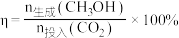 ,计算
,计算 时三种催化剂的催化效率之比
时三种催化剂的催化效率之比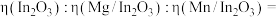
___________ (写出计算过程)。
 的再资源化利用。
的再资源化利用。(1)氨的饱和食盐水捕获
 是其利用的方法之一,反应原理为:
是其利用的方法之一,反应原理为: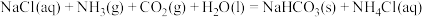 。该反应常温下能自发进行的原因是
。该反应常温下能自发进行的原因是(2)
 基掺杂
基掺杂 形成
形成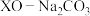 (
(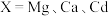 等),能用于捕获
等),能用于捕获 ,原理如下图所示。已知阳离子电荷数越高、半径越小,阴离子越易受其影响而分解。
,原理如下图所示。已知阳离子电荷数越高、半径越小,阴离子越易受其影响而分解。
①
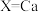 时,再生的化学方程式为
时,再生的化学方程式为②
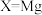 相比
相比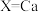 ,其优点有
,其优点有(3)催化电解吸收
 的
的 溶液可将
溶液可将 转化为有机物。
转化为有机物。①
 在阴极放电生成
在阴极放电生成 的电极反应式为
的电极反应式为②碱性溶液有利于抑制阴极上副产物的产生,该副产物的化学式为
(4)在催化剂作用下,以
 和
和 为原料合成
为原料合成 ,主要反应为:
,主要反应为:反应Ⅰ:
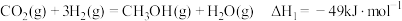
反应Ⅱ:

保持压强
 ,将起始
,将起始 的混合气体匀速通过装有催化剂的反应管,测得出口处
的混合气体匀速通过装有催化剂的反应管,测得出口处 的转化率和甲醇的选择性
的转化率和甲醇的选择性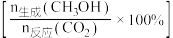 与温度的关系如题图1、题图2所示。
与温度的关系如题图1、题图2所示。
①随着温度的升高,
 转化率增大、但甲醇选择性降低的原因是
转化率增大、但甲醇选择性降低的原因是②假设定义催化剂催化效率
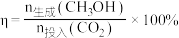 ,计算
,计算 时三种催化剂的催化效率之比
时三种催化剂的催化效率之比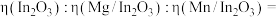
您最近一年使用:0次
2024-02-11更新
|
580次组卷
|
3卷引用:四川省宜宾市叙州区第二中学校2023-2024学年高二上学期1月期末化学试题
解题方法
8 . 利用甲烷制取氢气等气体是科学家研究的热点课题。
(1)一定条件下, 分解反应
分解反应 的部分反应历程如下图所示。
的部分反应历程如下图所示。
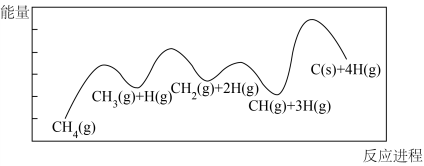
①该历程图表示___________ 步反应,其中正反应活化能最大步骤的反应方程式为___________ 。
② 分解反应
分解反应___________ 。
A.高温下能自发进行 B.低温下能自发进行
C.任何温度都能自发进行 D.任何温度都不能自发进行
(2)科学家提出以吸附性活性炭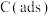 为催化剂,利用
为催化剂,利用 与
与 制备“合成气”(
制备“合成气”( 、
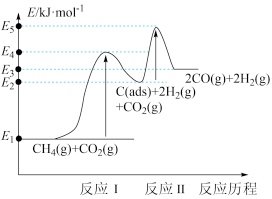
、 )。其反应历程分两步,反应历程的能量变化如下图:
)。其反应历程分两步,反应历程的能量变化如下图:
反应Ⅰ: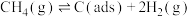 (慢反应)
(慢反应)
反应Ⅱ: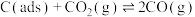 (快反应)
(快反应)
①加入活性炭C(ads)使该反应的活化能___________ (填“升高”“降低”或“不变”)。
② 与
与 制备“合成气”的反应为
制备“合成气”的反应为___________ 反应(填“放热”或“吸热”),其热化学方程式为___________ ( 用
用 表示),能量变化图中:
表示),能量变化图中:
___________  (填“>”、“<”或“=”)。
(填“>”、“<”或“=”)。
(1)一定条件下,
 分解反应
分解反应 的部分反应历程如下图所示。
的部分反应历程如下图所示。
①该历程图表示
②
 分解反应
分解反应A.高温下能自发进行 B.低温下能自发进行
C.任何温度都能自发进行 D.任何温度都不能自发进行
(2)科学家提出以吸附性活性炭
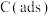 为催化剂,利用
为催化剂,利用 与
与 制备“合成气”(
制备“合成气”( 、
、 )。其反应历程分两步,反应历程的能量变化如下图:
)。其反应历程分两步,反应历程的能量变化如下图:
反应Ⅰ:
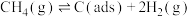 (慢反应)
(慢反应)反应Ⅱ:
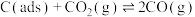 (快反应)
(快反应)①加入活性炭C(ads)使该反应的活化能
②
 与
与 制备“合成气”的反应为
制备“合成气”的反应为 用
用 表示),能量变化图中:
表示),能量变化图中:
 (填“>”、“<”或“=”)。
(填“>”、“<”或“=”)。
您最近一年使用:0次
解题方法
9 . 下列说法错误的是
A. ,恒温时,缩小容积,气体颜色变浅 ,恒温时,缩小容积,气体颜色变浅 |
B.若压强不再随时间变化能说明反应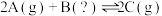 已达平衡,则 已达平衡,则 一定为气体 一定为气体 |
C.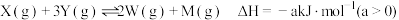 ,加入 ,加入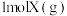 与 与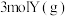 充分反应后,放出热量小于 充分反应后,放出热量小于 |
D. 该反应 该反应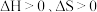 |
您最近一年使用:0次
10 .  与
与 催化重整制取
催化重整制取 的反应方程式为
的反应方程式为 ,下列关于该反应的说法正确的是
,下列关于该反应的说法正确的是
 与
与 催化重整制取
催化重整制取 的反应方程式为
的反应方程式为 ,下列关于该反应的说法正确的是
,下列关于该反应的说法正确的是A. ,表明反应达平衡状态 ,表明反应达平衡状态 |
| B.该反应放热,在任意温度下都能自发进行 |
C.增大压强,平衡向右移动,平衡常数 增大 增大 |
D.升温可加快反应速率并提高 的平衡产率 的平衡产率 |
您最近一年使用:0次



