名校
解题方法
1 . 研究从含锌资源中获取 的途径具有重要意义。
的途径具有重要意义。
I.工业上酸浸提锌
氧化锌矿中含有 等。
等。 如下:
如下:
ii.浸出液中主要金属阳离子浓度如下:
(1)浸出渣的主要成分有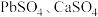 和
和 。
。 和
和 反应的离子方程式为
反应的离子方程式为_____ 。
(2)加入试剂a的目的是_______ 。
(3)电解前,含 溶液中铁和铝的离子浓度均需小于
溶液中铁和铝的离子浓度均需小于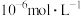 ,应调节
,应调节 的范围是
的范围是_______ (忽略①和②导致的体积变化)。
(4)工业上采用惰性电极作阳极电解 溶液可实现湿法炼锌,电解过程中总反应的离子方程式为
溶液可实现湿法炼锌,电解过程中总反应的离子方程式为_______ 。
Ⅱ.实验室中氨浸提锌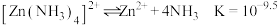 ;
;
iv.M的结构简式如图所示,R为 ,两个羟基中,酚羟基酸性较强。
,两个羟基中,酚羟基酸性较强。 和
和 中
中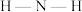 键角大小是
键角大小是_______ (填“前者大”或“后者大”)。
(6) 和
和 浸取
浸取 发生反应的离子方程式是
发生反应的离子方程式是_______ 。
(7)M能与 形成稳定的配合物X,相关反应为
形成稳定的配合物X,相关反应为 。X的结构如图所示。X中形成氢键有利于
。X的结构如图所示。X中形成氢键有利于 的萃取,原因可能是
的萃取,原因可能是_______ 。 能提高有机溶液中X含量的原因:
能提高有机溶液中X含量的原因:_______ 。
 的途径具有重要意义。
的途径具有重要意义。I.工业上酸浸提锌
氧化锌矿中含有
 等。
等。
 如下:
如下:| 难溶电解质 |  |  |  |  |
 |  |  | 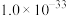 |  |
| 金属阳离子 |  |  和 和 |  |
浓度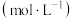 | 0.3 | 0.1 | 0.1 |
(1)浸出渣的主要成分有
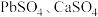 和
和 。
。 和
和 反应的离子方程式为
反应的离子方程式为(2)加入试剂a的目的是
(3)电解前,含
 溶液中铁和铝的离子浓度均需小于
溶液中铁和铝的离子浓度均需小于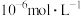 ,应调节
,应调节 的范围是
的范围是(4)工业上采用惰性电极作阳极电解
 溶液可实现湿法炼锌,电解过程中总反应的离子方程式为
溶液可实现湿法炼锌,电解过程中总反应的离子方程式为Ⅱ.实验室中氨浸提锌

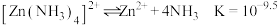 ;
;iv.M的结构简式如图所示,R为
 ,两个羟基中,酚羟基酸性较强。
,两个羟基中,酚羟基酸性较强。
 和
和 中
中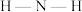 键角大小是
键角大小是(6)
 和
和 浸取
浸取 发生反应的离子方程式是
发生反应的离子方程式是(7)M能与
 形成稳定的配合物X,相关反应为
形成稳定的配合物X,相关反应为 。X的结构如图所示。X中形成氢键有利于
。X的结构如图所示。X中形成氢键有利于 的萃取,原因可能是
的萃取,原因可能是
 能提高有机溶液中X含量的原因:
能提高有机溶液中X含量的原因:
您最近一年使用:0次
2024-05-07更新
|
203次组卷
|
2卷引用:湖南省长沙市雅礼中学2024届高三下学期模拟卷(一)化学试题
名校
解题方法
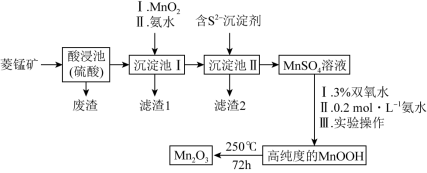
2 . Mn2O3是一种重要的化工产品。以菱锰矿(主要成分为MnCO3,还含有少量Fe3O4、FeO、CoO、Al2O3)为原料制备Mn2O3的工艺流程如图:
已知:氢氧化氧锰(MnOOH)难溶于水和碱性溶液。
(1)MnOOH中Mn的化合价为_______ 价。
(2)向“沉淀池I”中加入MnO2,MnO2的作用是_______ ,在“沉淀池I”中,滴加氨水调节溶液的pH,使溶液中铝、铁元素完全沉淀,则理论上pH的最小值为_______ (当溶液中某离子浓度c≤1.0×10-5mol•L-1时,可认为该离子沉淀完全)。
(3)MnSO4转化为MnOOH的离子方程式为_______ 。
(4)MnSO4转化为MnOOH中“III实验操作”包含过滤、洗涤、干燥,检验MnOOH是否洗涤干净,具体操作为_______ 。
(5)MnS晶胞与NaCl晶胞属于同种类型,MnS晶胞结构如图所示。_______ 。
②已知:MnS晶体的边长为bnm,NA为阿伏加德罗常数的值,则MnS晶胞密度为_______ g•cm-3(列出计算式即可)。
| 物质 | Fe(OH)2 | Fe(OH)3 | Al(OH)3 | Mn(OH)2 | Co(OH)2 |
| Ksp | 1×10-16.3 | 1×10-38.6 | 1×10-32.3 | 1×10-12.7 | 1.09×10-15 |
(1)MnOOH中Mn的化合价为
(2)向“沉淀池I”中加入MnO2,MnO2的作用是
(3)MnSO4转化为MnOOH的离子方程式为
(4)MnSO4转化为MnOOH中“III实验操作”包含过滤、洗涤、干燥,检验MnOOH是否洗涤干净,具体操作为
(5)MnS晶胞与NaCl晶胞属于同种类型,MnS晶胞结构如图所示。
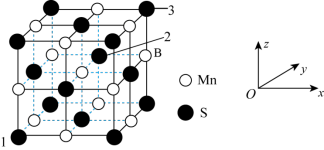
②已知:MnS晶体的边长为bnm,NA为阿伏加德罗常数的值,则MnS晶胞密度为
您最近一年使用:0次
名校
解题方法
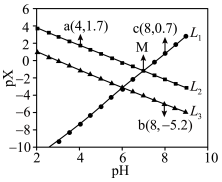
3 . 常温下,在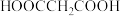 (简记为
(简记为 )和
)和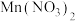 的混合溶液中滴加
的混合溶液中滴加 溶液,混合溶液中
溶液,混合溶液中 [
[ ,
, 、
、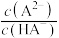 、
、 ]与
]与 的关系如图所示。下列叙述错误的是
的关系如图所示。下列叙述错误的是
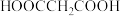 (简记为
(简记为 )和
)和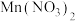 的混合溶液中滴加
的混合溶液中滴加 溶液,混合溶液中
溶液,混合溶液中 [
[ ,
, 、
、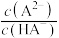 、
、 ]与
]与 的关系如图所示。下列叙述错误的是
的关系如图所示。下列叙述错误的是
A. 代表 代表 与 与 的关系 的关系 |
B.直线 和 和 的交叉点坐标为 的交叉点坐标为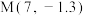 |
C.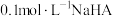 溶液中: 溶液中: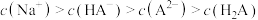 |
D.常温下,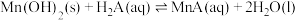 的 的 值为 值为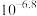 |
您最近一年使用:0次
2024-04-05更新
|
202次组卷
|
2卷引用:湖南省常德市汉寿县第一中学2023-2024学年高三下学期3月月考化学试题
4 . 向 溶液中滴加NaCl溶液,发生反应
溶液中滴加NaCl溶液,发生反应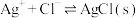 和
和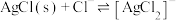 。
。 与
与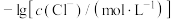 的关系如下图所示(其中M代表
的关系如下图所示(其中M代表 或
或 )。下列说法错误的是
)。下列说法错误的是

 溶液中滴加NaCl溶液,发生反应
溶液中滴加NaCl溶液,发生反应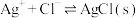 和
和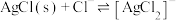 。
。 与
与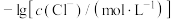 的关系如下图所示(其中M代表
的关系如下图所示(其中M代表 或
或 )。下列说法错误的是
)。下列说法错误的是
A. 时,溶液中 时,溶液中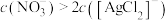 |
B.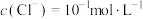 时,溶液中 时,溶液中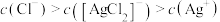 |
C.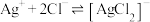 的平衡常数 的平衡常数 的值为 的值为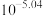 |
D.用 沉淀 沉淀 ,溶液中 ,溶液中 浓度过大时,沉淀效果不好 浓度过大时,沉淀效果不好 |
您最近一年使用:0次
解题方法
5 . 氧化锌在橡胶、油漆涂料、化工、医疗及食品等行业有着广泛应用。一种以含锌烟灰(含有 、
、 、
、 、
、 、
、 、
、 、
、 、
、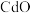 等)为原料制备氧化锌的工艺流程如图所示:
等)为原料制备氧化锌的工艺流程如图所示: 、
、 、
、 ;
;
ⅱ.25℃时相关物质的 如下表:
如下表:
(1) 态核外电子能级共
态核外电子能级共_____ 个。
(2)“氧化预处理”阶段得到的氧化产物有 、
、 ,“氧化预处理”的目的是
,“氧化预处理”的目的是_____ 。
(3)“氨浸”时生成多种配离子,其中生成 的离子方程式为
的离子方程式为_____ 。
(4)已知: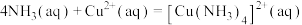
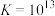 ,则
,则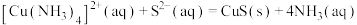 的化学平衡常数
的化学平衡常数 为
为_____ 。
(5)“蒸氨”时得到混合气体e和固体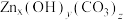 。
。
①混合气体e可返回至_____ 工序循环利用;
②取11.2g固体,经充分“煅烧”后得到氧化锌8.1g,同时产生的气体通入到足量 溶液中,可得沉淀9.85g,则固体
溶液中,可得沉淀9.85g,则固体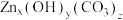 的化学式为
的化学式为_____ 。
(6)通过氢电极增压法可利用产品氧化锌进一步制得单质锌(如图),储罐内 溶解后形成
溶解后形成 离子,电解池中发生总反应的离子方程式为
离子,电解池中发生总反应的离子方程式为_____ 。
 、
、 、
、 、
、 、
、 、
、 、
、 、
、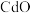 等)为原料制备氧化锌的工艺流程如图所示:
等)为原料制备氧化锌的工艺流程如图所示: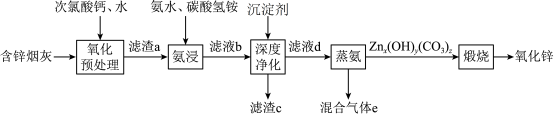
 、
、 、
、 ;
;ⅱ.25℃时相关物质的
 如下表:
如下表:| 物质 |  |  |  |  |  |  |
 | 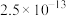 |  |  | 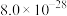 | 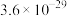 | 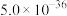 |
(1)
 态核外电子能级共
态核外电子能级共(2)“氧化预处理”阶段得到的氧化产物有
 、
、 ,“氧化预处理”的目的是
,“氧化预处理”的目的是(3)“氨浸”时生成多种配离子,其中生成
 的离子方程式为
的离子方程式为(4)已知:
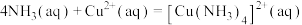
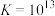 ,则
,则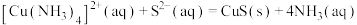 的化学平衡常数
的化学平衡常数 为
为(5)“蒸氨”时得到混合气体e和固体
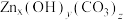 。
。①混合气体e可返回至
②取11.2g固体,经充分“煅烧”后得到氧化锌8.1g,同时产生的气体通入到足量
 溶液中,可得沉淀9.85g,则固体
溶液中,可得沉淀9.85g,则固体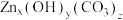 的化学式为
的化学式为(6)通过氢电极增压法可利用产品氧化锌进一步制得单质锌(如图),储罐内
 溶解后形成
溶解后形成 离子,电解池中发生总反应的离子方程式为
离子,电解池中发生总反应的离子方程式为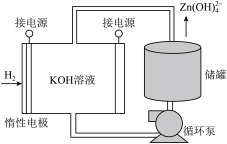
您最近一年使用:0次
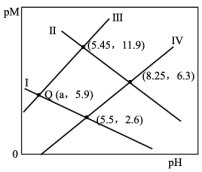
6 . 工业上常用 作沉淀剂除去废水中的
作沉淀剂除去废水中的 和
和 。通过调节溶液的
。通过调节溶液的 可使
可使 和
和 逐一沉降,处理过程中始终保持
逐一沉降,处理过程中始终保持 溶液为饱和状态即
溶液为饱和状态即 ,体系中
,体系中 、
、 、
、 、
、 浓度(mol/L)的负对数
浓度(mol/L)的负对数 与
与 的关系如图所示。已知:
的关系如图所示。已知: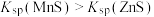 。下列说法错误的是
。下列说法错误的是
 作沉淀剂除去废水中的
作沉淀剂除去废水中的 和
和 。通过调节溶液的
。通过调节溶液的 可使
可使 和
和 逐一沉降,处理过程中始终保持
逐一沉降,处理过程中始终保持 溶液为饱和状态即
溶液为饱和状态即 ,体系中
,体系中 、
、 、
、 、
、 浓度(mol/L)的负对数
浓度(mol/L)的负对数 与
与 的关系如图所示。已知:
的关系如图所示。已知: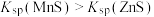 。下列说法错误的是
。下列说法错误的是
A.Ⅱ表示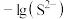 与 与 的关系曲线 的关系曲线 |
B. 点对应 点对应 的数量级为 的数量级为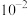 |
C.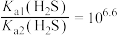 |
D.溶液中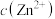 和 和 均为 均为 , , 完全沉淀时溶液的最小 完全沉淀时溶液的最小 为2(金属离子的浓度≤10-5mol/L可认为沉淀完全) 为2(金属离子的浓度≤10-5mol/L可认为沉淀完全) |
您最近一年使用:0次
2024-02-06更新
|
271次组卷
|
2卷引用:湖南省长沙市宁乡市第一高级中学2021届高三新高考第一次模拟考试化学试卷
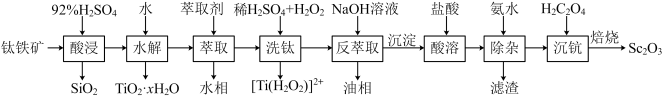
7 . 钪(Sc)是地壳中含量极少的稀土元素,在照明、合金和催化剂等领域有重要应用。钛铁矿的主要成分为FeTiO3(可表示为FeO·TiO2),还含有少量SiO2、Sc2O3等氧化物,从钛铁矿中提取Sc2O3的流程如下:
已知:①当离子浓度减小至10-5mol·L-1时可认为沉淀完全
②室温下,溶液中离子沉淀完全的pH如下表所示:
③lg2=0.3,Ksp[Sc(OH)3]=1.25×10-33。回答下列问题:
(1)“酸浸”后Ti元素转化为TiOSO4,其水解反应的化学方程式是___________ 。
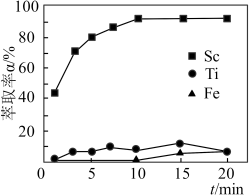
(2)“萃取”时,使用10%P2O4+5%TBP+煤油作为萃取剂,一定条件下萃取率α受振荡时间的影响如图,萃取时选择最佳的振荡时间为___________ min。
(3)若“酸溶”后滤液中Sc3+的浓度为0.01mol·L-1,则“除杂”过程中应控制的pH范围是___________ 。
(4)“沉钪”后得到五水草酸钪,焙烧生成四种氧化物。其反应的化学方程式为___________ 。

已知:①当离子浓度减小至10-5mol·L-1时可认为沉淀完全
②室温下,溶液中离子沉淀完全的pH如下表所示:
| 离子 | Fe3+ | Fe2+ | TiO2+ |
| 沉淀完全的pH | 3.2 | 9.0 | 1.05 |
(1)“酸浸”后Ti元素转化为TiOSO4,其水解反应的化学方程式是
(2)“萃取”时,使用10%P2O4+5%TBP+煤油作为萃取剂,一定条件下萃取率α受振荡时间的影响如图,萃取时选择最佳的振荡时间为

(3)若“酸溶”后滤液中Sc3+的浓度为0.01mol·L-1,则“除杂”过程中应控制的pH范围是
(4)“沉钪”后得到五水草酸钪,焙烧生成四种氧化物。其反应的化学方程式为
您最近一年使用:0次
名校
解题方法
8 . 三氯化钌( )是重要的化工原料,广泛应用于催化、电镀、电解阳极、电子工业等。从
)是重要的化工原料,广泛应用于催化、电镀、电解阳极、电子工业等。从 催化剂废料中分离制各
催化剂废料中分离制各 和
和 的一种工艺流程如图所示。
的一种工艺流程如图所示。
(1)基态 原子的价电子排布式为
原子的价电子排布式为___________ 。
(2)“焙烧”后所得固体主要成分为 、
、 、
、 和
和___________ 。
(3)“还原”过程会产生 和
和 沉淀,该反应的化学方程式为
沉淀,该反应的化学方程式为______________________ 。
(4)“酸溶”过程中,先加入盐酸溶解 ,然后加入盐酸羟胺(
,然后加入盐酸羟胺( )得到
)得到 和
和 。则该两种产物的物质的量之比为
。则该两种产物的物质的量之比为___________ 。
(5)“蒸发结晶”在真空度为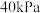 时进行(此时水的沸点是
时进行(此时水的沸点是 ),其目的是
),其目的是___________ 。
(6)若维持 不变,让
不变,让 沉淀完全(
沉淀完全( 浓度不高于
浓度不高于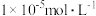 ),则混合体系中
),则混合体系中 的浓度不低于
的浓度不低于___________ 。[已知: ,
,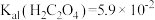 ,
, 结果保留三位小数]
结果保留三位小数]
(7)“沉钴”时,若得到的是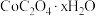 晶体,该反应的离子方程式为
晶体,该反应的离子方程式为______________________ 。
(8)该流程中,还有一种重要成分 未提取,你认为在哪一步骤后进行最合适:
未提取,你认为在哪一步骤后进行最合适:___________ 。
 )是重要的化工原料,广泛应用于催化、电镀、电解阳极、电子工业等。从
)是重要的化工原料,广泛应用于催化、电镀、电解阳极、电子工业等。从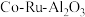 催化剂废料中分离制各
催化剂废料中分离制各 和
和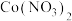 的一种工艺流程如图所示。
的一种工艺流程如图所示。
(1)基态
 原子的价电子排布式为
原子的价电子排布式为(2)“焙烧”后所得固体主要成分为
 、
、 、
、 和
和(3)“还原”过程会产生
 和
和 沉淀,该反应的化学方程式为
沉淀,该反应的化学方程式为(4)“酸溶”过程中,先加入盐酸溶解
 ,然后加入盐酸羟胺(
,然后加入盐酸羟胺( )得到
)得到 和
和 。则该两种产物的物质的量之比为
。则该两种产物的物质的量之比为(5)“蒸发结晶”在真空度为
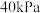 时进行(此时水的沸点是
时进行(此时水的沸点是 ),其目的是
),其目的是(6)若维持
 不变,让
不变,让 沉淀完全(
沉淀完全( 浓度不高于
浓度不高于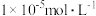 ),则混合体系中
),则混合体系中 的浓度不低于
的浓度不低于 ,
,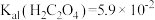 ,
, 结果保留三位小数]
结果保留三位小数](7)“沉钴”时,若得到的是
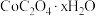 晶体,该反应的离子方程式为
晶体,该反应的离子方程式为(8)该流程中,还有一种重要成分
 未提取,你认为在哪一步骤后进行最合适:
未提取,你认为在哪一步骤后进行最合适:
您最近一年使用:0次
2024-01-09更新
|
1296次组卷
|
6卷引用:湖南省株洲市2024届高三上学期教学质量统一检测化学试题
湖南省株洲市2024届高三上学期教学质量统一检测化学试题湖南省株洲市2023-2024学年高三上学期教学质量统一检测化学试卷2024届湖南省长沙市雅礼中学高三下学期3月综合测试(一)化学试题(已下线)专题08 工艺流程综合题-【好题汇编】2024年高考化学一模试题分类汇编(全国通用)(已下线)大题01 化工流程综合题(分类过关)-【大题精做】冲刺2024年高考化学大题突破+限时集训(新高考专用)2024届江西省贵溪市实验中学高三下学期5月模拟考试压轴(三)化学试卷
9 . 草酸钴是制作氧化钴和金属钴的原料。一种利用含钴废料(主要成分为Co2O3,含少量Fe2O3、Al2O3、CaO、MgO、碳及有机物等)制取CoC2O4的工艺流程如图:
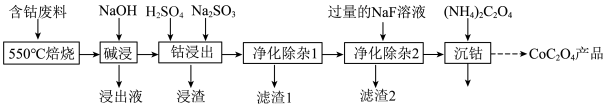
(1)“550℃焙烧”的目的是_________ 。
(2)“碱浸”过程中发生反应的化学方程式______ 。
(3)“钴浸出”过程中,不能用盐酸代替硫酸,因为Co2O3与盐酸反应生成Cl2污染环境,该反应的离子方程式为________ 。
(4)“净化除杂1”过程中,先在40~50℃加入H2O2,再升温至80~85℃,加入Na2CO3溶液,调pH至4.5.滤渣1的主要成分是_______ 。金属离子与H2O2反应的离子方程式为________ 。
(5)“净化除杂2”过程中,加入NaF以除去原溶液中Ca2+(浓度为1.0×10﹣3mol⋅L﹣1)和Mg2+,若控制溶液中c(F﹣)=2.0×10﹣3mol⋅L﹣1,则Ca2+的去除率准确值为________ 。[已知某温度下,Ksp(CaF2)=4.0×10﹣11]
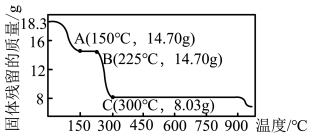
(6)如图为二水合草酸钴(CoC2O4⋅2H2O摩尔质量为183g/mol)在空气中受热的质量变化曲线,曲线中300℃及以上所得固体均为钴氧化物。写出B点物质与O2在一定温度下发生反应生成C点物质的化学方程式_________ 。

(1)“550℃焙烧”的目的是
(2)“碱浸”过程中发生反应的化学方程式
(3)“钴浸出”过程中,不能用盐酸代替硫酸,因为Co2O3与盐酸反应生成Cl2污染环境,该反应的离子方程式为
(4)“净化除杂1”过程中,先在40~50℃加入H2O2,再升温至80~85℃,加入Na2CO3溶液,调pH至4.5.滤渣1的主要成分是
(5)“净化除杂2”过程中,加入NaF以除去原溶液中Ca2+(浓度为1.0×10﹣3mol⋅L﹣1)和Mg2+,若控制溶液中c(F﹣)=2.0×10﹣3mol⋅L﹣1,则Ca2+的去除率准确值为
(6)如图为二水合草酸钴(CoC2O4⋅2H2O摩尔质量为183g/mol)在空气中受热的质量变化曲线,曲线中300℃及以上所得固体均为钴氧化物。写出B点物质与O2在一定温度下发生反应生成C点物质的化学方程式

您最近一年使用:0次
2024-01-07更新
|
196次组卷
|
2卷引用:湖南省长沙市雅礼中学2023-2024学年高三上学期月考试卷(六)化学试题
名校
解题方法
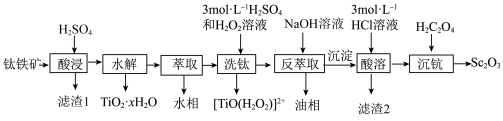
10 . 氧化钪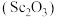 可用作半导体镀层的蒸镀材料,也可制成可变波长的固体激光器和高清晰度的电视电子枪、金属卤化物灯等。从钛铁矿(主要成分为
可用作半导体镀层的蒸镀材料,也可制成可变波长的固体激光器和高清晰度的电视电子枪、金属卤化物灯等。从钛铁矿(主要成分为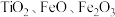 ,还含有
,还含有 等元素)中提取
等元素)中提取 的流程如下图。
的流程如下图。
已知:
①当离子浓度减小至 时可认为沉淀完全。
时可认为沉淀完全。
②室温下 完全沉淀的
完全沉淀的 为1.05。
为1.05。
③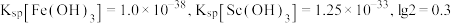 。
。
回答下列问题:
(1)“酸浸”后 元素转化为
元素转化为 ,其水解反应的离子方程式是
,其水解反应的离子方程式是_______ 。
(2) 既有氧化性又有还原性,还有弱酸性,请写出它的电离方程式
既有氧化性又有还原性,还有弱酸性,请写出它的电离方程式_______ 。
(3)萃取剂萃取 的反应原理为阳离子交换:
的反应原理为阳离子交换: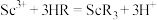 (
( 代表萃取剂)。在“反萃取”中反应生成含
代表萃取剂)。在“反萃取”中反应生成含 化合物的化学方程式是
化合物的化学方程式是_______ 。
(4)“酸溶”后滤液中存在的金属阳离子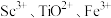 浓度均小于
浓度均小于 ,再用氨水调节溶液
,再用氨水调节溶液 使
使 、
、 沉淀完全而
沉淀完全而 不沉淀,则调
不沉淀,则调 应控制的范围是
应控制的范围是_______ 。
(5)由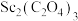 在空气中煅烧生成
在空气中煅烧生成 的化学反应方程式
的化学反应方程式_______ 。
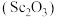 可用作半导体镀层的蒸镀材料,也可制成可变波长的固体激光器和高清晰度的电视电子枪、金属卤化物灯等。从钛铁矿(主要成分为
可用作半导体镀层的蒸镀材料,也可制成可变波长的固体激光器和高清晰度的电视电子枪、金属卤化物灯等。从钛铁矿(主要成分为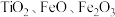 ,还含有
,还含有 等元素)中提取
等元素)中提取 的流程如下图。
的流程如下图。
已知:
①当离子浓度减小至
 时可认为沉淀完全。
时可认为沉淀完全。②室温下
 完全沉淀的
完全沉淀的 为1.05。
为1.05。③
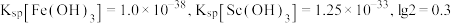 。
。回答下列问题:
(1)“酸浸”后
 元素转化为
元素转化为 ,其水解反应的离子方程式是
,其水解反应的离子方程式是(2)
 既有氧化性又有还原性,还有弱酸性,请写出它的电离方程式
既有氧化性又有还原性,还有弱酸性,请写出它的电离方程式(3)萃取剂萃取
 的反应原理为阳离子交换:
的反应原理为阳离子交换: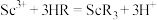 (
( 代表萃取剂)。在“反萃取”中反应生成含
代表萃取剂)。在“反萃取”中反应生成含 化合物的化学方程式是
化合物的化学方程式是(4)“酸溶”后滤液中存在的金属阳离子
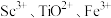 浓度均小于
浓度均小于 ,再用氨水调节溶液
,再用氨水调节溶液 使
使 、
、 沉淀完全而
沉淀完全而 不沉淀,则调
不沉淀,则调 应控制的范围是
应控制的范围是(5)由
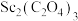 在空气中煅烧生成
在空气中煅烧生成 的化学反应方程式
的化学反应方程式
您最近一年使用:0次
2023-12-19更新
|
302次组卷
|
2卷引用:湖南省雅礼教育集团2023-2024学年高二上学期期中考试化学试题



