名校
1 . 室温下,用含少量 的
的 溶液制备
溶液制备 的过程如题图所示,已知
的过程如题图所示,已知 ,
, 。下列说法正确的是
。下列说法正确的是

 的
的 溶液制备
溶液制备 的过程如题图所示,已知
的过程如题图所示,已知 ,
, 。下列说法正确的是
。下列说法正确的是
A.增大NaF溶液的浓度,可以将 沉淀至浓度为0 沉淀至浓度为0 |
B.“除镁”得到的上层清液中: |
C. 溶液显碱性,则: 溶液显碱性,则: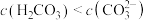 |
D.“沉锰”步骤中的离子方程式为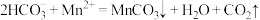 |
您最近一年使用:0次
2023-12-12更新
|
119次组卷
|
2卷引用:湖南省邵东市第三中学2023-2024学年高二上学期第三次月考化学试题
名校
解题方法
2 . 某废钒渣(主要成分为V2O3,含有少量Al2O3、CaO)为原料生产V2O5的工艺流程如图:
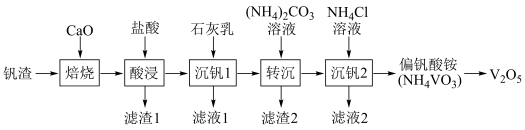
已知:钒酸(H3VO4)是强酸,NH4VO3难溶于水;+5价钒在溶液中的主要存在形式与溶液pH的关系如表。
(1)向钒渣中加入生石灰焙烧,将V2O3转化为Ca(VO3)2的化学方程式为_______ 。
(2)已知Ca(VO3)2难溶于水,可溶于盐酸。若“酸浸”时溶液的pH=4,则Ca(VO3)2溶于盐酸的离子方程式为_______ 。
(3)已知加入石灰乳后生成Ca3(VO4)2沉淀,则加入石灰乳的作用是_______ 。
(4)反应Ca3(VO4)2(s)+3 (aq)⇌2VO
(aq)⇌2VO (aq)+3CaCO3(s)的平衡常数为
(aq)+3CaCO3(s)的平衡常数为_______ (用含m,n的代数式表示),已知:Ksp(CaCO3)=m,Ksp[Ca3(VO4)2]=n。
(5)沉钒2过程中加入氯化铵溶液,控制溶液的pH=7.5,当pH>8时,NH4VO3的产量明显降低,原因是_______ 。
(6)测定产品中V2O5的纯度:取ag产品用硫酸溶解得(VO2)2SO4溶液,加入b1mLclmol·L-1(NH4)2Fe(SO4)2溶液(VO +2H++Fe2+=VO2++Fe3++H2O),再用c2mol·L-1KMnO4溶液滴定过量的(NH4)2Fe(SO4)2至终点,消耗KMnO4溶液的体积为b2mL。已知
+2H++Fe2+=VO2++Fe3++H2O),再用c2mol·L-1KMnO4溶液滴定过量的(NH4)2Fe(SO4)2至终点,消耗KMnO4溶液的体积为b2mL。已知 被还原为Mn2+,假设杂质不参与反应。
被还原为Mn2+,假设杂质不参与反应。
①滴定时装KMnO4溶液为_______ 滴定管(填“酸式”或“碱式”)
②则产品中V2O5的质量分数是_______ (V2O5的摩尔质量为Mg·mol-1)。
(7)下列操作会导致测定的纯度偏高的是_______。

已知:钒酸(H3VO4)是强酸,NH4VO3难溶于水;+5价钒在溶液中的主要存在形式与溶液pH的关系如表。
| pH | 4~6 | 6~8 | 8~10 | 10~12 |
| 主要离子 | VO |  | V2O | VO |
(1)向钒渣中加入生石灰焙烧,将V2O3转化为Ca(VO3)2的化学方程式为
(2)已知Ca(VO3)2难溶于水,可溶于盐酸。若“酸浸”时溶液的pH=4,则Ca(VO3)2溶于盐酸的离子方程式为
(3)已知加入石灰乳后生成Ca3(VO4)2沉淀,则加入石灰乳的作用是
(4)反应Ca3(VO4)2(s)+3
 (aq)⇌2VO
(aq)⇌2VO (aq)+3CaCO3(s)的平衡常数为
(aq)+3CaCO3(s)的平衡常数为(5)沉钒2过程中加入氯化铵溶液,控制溶液的pH=7.5,当pH>8时,NH4VO3的产量明显降低,原因是
(6)测定产品中V2O5的纯度:取ag产品用硫酸溶解得(VO2)2SO4溶液,加入b1mLclmol·L-1(NH4)2Fe(SO4)2溶液(VO
 +2H++Fe2+=VO2++Fe3++H2O),再用c2mol·L-1KMnO4溶液滴定过量的(NH4)2Fe(SO4)2至终点,消耗KMnO4溶液的体积为b2mL。已知
+2H++Fe2+=VO2++Fe3++H2O),再用c2mol·L-1KMnO4溶液滴定过量的(NH4)2Fe(SO4)2至终点,消耗KMnO4溶液的体积为b2mL。已知 被还原为Mn2+,假设杂质不参与反应。
被还原为Mn2+,假设杂质不参与反应。①滴定时装KMnO4溶液为
②则产品中V2O5的质量分数是
(7)下列操作会导致测定的纯度偏高的是_______。
| A.锥形瓶水洗后未干燥 |
| B.滴定前滴定管尖嘴有气泡,滴定结束无气泡 |
| C.滴定终点时俯视读数 |
| D.滴定管用蒸馏水洗净后未用标准溶液润洗 |
您最近一年使用:0次
解题方法
3 .  (钉)被广泛用于制笔。某小组以某含
(钉)被广泛用于制笔。某小组以某含 废料[主要成分是
废料[主要成分是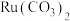 ,含
,含 (其中
(其中 为+6价)、
为+6价)、 、
、 、
、 和
和 等]为原料制备
等]为原料制备 的流程如图所示:
的流程如图所示:
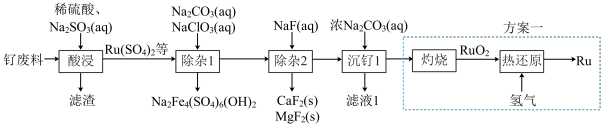
已知:常温下, ,
, ;离子浓度小于或等于
;离子浓度小于或等于 时认为该离子已被完全除去。
时认为该离子已被完全除去。
回答下列问题:
(1)滤渣主要成分是___________ (填化学式)。
(2)“酸浸”中 转化成
转化成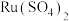 的离子方程式为
的离子方程式为___________ 。
(3)“除杂1”中氯元素被还原成最低价态,若只氧化 ,生成
,生成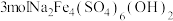 理论上需要
理论上需要___________ 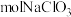 。
。
(4)“除杂1”之后,若滤液中 ,则“除杂2”中先生成的沉淀是
,则“除杂2”中先生成的沉淀是___________ (填化学式)。“除杂2”的滤液中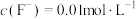 ,则
,则 和
和 是否除尽?
是否除尽?___________ (填“是”或“否”)。
(5)“除杂2”宜选择的容器有___________(填标号)。
(6)该小组设计方案2优化方案1,从安全角度分析,方案2优于方案1,其理由是___________ 。
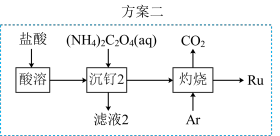
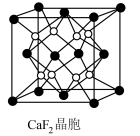
(7) 晶胞如图所示,晶胞中,钙离子将晶胞切割成8个小空隙,
晶胞如图所示,晶胞中,钙离子将晶胞切割成8个小空隙, 可以看成是填充在
可以看成是填充在 割切的空隙中,则
割切的空隙中,则 填充在
填充在 构成的
构成的___________ (填“正八面体形”“正方形”或“正四面体形”)空隙中,其填充率为___________ 。
 (钉)被广泛用于制笔。某小组以某含
(钉)被广泛用于制笔。某小组以某含 废料[主要成分是
废料[主要成分是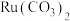 ,含
,含 (其中
(其中 为+6价)、
为+6价)、 、
、 、
、 和
和 等]为原料制备
等]为原料制备 的流程如图所示:
的流程如图所示:
已知:常温下,
 ,
, ;离子浓度小于或等于
;离子浓度小于或等于 时认为该离子已被完全除去。
时认为该离子已被完全除去。回答下列问题:
(1)滤渣主要成分是
(2)“酸浸”中
 转化成
转化成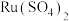 的离子方程式为
的离子方程式为(3)“除杂1”中氯元素被还原成最低价态,若只氧化
 ,生成
,生成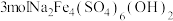 理论上需要
理论上需要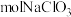 。
。(4)“除杂1”之后,若滤液中
 ,则“除杂2”中先生成的沉淀是
,则“除杂2”中先生成的沉淀是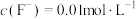 ,则
,则 和
和 是否除尽?
是否除尽?(5)“除杂2”宜选择的容器有___________(填标号)。
| A.陶瓷 | B.铁质 | C.石英 | D.氧化铝 |
(6)该小组设计方案2优化方案1,从安全角度分析,方案2优于方案1,其理由是

(7)
 晶胞如图所示,晶胞中,钙离子将晶胞切割成8个小空隙,
晶胞如图所示,晶胞中,钙离子将晶胞切割成8个小空隙, 可以看成是填充在
可以看成是填充在 割切的空隙中,则
割切的空隙中,则 填充在
填充在 构成的
构成的
您最近一年使用:0次
名校
解题方法
4 . 向 饱和溶液(有足量
饱和溶液(有足量 固体)中滴加氨水,发生反应
固体)中滴加氨水,发生反应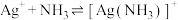 和
和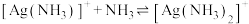 ,
,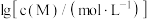 与
与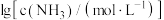 的关系如图所示{其中
的关系如图所示{其中 代表
代表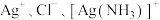 或
或 }。
}。
 饱和溶液(有足量
饱和溶液(有足量 固体)中滴加氨水,发生反应
固体)中滴加氨水,发生反应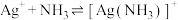 和
和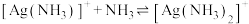 ,
,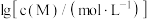 与
与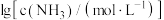 的关系如图所示{其中
的关系如图所示{其中 代表
代表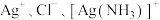 或
或 }。
}。
A.曲线Ⅲ表示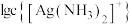 随 随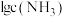 的变化曲线 的变化曲线 |
B.随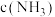 增大, 增大, 先增大后减小 先增大后减小 |
C.反应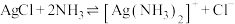 的平衡常数为 的平衡常数为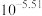 |
D.完全溶解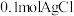 ,至少需要含有 ,至少需要含有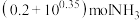 的氨水 的氨水 |
您最近一年使用:0次
2023-10-06更新
|
900次组卷
|
8卷引用:湖南省长沙市雅礼中学2023-2024学年高二下学期期中考试化学试题
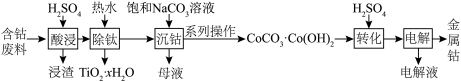
5 . 以湿法炼锌厂所产的钴锰渣(主要成分为 Co2O3、CoO、NiO、MnO2,含少量 Fe2O3、ZnO、CuO、CaO 等)为原料回收制备 CoC2O4 的工艺如下:

已知:“酸浸”后溶液中含有 Co2+、Mn2+、Ni2+、Fe2+、Zn2+、Ca2+、Cu2+。常温下, Ka1(H2S)=1.0×10-7,Ka2(H2S)=7.0×10-15;Ksp(CuS)=1.3×10-36,Ksp[Cu(OH)2]=2.2×10-20, Ksp(ZnS)=1.3×10-24。回答下列问题:
(1)“酸浸”时可能产生有毒气体_______ ,说出该气体的一种用途_______ 。
(2)“氧化调 pH”过程中得到KFe3(SO4)2(OH)6的离子方程式为_______ 。
(3)试分析Cu2+主要以_______ [填“CuS”或“Cu(OH)2”]形式除去。
(4)“滤渣 3”中含有 a mol S、b mol MnO2,则理论上需要Co(OH)3的物质的量为_______ mol (用含 a、b 的式子表示)。
(5)采用双萃取剂 P204、P507 分离钴镍。P204、P507 对金属离子的萃取率与 pH 的关系如下图所示。
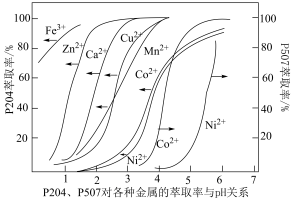
①直接用于分离钴镍的萃取剂是_______ 。
②指出分离钴镍的合适pH范围为_______ (填标号)。
A.3~4 B.4~5 C.5~6 D.6~7

已知:“酸浸”后溶液中含有 Co2+、Mn2+、Ni2+、Fe2+、Zn2+、Ca2+、Cu2+。常温下, Ka1(H2S)=1.0×10-7,Ka2(H2S)=7.0×10-15;Ksp(CuS)=1.3×10-36,Ksp[Cu(OH)2]=2.2×10-20, Ksp(ZnS)=1.3×10-24。回答下列问题:
(1)“酸浸”时可能产生有毒气体
(2)“氧化调 pH”过程中得到KFe3(SO4)2(OH)6的离子方程式为
(3)试分析Cu2+主要以
(4)“滤渣 3”中含有 a mol S、b mol MnO2,则理论上需要Co(OH)3的物质的量为
(5)采用双萃取剂 P204、P507 分离钴镍。P204、P507 对金属离子的萃取率与 pH 的关系如下图所示。

①直接用于分离钴镍的萃取剂是
②指出分离钴镍的合适pH范围为
A.3~4 B.4~5 C.5~6 D.6~7
您最近一年使用:0次
名校
解题方法
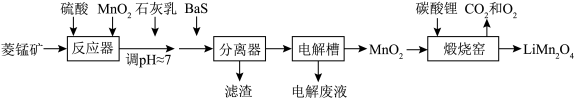
6 .  作为一种新型锂电池正极材料受到广泛关注。由菱锰矿(
作为一种新型锂电池正极材料受到广泛关注。由菱锰矿( ,含有少量
,含有少量 、
、 、
、 、
、 等元素)制备
等元素)制备 的流程如下:
的流程如下:
已知: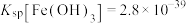 ,
,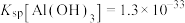 ,
,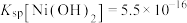 。
。
回答下列问题:
(1)硫酸溶矿主要反应的化学方程式为
(2)加入少量
 的作用是
的作用是(3)溶矿反应完成后,反应器中溶液
 ,此时
,此时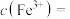
 ;用石灰乳调节至
;用石灰乳调节至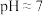 ,除去的金属离子是
,除去的金属离子是(4)加入少量
 溶液除去
溶液除去 ,生成的沉淀有
,生成的沉淀有(5)在电解槽中,发生电解反应的离子方程式为
(6)煅烧窑中,生成
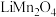 反应的化学方程式是
反应的化学方程式是
您最近一年使用:0次
2023-09-02更新
|
442次组卷
|
3卷引用:湖南省长沙市弘益高级中学2023-2024学年高三上学期第四次月考化学试卷
名校
7 . 钒(V)广泛应用于冶金、化工、航天等领域。一种以钒渣(主要成分是 、
、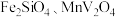 等)为原料制取金属钒的工艺流程如图所示:
等)为原料制取金属钒的工艺流程如图所示: 具有强氧化性,主要存在于
具有强氧化性,主要存在于 的溶液中,
的溶液中,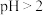 时转化成酸式多钒酸盐。
时转化成酸式多钒酸盐。
②溶液中金属离子开始沉淀和完全沉淀的 如下表所示:
如下表所示:
回答下列问题:
(1) 中
中 为
为 价,
价, 的化合价为
的化合价为_______ ;基态 原子价层电子排布图为
原子价层电子排布图为_______ 。
(2)“焙烧Ⅰ”中将 和空气分别加入炉中,焙烧将
和空气分别加入炉中,焙烧将 转化为
转化为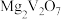 和
和 的化学方程式为
的化学方程式为_______ 。
(3)“酸浸”所得浸出液中除含有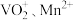 外,还含有的金属阳离子有
外,还含有的金属阳离子有_______ 。
(4)“沉钒”可得到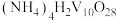 沉淀,“焙烧Ⅱ”中发生反应的化学方程式为
沉淀,“焙烧Ⅱ”中发生反应的化学方程式为_______ 。
(5)“沉钒”所得滤液中加入氨水调节溶液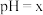 ,过滤得到
,过滤得到 沉淀和溶液A,溶液A中
沉淀和溶液A,溶液A中 浓度为
浓度为 ,为尽可能多地回收
,为尽可能多地回收 ,并避免
,并避免 中混入
中混入 ,应控制
,应控制
_______ 。
 、
、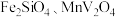 等)为原料制取金属钒的工艺流程如图所示:
等)为原料制取金属钒的工艺流程如图所示: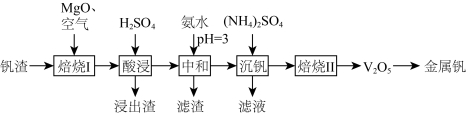
 具有强氧化性,主要存在于
具有强氧化性,主要存在于 的溶液中,
的溶液中,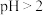 时转化成酸式多钒酸盐。
时转化成酸式多钒酸盐。②溶液中金属离子开始沉淀和完全沉淀的
 如下表所示:
如下表所示:| 金属离子 |  |  |  |  |
开始沉淀时 的 的 | 1.9 | 7.0 | 8.1 | 8.9 |
沉淀完全时 的 的 | 3.2 | 9.0 | 10.1 | 10.9 |
(1)
 中
中 为
为 价,
价, 的化合价为
的化合价为 原子价层电子排布图为
原子价层电子排布图为(2)“焙烧Ⅰ”中将
 和空气分别加入炉中,焙烧将
和空气分别加入炉中,焙烧将 转化为
转化为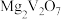 和
和 的化学方程式为
的化学方程式为(3)“酸浸”所得浸出液中除含有
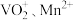 外,还含有的金属阳离子有
外,还含有的金属阳离子有(4)“沉钒”可得到
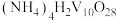 沉淀,“焙烧Ⅱ”中发生反应的化学方程式为
沉淀,“焙烧Ⅱ”中发生反应的化学方程式为(5)“沉钒”所得滤液中加入氨水调节溶液
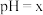 ,过滤得到
,过滤得到 沉淀和溶液A,溶液A中
沉淀和溶液A,溶液A中 浓度为
浓度为 ,为尽可能多地回收
,为尽可能多地回收 ,并避免
,并避免 中混入
中混入 ,应控制
,应控制
您最近一年使用:0次
2023-07-01更新
|
112次组卷
|
2卷引用:湖南省岳阳市2022-2023学年高二下学期6月期末考试化学试题
名校
解题方法
8 . 氧化铋((Bi2O3)是一种淡黄色、低毒的氧化物俗称铋黄,广泛应用于医药合成、能源材料等领域,也是制作防火纸的材料之一,以下是一种用铋精矿(Bi2S3,含有FeS2、Cu2S、PbO2及不溶性杂质)制备Bi2O3的一种方法,其流程如图:

已知:①Fe(OH)3开始沉淀的pH值为2.7,沉淀完全时的pH值为3.7
②pH≥3时,BiCl3极易水解为白色的BiOCl沉淀。
请回答以下问题:
(1)铋原子价层电子排布式为:___________
(2)“加压浸取”过程中,Bi2S3转化为Bi2O3,FeS2转化为Fe2O3,而Cu2S溶解进入浸出液,且硫元素转化为SO ,请写出Cu2S在此过程中发生反应的离子方程式:
,请写出Cu2S在此过程中发生反应的离子方程式:___________ 。
(3)实验室灼烧(BiO)2CO3时用到的硅酸盐制品有___________ 、___________ 、酒精灯、玻璃棒。
(4)根据流程分析,盐酸羟胺(NH3OHCl)在流程中的作用是:①___________ ;②___________ 。
(5)流程中生成(BiO)2CO3的化学方程式为:___________ 。
(6)实际生产过程中温度保持在50℃左右(BiO)2CO3产率较高,请分析温度过低或过高时(BiO)2CO3产率较低的原因___________ 。

已知:①Fe(OH)3开始沉淀的pH值为2.7,沉淀完全时的pH值为3.7
②pH≥3时,BiCl3极易水解为白色的BiOCl沉淀。
请回答以下问题:
(1)铋原子价层电子排布式为:
(2)“加压浸取”过程中,Bi2S3转化为Bi2O3,FeS2转化为Fe2O3,而Cu2S溶解进入浸出液,且硫元素转化为SO
 ,请写出Cu2S在此过程中发生反应的离子方程式:
,请写出Cu2S在此过程中发生反应的离子方程式:(3)实验室灼烧(BiO)2CO3时用到的硅酸盐制品有
(4)根据流程分析,盐酸羟胺(NH3OHCl)在流程中的作用是:①
(5)流程中生成(BiO)2CO3的化学方程式为:
(6)实际生产过程中温度保持在50℃左右(BiO)2CO3产率较高,请分析温度过低或过高时(BiO)2CO3产率较低的原因
您最近一年使用:0次
2023-05-31更新
|
385次组卷
|
3卷引用:湖南省衡阳市第八中学2023-2024学年高三上学期12月月考化学试题
9 . 二元有机酸(H2X)的电离常数Ka1=1.67×10-8、Ka2=3.34×10-17。BaX难溶于水,常温下,将一定浓度的HY溶液,逐滴加入盛有一定量BaX固体的试管中,直到BaX全部溶解,测得混合液中c2(H+)与c2(Ba2+)的关系如图所示。下列说法错误的是
②0.192=0.0361,0.382=0.1444
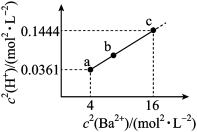
②0.192=0.0361,0.382=0.1444
| A.NaHX溶液显碱性 |
| B.溶度积Ksp(BaX)≈6.18×10-21mol2•L-2 |
| C.b点:2c(Ba2+)+c(H+)=2c(X2-)+c(HX-)+c(OH-)+c(Y-) |
| D.若0.1molBaX溶于25mLxmol•L-1HY溶液中得到c点溶液,则x≈8.38 |
您最近一年使用:0次
2023-04-27更新
|
1049次组卷
|
2卷引用:湖南省张家界市慈利县第一中学2023-2024学年高二上学期第二次月考化学试题
名校
10 . 钴是航空、军事和机械工业中不可或缺的金属,一种从含钴废料(主要含钴、钡、钛的化合物)中提取金属钴的工艺流程如下: 的溶度积常数分别为
的溶度积常数分别为 。
。
回答下列问题:
(1)晶体钴中钴原子的堆积方式如图所示,钴原子的配位数为____________ 。 的难溶物外,还有
的难溶物外,还有____________ (填化学式),此工序中浸出温度与 浸出率的关系如图所示,综合考虑成本和浸出率,选择的最佳浸出温度为
浸出率的关系如图所示,综合考虑成本和浸出率,选择的最佳浸出温度为____________  ;此温度下,还能提高酸浸效果的措施为
;此温度下,还能提高酸浸效果的措施为____________ 。 生成
生成 的离子方程式为
的离子方程式为____________ 。
(4)获得纯净碱式碳酸钴 的“系列操作”具体是指
的“系列操作”具体是指____________ 。室温下,沉钴所得母液中 时,溶液中的
时,溶液中的 为
为____________ 。
(5)资料表明:离子在电极上的放电顺序和电压有关,电压增大,放电顺序靠后的离子也可以参与电极反应。用惰性电极电解 溶液可得到钴单质,实际生产中发现电解相同时间,钴的产率随电压的变化如图所示。当电压超过
溶液可得到钴单质,实际生产中发现电解相同时间,钴的产率随电压的变化如图所示。当电压超过 时,钴的产率降低的原因可能是
时,钴的产率降低的原因可能是____________ 。
 的溶度积常数分别为
的溶度积常数分别为 。
。回答下列问题:
(1)晶体钴中钴原子的堆积方式如图所示,钴原子的配位数为
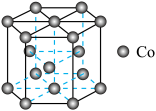
 的难溶物外,还有
的难溶物外,还有 浸出率的关系如图所示,综合考虑成本和浸出率,选择的最佳浸出温度为
浸出率的关系如图所示,综合考虑成本和浸出率,选择的最佳浸出温度为 ;此温度下,还能提高酸浸效果的措施为
;此温度下,还能提高酸浸效果的措施为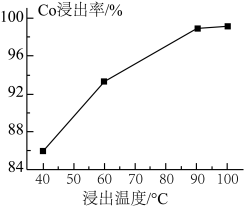
 生成
生成 的离子方程式为
的离子方程式为(4)获得纯净碱式碳酸钴
 的“系列操作”具体是指
的“系列操作”具体是指 时,溶液中的
时,溶液中的 为
为(5)资料表明:离子在电极上的放电顺序和电压有关,电压增大,放电顺序靠后的离子也可以参与电极反应。用惰性电极电解
 溶液可得到钴单质,实际生产中发现电解相同时间,钴的产率随电压的变化如图所示。当电压超过
溶液可得到钴单质,实际生产中发现电解相同时间,钴的产率随电压的变化如图所示。当电压超过 时,钴的产率降低的原因可能是
时,钴的产率降低的原因可能是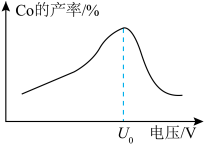
您最近一年使用:0次
2023-04-22更新
|
169次组卷
|
2卷引用:湖南省岳阳市岳阳县第一中学2023-2024学年高三下学期4月期中考试化学试题



