2023·全国·模拟预测
名校
解题方法
1 . 二十大报告提出深入推进环境污染防治。一种废催化剂(含V2O5、V2O4、V2O3和杂质Fe2O3、SiO2等)的处理流程如图所示。已知工序①得到的溶液的主要成分是[VO(C2O4)2]2-、[Fe(C2O4)2]2-和H2C2O4。下列说法错误的是
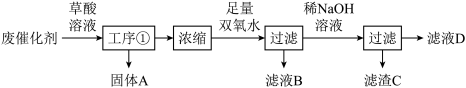
| A.固体A的主要成分是SiO2 |
B.含[Fe(C2O4)2]2-的溶液中存在[Fe(C2O4)2]2- FeC2O4+C2O FeC2O4+C2O K1=10-1.8,FeC2O4 K1=10-1.8,FeC2O4 Fe2++C2O Fe2++C2O K2=10-3.0,若c(C2O K2=10-3.0,若c(C2O )=0.10mol•L-1,则 )=0.10mol•L-1,则 =102.8 =102.8 |
| C.在实验室中进行工序①要用到普通漏斗,进行浓缩要用到蒸发皿 |
D.加入足量双氧水生成V2O5·H2O,反应的离子方程式为H2O2+2[VO(C2O4)2]2-=V2O5·H2O↓+2C2O |
您最近一年使用:0次
2023-04-21更新
|
669次组卷
|
5卷引用:湖南省衡阳市衡阳县第二中学2023-2024学年高三下学期开学摸底考试化学试卷
湖南省衡阳市衡阳县第二中学2023-2024学年高三下学期开学摸底考试化学试卷(已下线)2023年普通高中学业水平选择性考试化学押题卷(四)(已下线)专题八工艺流程图(练)(已下线)题型36 微型化工工艺流程四川省绵阳市高中2022-2023学年高二下学期理科突击班6月月考化学试题
2023·全国·模拟预测
名校
解题方法
2 . 以铜钴矿[主要成分为CoOOH、 、
、 ,另含少量
,另含少量 及含砷化合物]制备锂电池正极原料
及含砷化合物]制备锂电池正极原料 ,生产流程如图甲所示。
,生产流程如图甲所示。

已知:①酸浸液中含有的阳离子为 、
、 、
、 、
、 ;②萃取除铜的过程可表示为
;②萃取除铜的过程可表示为 ;③
;③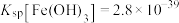 ,
,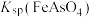
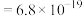 。
。
(1)一种钴的氧化物的晶胞结构如图乙所示,该氧化物中钴离子的价电子排布式为_______ ,该氧化物中钴离子的配位数是_______ 。设 为阿伏加德罗常数的值,晶胞参数为apm,该晶体的密度为
为阿伏加德罗常数的值,晶胞参数为apm,该晶体的密度为_______  。
。

(2)酸浸液中钴以 形式存在,生成
形式存在,生成 的化学方程式为
的化学方程式为_______ 。酸浸过程中可适当升温以加快反应速率,但温度过高,单位时间内钴的浸出率明显降低,原因是_______ 。
(3)实验室模拟萃取除铜,加入萃取剂后充分振荡静置,如图丙所示,则分离出含铜有机溶剂的具体实验操作为_______ 。

(4)在除铁过程中,溶液中的 转化为
转化为 沉淀,该反应的离子方程式为
沉淀,该反应的离子方程式为_______ 。常温条件下,若除铁结束后溶液pH=3,则 是否完全沉淀(离子浓度低于
是否完全沉淀(离子浓度低于 时,可认为该离子完全沉淀)?通过计算说明:
时,可认为该离子完全沉淀)?通过计算说明:_______ 。
 、
、 ,另含少量
,另含少量 及含砷化合物]制备锂电池正极原料
及含砷化合物]制备锂电池正极原料 ,生产流程如图甲所示。
,生产流程如图甲所示。
已知:①酸浸液中含有的阳离子为
 、
、 、
、 、
、 ;②萃取除铜的过程可表示为
;②萃取除铜的过程可表示为 ;③
;③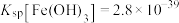 ,
,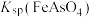
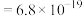 。
。(1)一种钴的氧化物的晶胞结构如图乙所示,该氧化物中钴离子的价电子排布式为
 为阿伏加德罗常数的值,晶胞参数为apm,该晶体的密度为
为阿伏加德罗常数的值,晶胞参数为apm,该晶体的密度为 。
。
(2)酸浸液中钴以
 形式存在,生成
形式存在,生成 的化学方程式为
的化学方程式为(3)实验室模拟萃取除铜,加入萃取剂后充分振荡静置,如图丙所示,则分离出含铜有机溶剂的具体实验操作为

(4)在除铁过程中,溶液中的
 转化为
转化为 沉淀,该反应的离子方程式为
沉淀,该反应的离子方程式为 是否完全沉淀(离子浓度低于
是否完全沉淀(离子浓度低于 时,可认为该离子完全沉淀)?通过计算说明:
时,可认为该离子完全沉淀)?通过计算说明:
您最近一年使用:0次
2023-04-11更新
|
426次组卷
|
3卷引用:湖南省长沙市湖南师范大学附属中学2023-2024学年高三下学期第七次月考化学试题
名校
3 . 已知常温下水溶液中 、
、 、
、 、HB、
、HB、 的分布分数δ[如
的分布分数δ[如 ]随pH变化曲线如图1;溶液中
]随pH变化曲线如图1;溶液中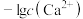 和
和 关系如图2.用
关系如图2.用
 溶液滴定20.00mL
溶液滴定20.00mL
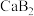 溶液,下列说法错误的是
溶液,下列说法错误的是

 、
、 、
、 、HB、
、HB、 的分布分数δ[如
的分布分数δ[如 ]随pH变化曲线如图1;溶液中
]随pH变化曲线如图1;溶液中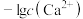 和
和 关系如图2.用
关系如图2.用
 溶液滴定20.00mL
溶液滴定20.00mL
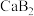 溶液,下列说法错误的是
溶液,下列说法错误的是
| A.曲线d表示δ(HB) |
B. 的水解平衡常数 的水解平衡常数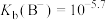 |
| C.滴定过程中溶液会变浑浊 |
D.滴定过程中始终存在: |
您最近一年使用:0次
2023-04-10更新
|
1876次组卷
|
12卷引用:湖南省长郡中学2024届高三上学期月考卷(一)化学试题
湖南省长郡中学2024届高三上学期月考卷(一)化学试题湖南省长沙市长郡中学2024届高三上学期9月月考化学试题河北省石家庄市部分学校2023届高中毕业年级教学质量检测(二)(一模)化学试题河北省邢台市2022-2023学年高三下学期4月第一次模拟考试化学试题(已下线)专题15 水溶液中的离子平衡山东省东营市第一中学2023届高三下学期二模化学试题东北育才学校高中部2023届高三下学期适应性考试化学试题重庆市七校2023-2024学年高三上学期开学考试化学试题江西省宜丰中学创新部2023-2024学年高二上学期第一次(10月)月考化学试题四川省宜宾市叙州区第一中学校2023-2024学年高二上学期12月月考化学试题(已下线)化学(九省联考考后提升卷,河南卷)-2024年1月“九省联考”真题完全解读与考后提升(已下线)热点18 电解质溶液图像分析
名校
解题方法
4 . 某软锰矿含锰为50%,是重要的锰矿石。其主要成分如表:
某科研团队设计制备高纯度MnCO3。反应原理为①MnO2+BaS+H2O=MnO+Ba(OH)2+S;②MnO+H2SO4=MnSO4+H2O;③硫酸锰+碳酸氢铵+一水合氨→MnCO3↓(白色)。工艺流程图如图。

回答下列问题:
(1)软锰矿与硫化钡反应时,适当提高反应液温度的目的是_____ 。
(2)“不溶物”中除SiO2外,还有_____ (“填化学式”)。
(3)工序2中加入H2O2的目的是_____ ,使用氨水调溶液的pH,理论上pH最小值为_____ 。(通常认为溶液中离子浓度小于10-5mol•L-1为沉淀完全;Ksp[Fe(OH)3]=10-38.6、Ksp[Fe(OH)2]=10-16.3、Ksp[Al(OH)3]=10-32.3、Ksp[Mn(OH)2]=10-12.7)
(4)MnF2难溶于水,工序3加入MnF2的目的是除去Mg2+,其反应的离子反应方程式为_____ 。
(5)碳化过程中发生反应的化学方程式为______ 。
(6)由镍、锰、镓制备的磁性形状记忆型合金中,基态Mn原子的价电子的轨道表示式为_____ 。晶胞结构如图,晶胞参数为anm,则该晶体的密度为______ g•cm-3(NA表示阿伏加德罗常数)。

| 软锰矿主要成分 | 杂质 |
| MnO2 | MgO、FeO、Fe2O3、Al2O3、SiO2等杂质 |

回答下列问题:
(1)软锰矿与硫化钡反应时,适当提高反应液温度的目的是
(2)“不溶物”中除SiO2外,还有
(3)工序2中加入H2O2的目的是
(4)MnF2难溶于水,工序3加入MnF2的目的是除去Mg2+,其反应的离子反应方程式为
(5)碳化过程中发生反应的化学方程式为
(6)由镍、锰、镓制备的磁性形状记忆型合金中,基态Mn原子的价电子的轨道表示式为

您最近一年使用:0次
2023-03-15更新
|
898次组卷
|
3卷引用:湖南省张家界市2023届高三下学期模拟考试化学试题
5 . 钼(Mo)是一种难熔稀有金属,钼及其合金在冶金、环保和航天等方面有着广泛的应用,其化合物钼酸钠晶体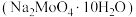 可制造金属缓蚀剂。下图为钼精矿(主要成分
可制造金属缓蚀剂。下图为钼精矿(主要成分 ,含有少量不反应杂质)制备钼酸钠晶体的工艺流程。
,含有少量不反应杂质)制备钼酸钠晶体的工艺流程。
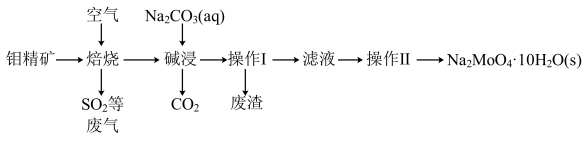
(1)“操作Ⅰ”的名称为_______ 。
(2)“焙烧”过程中钼的产物为 ,其反应的化学方程式为
,其反应的化学方程式为_______ 。
(3)提高“碱浸”浸出率的措施有_______ 。(任写一条)
(4)已知钼酸钠的溶解度曲线如图所示,“操作Ⅱ”的系列名称为_______ 、过滤、洗涤、烘干。

(5)在实际生产中会有少量 生成,用固体
生成,用固体 除去。在除
除去。在除 前测定碱浸液中
前测定碱浸液中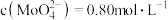 ,
,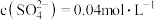 ,当
,当 开始沉淀时,
开始沉淀时, 的去除率为
的去除率为_______ 。[已知 ,
,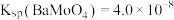 ,溶液体积变化可忽略不计]。
,溶液体积变化可忽略不计]。
(6)电氧化法提纯钼的原理:将辉钼矿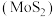 放入装有食盐水的电解槽中,用惰性电极电解时,
放入装有食盐水的电解槽中,用惰性电极电解时, 被氧化为
被氧化为 和
和 。
。
①辉钼矿应放入电解槽的_______ (填“阴极区”或“阳极区”);
②阴极的电极反应式为_______ 。
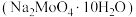 可制造金属缓蚀剂。下图为钼精矿(主要成分
可制造金属缓蚀剂。下图为钼精矿(主要成分 ,含有少量不反应杂质)制备钼酸钠晶体的工艺流程。
,含有少量不反应杂质)制备钼酸钠晶体的工艺流程。
(1)“操作Ⅰ”的名称为
(2)“焙烧”过程中钼的产物为
 ,其反应的化学方程式为
,其反应的化学方程式为(3)提高“碱浸”浸出率的措施有
(4)已知钼酸钠的溶解度曲线如图所示,“操作Ⅱ”的系列名称为

(5)在实际生产中会有少量
 生成,用固体
生成,用固体 除去。在除
除去。在除 前测定碱浸液中
前测定碱浸液中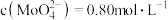 ,
,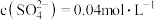 ,当
,当 开始沉淀时,
开始沉淀时, 的去除率为
的去除率为 ,
,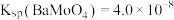 ,溶液体积变化可忽略不计]。
,溶液体积变化可忽略不计]。(6)电氧化法提纯钼的原理:将辉钼矿
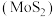 放入装有食盐水的电解槽中,用惰性电极电解时,
放入装有食盐水的电解槽中,用惰性电极电解时, 被氧化为
被氧化为 和
和 。
。①辉钼矿应放入电解槽的
②阴极的电极反应式为
您最近一年使用:0次
6 . 某元素M的氢氧化物 在水中的溶解反应为:
在水中的溶解反应为: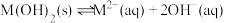 、
、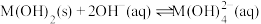 ,25℃时,
,25℃时,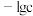 (c为
(c为 或
或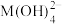 浓度的值)与
浓度的值)与 的关系如图所示。下列说法正确的是
的关系如图所示。下列说法正确的是

 在水中的溶解反应为:
在水中的溶解反应为: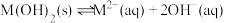 、
、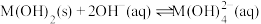 ,25℃时,
,25℃时,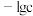 (c为
(c为 或
或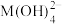 浓度的值)与
浓度的值)与 的关系如图所示。下列说法正确的是
的关系如图所示。下列说法正确的是
A.曲线②代表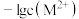 与 与 的关系 的关系 |
B. 的 的 约为 约为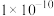 |
C.向 的溶液中加入 的溶液中加入 溶液至 溶液至 ,体系中元素M主要以 ,体系中元素M主要以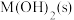 存在 存在 |
D.向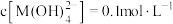 的溶液中加入等体积 的溶液中加入等体积 的 的 后,体系中元素M主要以 后,体系中元素M主要以 存在 存在 |
您最近一年使用:0次
2023-02-19更新
|
330次组卷
|
2卷引用:湖南省永州市2022-2023学年高二上学期期末考试化学试题
7 . 难溶盐 可溶于盐酸,常温下,用
可溶于盐酸,常温下,用 调节
调节 浊液的
浊液的 ,测得体系中
,测得体系中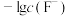 或
或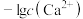 与
与 的关系如图所示。下列说法错误的是
的关系如图所示。下列说法错误的是

 可溶于盐酸,常温下,用
可溶于盐酸,常温下,用 调节
调节 浊液的
浊液的 ,测得体系中
,测得体系中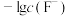 或
或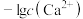 与
与 的关系如图所示。下列说法错误的是
的关系如图所示。下列说法错误的是
A.M代表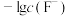 与 与 的变化曲线 的变化曲线 |
B.难溶盐 的溶度积常数 的溶度积常数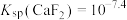 |
C.Y点的溶液中存在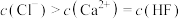 |
D.Z点的溶液中存在 |
您最近一年使用:0次
2023-02-18更新
|
1953次组卷
|
9卷引用:湖南省百校2023届高三开年摸底联考化学试题
湖南省百校2023届高三开年摸底联考化学试题浙江省杭州学军中学2022-2023学年高三下学期阶段性测试化学试题(已下线)素养卷05 电解质溶液中微粒变化图像题-【小题小卷】冲刺2023年高考化学小题限时集训(新高考专用)(已下线)先机卷 04 -【热题狂飙】2023年高考化学样卷(全国卷专用)广东省广州市等5地广州百师信息科技有限公司等2校2022-2023学年高三下学期开学考试化学试题山东省蒙阴第一中学等5校2023届高三开学摸底联考化学试题四川省绵阳市南山中学实验学校2022-2023学年高三下学期3月月考理科综合化学试题河南省南阳市第一中学校2023-2024学年高二上学期12月月考化学试题(已下线)选择题11-15
8 . 碳酸锶(SrCO3)难溶于水,主要用于电磁材料和金属冶炼。一种由工业碳酸锶(含少量Ba2+、Ca2+、 Mg2+、 Pb2+等 )制备高纯碳酸锶的工艺流程如下:
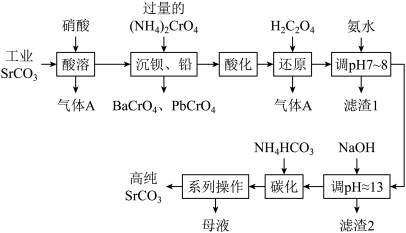
已知:I.Cr(OH)3为两性氢氧化物;
Ⅱ.常温下,各物质的溶度积常数如下表所示。
回答下列问题:
(1)基态Cr原子的价层电子排布为_______ 。
(2)“除钡、铅”时,pH过低会导致(NH4)2CrO4的利用率降低,原因为_______ (结合化学用语解释);“还原”时含铬微粒发生反应的离子方程式为_______ 。
(3)“滤渣1”的主要成分为_______ (填化学式)。
(4)用氨水和NaOH分步调节pH,而不是直接调节溶液的pH≈13的原因为_______ 。
(5)已知:碳酸的电离常数Ka1=4.4×10-7、 Ka2= 4.7×10-11, 则碳化时,反应Sr2+(aq)+2HCO (aq)
(aq) SrCO3(s)+H2CO3(aq)的平衡常数 K =
SrCO3(s)+H2CO3(aq)的平衡常数 K =_______ (保留两位有效数字)。
(6)“系列操作”中,将结晶过滤后,不经洗涤,直接以200℃热风烘干,便可得高纯SrCO3,其原因是_______ 。

已知:I.Cr(OH)3为两性氢氧化物;
Ⅱ.常温下,各物质的溶度积常数如下表所示。
| 化合物 | Cr(OH)3 | Ca(OH)2 | Mg(OH)2 | SrCO3 |
| Ksp近似值 | 1×10-31 | 5.5×10-6 | 1.8×10-11 | 5.6×10-10 |
(1)基态Cr原子的价层电子排布为
(2)“除钡、铅”时,pH过低会导致(NH4)2CrO4的利用率降低,原因为
(3)“滤渣1”的主要成分为
(4)用氨水和NaOH分步调节pH,而不是直接调节溶液的pH≈13的原因为
(5)已知:碳酸的电离常数Ka1=4.4×10-7、 Ka2= 4.7×10-11, 则碳化时,反应Sr2+(aq)+2HCO
 (aq)
(aq) SrCO3(s)+H2CO3(aq)的平衡常数 K =
SrCO3(s)+H2CO3(aq)的平衡常数 K =(6)“系列操作”中,将结晶过滤后,不经洗涤,直接以200℃热风烘干,便可得高纯SrCO3,其原因是
您最近一年使用:0次
2023-02-16更新
|
187次组卷
|
3卷引用:湖南省岳阳县第一中学2022-2023学年高二下学期开学考试化学试题
名校
解题方法
9 . 稀土是元素周期表第Ⅲ族副族元素钪(SC)、钇(Y)和镧系元素共17种化学元素的合称,是隐形战机、超导、核工业等高精尖领域必备的原料,但是稀土的开采和加工对环境破坏比较大。从某种矿物(含铁、铝等元素)中提取稀土(用R表示)的工艺如图:
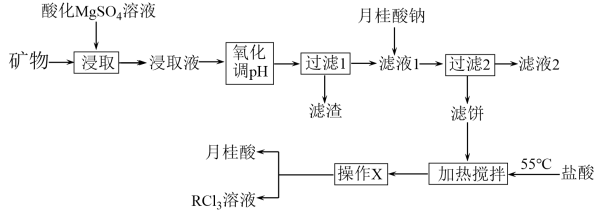
已知:①月桂酸(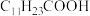 )熔点为44℃,难溶于水;
)熔点为44℃,难溶于水;
②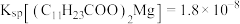 ;
;
③ 开始溶解时的pH为8.8,有关金属离子沉淀的相关pH见表。
开始溶解时的pH为8.8,有关金属离子沉淀的相关pH见表。
(1)“过滤1”前,用NaOH溶液调pH,控制pH的范围为_______ ,得到的滤渣主要成分为_______ 。
(2)“过滤2”后,滤饼中检测不到Mg元素,滤液2中 浓度为0.2mol/L。为尽可能多地提取
浓度为0.2mol/L。为尽可能多地提取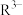 ,可提高月桂酸钠的加入量,但应确保“过滤2”前的溶液中
,可提高月桂酸钠的加入量,但应确保“过滤2”前的溶液中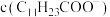 低于
低于_______  (保留两位有效数字)。
(保留两位有效数字)。
(3)“加热搅拌”控制在55℃左右,其原因是_______ 。
(4)稀土中钪元素的单质具有较高熔点且密度和铝接近,可制备高熔点轻质合金,此种合金可用作_______ (任答出一种用途即可)。
(5)某甲醇/ 燃料电池,电解质是掺杂
燃料电池,电解质是掺杂 的
的 晶体,它在熔融状态下能传导
晶体,它在熔融状态下能传导 ,写出该电池负极的电极反应式
,写出该电池负极的电极反应式_______ 。

已知:①月桂酸(
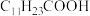 )熔点为44℃,难溶于水;
)熔点为44℃,难溶于水;②
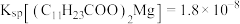 ;
;③
 开始溶解时的pH为8.8,有关金属离子沉淀的相关pH见表。
开始溶解时的pH为8.8,有关金属离子沉淀的相关pH见表。| 离子 |  |  |  |  |
| 开始沉淀时的pH | 8.8 | 1.5 | 3.6 | 6.2~7.4 |
| 沉淀完全时的pH | / | 3.2 | 4.7 | / |
(2)“过滤2”后,滤饼中检测不到Mg元素,滤液2中
 浓度为0.2mol/L。为尽可能多地提取
浓度为0.2mol/L。为尽可能多地提取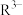 ,可提高月桂酸钠的加入量,但应确保“过滤2”前的溶液中
,可提高月桂酸钠的加入量,但应确保“过滤2”前的溶液中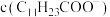 低于
低于 (保留两位有效数字)。
(保留两位有效数字)。(3)“加热搅拌”控制在55℃左右,其原因是
(4)稀土中钪元素的单质具有较高熔点且密度和铝接近,可制备高熔点轻质合金,此种合金可用作
(5)某甲醇/
 燃料电池,电解质是掺杂
燃料电池,电解质是掺杂 的
的 晶体,它在熔融状态下能传导
晶体,它在熔融状态下能传导 ,写出该电池负极的电极反应式
,写出该电池负极的电极反应式
您最近一年使用:0次
2023-02-09更新
|
220次组卷
|
2卷引用:湖南省长沙市雅礼中学2022-2023学年高二上学期期末考试化学试题
名校
解题方法
10 . 弱电解质的电离平衡、盐类的水解平衡和难溶物的溶解平衡均属于化学平衡。请回答下列有关平衡的问题。
Ⅰ.在一定温度下,向一个容积不变(1L)的密闭容器中,加入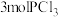 和
和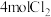 使之发生反应
使之发生反应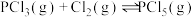 ,起始时压强为
,起始时压强为 ,平衡时容器内压强为起始时的6/7。计算并回答:
,平衡时容器内压强为起始时的6/7。计算并回答:
(1)已知:可逆反应的平衡常数可以用平衡分压代替平衡浓度(称为分压平衡常数,用 表示)计算,分压=总压×物质的量分数,则上述反应的
表示)计算,分压=总压×物质的量分数,则上述反应的
_______ (用含 的代数式表示)。
的代数式表示)。
(2)保持同一反应温度和体积,若将起始物改为amolPCl3,bmolCl2,cmol 。欲使平衡时各组分的体积分数与(1)中的一样,则a,b,c满足的关系为
。欲使平衡时各组分的体积分数与(1)中的一样,则a,b,c满足的关系为_______ 。
Ⅱ.某三元羧酸在表面活性剂、洗涤剂、润滑剂等方面具有重要的地位。常温时,向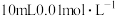 的溶液中滴入等浓度的NaOH溶液,H3A、
的溶液中滴入等浓度的NaOH溶液,H3A、 、
、 、
、 的物质的量分数与溶液的pH的关系如图所示。
的物质的量分数与溶液的pH的关系如图所示。
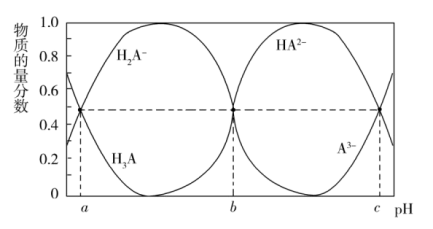
(3)常温时, 的
的 溶液的pH约为
溶液的pH约为_______ 。(已知 )
)
(4)常温时,反应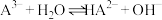 的平衡常数为K=
的平衡常数为K=_______ (用含a或b或c的代数式表示)
(5)当滴入30mLNaOH溶液时,下列溶液中微粒浓度关系正确的是_______
Ⅲ.含有 的废水毒性较大,某工厂废水中含
的废水毒性较大,某工厂废水中含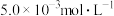 的
的 。为了使废水的排放达标,进行如下处理:
。为了使废水的排放达标,进行如下处理:
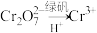 、
、
(6)该废水加硫酸酸化后,再加入绿矾( ),发生反应的离子方程式为
),发生反应的离子方程式为_______ 。
(7)若处理后的废水中残留的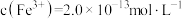 ,则残留的
,则残留的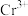 的浓度为
的浓度为_______ mol/L。(已知: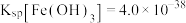 ,
,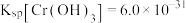 )。
)。
Ⅰ.在一定温度下,向一个容积不变(1L)的密闭容器中,加入
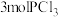 和
和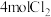 使之发生反应
使之发生反应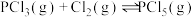 ,起始时压强为
,起始时压强为 ,平衡时容器内压强为起始时的6/7。计算并回答:
,平衡时容器内压强为起始时的6/7。计算并回答:(1)已知:可逆反应的平衡常数可以用平衡分压代替平衡浓度(称为分压平衡常数,用
 表示)计算,分压=总压×物质的量分数,则上述反应的
表示)计算,分压=总压×物质的量分数,则上述反应的
 的代数式表示)。
的代数式表示)。(2)保持同一反应温度和体积,若将起始物改为amolPCl3,bmolCl2,cmol
 。欲使平衡时各组分的体积分数与(1)中的一样,则a,b,c满足的关系为
。欲使平衡时各组分的体积分数与(1)中的一样,则a,b,c满足的关系为Ⅱ.某三元羧酸在表面活性剂、洗涤剂、润滑剂等方面具有重要的地位。常温时,向
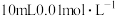 的溶液中滴入等浓度的NaOH溶液,H3A、
的溶液中滴入等浓度的NaOH溶液,H3A、 、
、 、
、 的物质的量分数与溶液的pH的关系如图所示。
的物质的量分数与溶液的pH的关系如图所示。
(3)常温时,
 的
的 溶液的pH约为
溶液的pH约为 )
)(4)常温时,反应
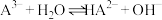 的平衡常数为K=
的平衡常数为K=(5)当滴入30mLNaOH溶液时,下列溶液中微粒浓度关系正确的是_______
A.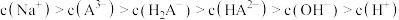 |
B.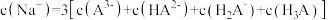 |
C.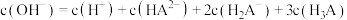 |
D.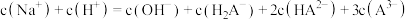 |
Ⅲ.含有
 的废水毒性较大,某工厂废水中含
的废水毒性较大,某工厂废水中含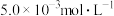 的
的 。为了使废水的排放达标,进行如下处理:
。为了使废水的排放达标,进行如下处理: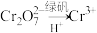 、
、
(6)该废水加硫酸酸化后,再加入绿矾(
 ),发生反应的离子方程式为
),发生反应的离子方程式为(7)若处理后的废水中残留的
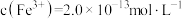 ,则残留的
,则残留的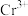 的浓度为
的浓度为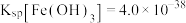 ,
,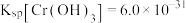 )。
)。
您最近一年使用:0次
2023-02-09更新
|
440次组卷
|
3卷引用:湖南省长沙市雅礼中学2022-2023学年高二上学期期末考试化学试题



