名校
解题方法
1 . 25℃时,向10mL 0.05 的
的 溶液中通入氨气,测得溶液中的p(OH)与p(Mg)之间的变化曲线如图所示。已知:
溶液中通入氨气,测得溶液中的p(OH)与p(Mg)之间的变化曲线如图所示。已知: ,
, ,
,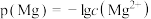 ,忽略反应过程中溶液体积的变化。下列说法正确的是
,忽略反应过程中溶液体积的变化。下列说法正确的是
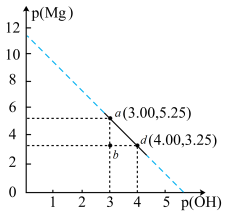
 的
的 溶液中通入氨气,测得溶液中的p(OH)与p(Mg)之间的变化曲线如图所示。已知:
溶液中通入氨气,测得溶液中的p(OH)与p(Mg)之间的变化曲线如图所示。已知: ,
, ,
,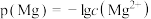 ,忽略反应过程中溶液体积的变化。下列说法正确的是
,忽略反应过程中溶液体积的变化。下列说法正确的是
A.a点溶液满足: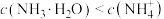 | B.b点溶液中会产生 沉淀 沉淀 |
C.d点溶液满足: | D.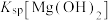 的数量级是 的数量级是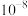 |
您最近一年使用:0次
2022-11-30更新
|
229次组卷
|
5卷引用:湖南省株洲市炎陵县2023-2024学年高二下学期开学化学试题
名校
解题方法
2 . 以软锰矿粉(含MnO2及少量Fe、Al、Si、Ca、Mg等的氧化物)为原料制备电池级MnO2。
(1)浸取。将一定量软锰矿粉与Na2SO3、H2SO4溶液中的一种配成悬浊液,加入到三颈瓶中(如图)。70℃下通过满液漏斗缓慢滴加另一种溶液,充分反应,过滤。滴液漏斗中的溶液是_______ ;MnO2转化为Mn2+的离子方程式为_______ 。

(2)除杂。向已经除去Fe、Al、Si的MnSO4溶液(pH约为5)中加入NH4F溶液,溶液中Ca2+、Mg2+形成氟化物沉淀。若沉淀后上层清夜中c(F-)=0.05mol/L,则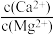 =
=_____ [Ksp(MgF2)=5×10-11,Ksp(CaF2)=5×10-9]
(3)制备MnCO3.在搅拌下向100mL1mol/LMnSO4溶液中缓慢滴加1mol/LNH4HCO3溶液,过滤、洗涤、干燥,得到MnCO3固体。需加入NH4HCO3溶液的体积约为_______ 。
(4)制备MnO2,MnCO3经热解、酸浸等步骤可制备MnO2。MnCO3在空气气流中热解得到三种价态锰的氧化物,锰元素所占比例(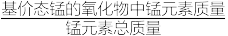 ×100%)随热解温度变化的曲线如图所示。
×100%)随热解温度变化的曲线如图所示。
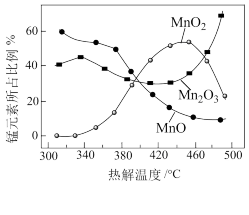
已知:MnO2与酸反应生成Mn2+;Mn2O3氧化性强于Cl2,加热条件下Mn2O3在酸性溶液中转化为MnO2和Mn2+。
为获得较高产率的MnO2,请补充实验方案:取一定量MnCO3置于热解装置中,通空气气流,加热到_______ 。将固体冷却后研成粉末,边搅摔边加入一定量_______ ,_______ ,充分反应后过滤,洗涤,_______ 。固体干燥,得到MnO2(可选用的试剂:1mol/LH2SO4溶液、2mol/LHCl溶液、0.1mo/LBaCl2溶液、0.1mol/LAgNO3溶液)。
(1)浸取。将一定量软锰矿粉与Na2SO3、H2SO4溶液中的一种配成悬浊液,加入到三颈瓶中(如图)。70℃下通过满液漏斗缓慢滴加另一种溶液,充分反应,过滤。滴液漏斗中的溶液是

(2)除杂。向已经除去Fe、Al、Si的MnSO4溶液(pH约为5)中加入NH4F溶液,溶液中Ca2+、Mg2+形成氟化物沉淀。若沉淀后上层清夜中c(F-)=0.05mol/L,则
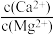 =
=(3)制备MnCO3.在搅拌下向100mL1mol/LMnSO4溶液中缓慢滴加1mol/LNH4HCO3溶液,过滤、洗涤、干燥,得到MnCO3固体。需加入NH4HCO3溶液的体积约为
(4)制备MnO2,MnCO3经热解、酸浸等步骤可制备MnO2。MnCO3在空气气流中热解得到三种价态锰的氧化物,锰元素所占比例(
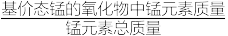 ×100%)随热解温度变化的曲线如图所示。
×100%)随热解温度变化的曲线如图所示。
已知:MnO2与酸反应生成Mn2+;Mn2O3氧化性强于Cl2,加热条件下Mn2O3在酸性溶液中转化为MnO2和Mn2+。
为获得较高产率的MnO2,请补充实验方案:取一定量MnCO3置于热解装置中,通空气气流,加热到
您最近一年使用:0次
2022-10-11更新
|
234次组卷
|
2卷引用:湖南省邵阳市第二中学2023-2024学年高二下学期入学考试化学试题
名校
解题方法
3 . 下列实验不能达到预期实验目的的是
| 选项 | 实验 | 实验目的 |
| A | 室温下,用pH计测定浓度均为0.1mol/L的 溶液和 溶液和 溶液的pH 溶液的pH | 比较 和 和 的酸性强弱 的酸性强弱 |
| B | 向盛有 溶液的试管中滴加2滴0.1mol/L的 溶液的试管中滴加2滴0.1mol/L的 溶液,产生白色沉淀后,再滴加2滴0.1mol/L的 溶液,产生白色沉淀后,再滴加2滴0.1mol/L的 溶液,又产生红褐色沉淀 溶液,又产生红褐色沉淀 | 验证该温度下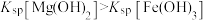 |
| C | 用铁片、铜片、稀硫酸等组成原电池 | 比较铁、铜的金属性强弱 |
| D | 室温下,分别向2支试管中加入相同体积、相同浓度的 溶液,再分别加入相同体积、不同浓度的稀硫酸 溶液,再分别加入相同体积、不同浓度的稀硫酸 | 研究浓度对反应速率的影响 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
2022-08-27更新
|
834次组卷
|
5卷引用:湖南省三湘创新发展联合2022-2023学年高三上学期起点调研考试化学试题
湖南省三湘创新发展联合2022-2023学年高三上学期起点调研考试化学试题河南省平顶山市、安阳市部分学校2022-2023学年高三上学期开学考试化学试题河南省洛阳市洛宁县第一高级中学2022-2023学年高三上学期开学考试化学试题广东省百校2023届高三上学期8月月考化学试题(已下线)专题24 实验分析设计型选择题-2023年高考化学毕业班二轮热点题型归纳与变式演练(新高考专用)
4 . 工业生产中利用方铅矿(主要成分为PbS,含有FeS2等杂质)制备PbSO4晶体的工艺流程如图:

已知:PbCl2难溶于冷水,易溶于热水;PbCl2(s)+2Cl-(aq) PbCl
PbCl (aq) △H>0;Ksp(PbSO4)=1×10-8,Ksp(PbCl2)=1.6×10-5。下列说法错误的是
(aq) △H>0;Ksp(PbSO4)=1×10-8,Ksp(PbCl2)=1.6×10-5。下列说法错误的是

已知:PbCl2难溶于冷水,易溶于热水;PbCl2(s)+2Cl-(aq)
 PbCl
PbCl (aq) △H>0;Ksp(PbSO4)=1×10-8,Ksp(PbCl2)=1.6×10-5。下列说法错误的是
(aq) △H>0;Ksp(PbSO4)=1×10-8,Ksp(PbCl2)=1.6×10-5。下列说法错误的是| A.“浸取”时的主要离子反应为MnO2+PbS+4H++2Cl-=PbCl2 +S+Mn2++2H2O |
| B.“滤渣2”的主要成分是Fe(OH)3 |
C.“沉降”时加入冰水,PbCl2(s)+2Cl-(aq) PbCl PbCl (aq)平衡左移,有利于PbCl2沉淀更完全 (aq)平衡左移,有利于PbCl2沉淀更完全 |
D.“沉淀转化”过程达平衡时,溶液中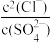 =1.6×103 =1.6×103 |
您最近一年使用:0次
2022-07-19更新
|
729次组卷
|
4卷引用:湖南省长沙麓山国际实验学校2023-2024学年高二下学期第一次学情检测化学试卷
湖南省长沙麓山国际实验学校2023-2024学年高二下学期第一次学情检测化学试卷 江西省九校2022-2023学年高二下学期开学联考化学试题河北省石家庄市第二中学教育集团2021-2022学年高二下学期期末考试化学试题(已下线)3.4.2 沉淀溶解平衡的应用-2022-2023学年高二化学上学期课后培优分级练(人教版2019选择性必修1)
5 . 锰是重要的合金材料和催化剂,在工农业生产和科技领域有广泛的用途。利用某工业废料[含MnO2、MnOOH、Zn(OH)2及少量Fe]制备Zn和MnO2的一种工艺流程如图所示:

已知:
①MnO能溶于酸,且Mn2+在酸性条件下比较稳定,pH高于5.5时易被O2氧化;
②室温下Ksp[Mn(OH)2]=10﹣13,Ksp[Fe(OH)3]=10﹣38,Ksp[Zn(OH)2]=10﹣17(当离子浓度≤10﹣5mol•L﹣1可认为沉淀完全)。
下列说法错误的是

已知:
①MnO能溶于酸,且Mn2+在酸性条件下比较稳定,pH高于5.5时易被O2氧化;
②室温下Ksp[Mn(OH)2]=10﹣13,Ksp[Fe(OH)3]=10﹣38,Ksp[Zn(OH)2]=10﹣17(当离子浓度≤10﹣5mol•L﹣1可认为沉淀完全)。
下列说法错误的是
| A.加入过量炭黑的主要作用是将MnO2、MnOOH转化为MnO |
| B.“酸浸”时,可以用浓盐酸代替稀硫酸 |
| C.“净化”时,溶液中Mn2+、Zn2+的浓度约为0.1mol•L﹣1,调节pH的合理范围是3≤pH<8 |
| D.“电解”时,阳极产物制得MnO2,阴极制得Zn,余下电解质溶液经处理可循环使用 |
您最近一年使用:0次
6 . 离子交换法测定PbCl2的Ksp的步骤如图,下列说法正确的是

已知:在离子交换柱中发生的反应为2RSO3H+Pb2+=(RSO3)2Pb+2H+

已知:在离子交换柱中发生的反应为2RSO3H+Pb2+=(RSO3)2Pb+2H+
| A.PbCl2饱和溶液通过交换柱时,交换液流出的速率越快越好 |
| B.用NaOH溶液滴定时,可用石蕊溶液作指示剂 |
| C.PbCl2的溶解度为5.76cVg |
| D.PbCl2的溶度积Ksp(PbCl2)=3.2(cV)3×10﹣5 |
您最近一年使用:0次
名校
7 . 某湿法炼锌的萃余液中含有Na+、Zn2+、Fe2+、Mn2+、Co2+、Cd2+及30~60g·L-1H2SO4等,逐级回收有价值金属并制取活性氧化锌的工艺流程如图:
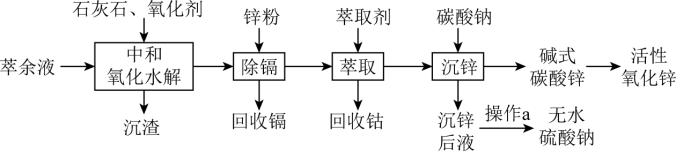
已知:
回答下列问题:
(1)“中和氧化水解”时,先加入适量的石灰石调节溶液的pH为1.0;加入一定量的Na2S2O8;再加入石灰石调节溶液的pH为4.0。
①氧化”时,Mn2+转化为MnO2除去,反应的离子方程式为_______ 。
②“沉渣”的主要成分除MnO2外还有_______ 。
③“氧化”时若加入过量的Na2S2O8,钴元素将会进入“沉渣”中,则水解后溶液中含钴微粒的浓度为_______ mol·L-1。
(2)“除镉”时,主要反应的离子方程式为_______ 。
(3)“沉锌”时,在近中性条件下加入Na2CO3可得碱式碳酸锌[ZnCO3·2Zn(OH)2·H2O]固体,同时产生大量的气体。产生大量气体的原因是_______ 。
(4)不同质量分数的Na2SO4溶液在不同温度下析出Na2SO4晶体的物种如图所示。欲从含20%Na2SO4及微量杂质的“沉锌后液”中直接析出无水Na2SO4,“操作a”为_______ 。


已知:
| 沉淀物 | Fe(OH)3 | Fe(OH)2 | Co(OH)2 | Co(OH)3 | Cd(OH)2 |
| Ksp | 2.6×10-39 | 4.9×10-17 | 5.9×10-15 | 1.6×10-44 | 7.2×10-15 |
(1)“中和氧化水解”时,先加入适量的石灰石调节溶液的pH为1.0;加入一定量的Na2S2O8;再加入石灰石调节溶液的pH为4.0。
①氧化”时,Mn2+转化为MnO2除去,反应的离子方程式为
②“沉渣”的主要成分除MnO2外还有
③“氧化”时若加入过量的Na2S2O8,钴元素将会进入“沉渣”中,则水解后溶液中含钴微粒的浓度为
(2)“除镉”时,主要反应的离子方程式为
(3)“沉锌”时,在近中性条件下加入Na2CO3可得碱式碳酸锌[ZnCO3·2Zn(OH)2·H2O]固体,同时产生大量的气体。产生大量气体的原因是
(4)不同质量分数的Na2SO4溶液在不同温度下析出Na2SO4晶体的物种如图所示。欲从含20%Na2SO4及微量杂质的“沉锌后液”中直接析出无水Na2SO4,“操作a”为

您最近一年使用:0次
名校
解题方法
8 . 以印刷线路板酸性蚀刻废液(含有CuCl2、FeCl2、FeCl3)为原料制备纳米CuO的流程如图:
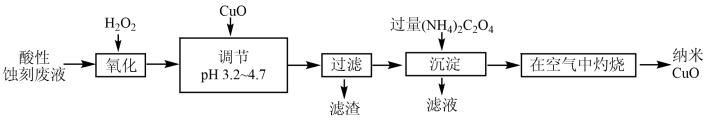
下列说法错误的是

下列说法错误的是
| A.“沉淀”产生的CuC2O4,不洗涤直接灼烧不影响产品质量 |
| B.“在空气中灼烧”时发生了非氧化还原反应 |
| C.调节pH为3.2~4.7的目的是使Fe3+完全沉淀,Cu2+不沉淀 |
| D.“沉淀”过程中用Na2C2O4代替(NH4)2C2O4,得到的CuC2O4中可能混有Cu(OH)2 |
您最近一年使用:0次
2022-06-01更新
|
727次组卷
|
6卷引用:湖南省长沙市明德中学2023届高三上学期入学检测化学试题
名校
9 . 已知Ksp(CaCO3)=2.8×10-9及表中有关信息:
下列判断正确的是
| 弱酸 | CH3COOH | H2CO3 |
| 电离平衡常数(常温) | Ka=1.8×10-5 | Ka1=4.3×10-7 Ka2=5.6×10-11 |
A.向Na2CO3溶液中滴入酚酞,溶液变红,主要原因是CO +2H2O +2H2O H2CO3+2OH- H2CO3+2OH- |
B.常温时,CH3COOH与CH3COONa混合溶液的pH=6,则 = = |
C.NaHCO3溶液中:c(OH-)-c(H+)=c(H2CO3)-c(CO ) ) |
| D.2×10-4mol·L-1的Na2CO3溶液与CaCl2溶液等体积混合出现沉淀,则CaCl2溶液的浓度一定是5.6×10-5mol·L-1 |
您最近一年使用:0次
2022-04-05更新
|
104次组卷
|
2卷引用:湖南省益阳市箴言中学2021-2022学年高二下学期入学考试化学检测题
10 . 常温时,若Ca(OH)2和CaWO4(钨酸钙)的沉淀溶解平衡曲线如图所示(已知 =0.29)。下列分析正确的是
=0.29)。下列分析正确的是
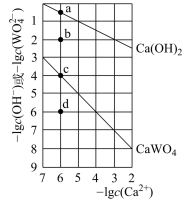
 =0.29)。下列分析正确的是
=0.29)。下列分析正确的是
| A.由图可知常温下Ksp(CaWO4)<Ksp[Ca(OH)2] |
| B.室温下饱和Ca(OH)2溶液中加入少量CaO,溶液变浑浊,恢复至室温,Ca(OH)2的Ksp不变,钙离子浓度不变 |
C.饱和Ca(OH)2溶液和饱和CaWO4溶液等体积混合:c(WO )<c(Ca2+)<c(H+)<c(OH—) )<c(Ca2+)<c(H+)<c(OH—) |
| D.d点的CaWO4溶液中,加入CaCl2固体,d点溶液组成沿da线向c点移动(假设混合后溶液体积不变) |
您最近一年使用:0次
2022-03-17更新
|
175次组卷
|
2卷引用:湖南省常德市临澧县第一中学2021-2022学年高三下学期开学考试化学试题



