解题方法
1 . 沉淀的转化在生产中具有重要的应用价值。为了除去水垢中的 ,可先用
,可先用 溶液处理,使
溶液处理,使 转化为疏松、易溶于酸的
转化为疏松、易溶于酸的 ,下列说法正确的是
,下列说法正确的是
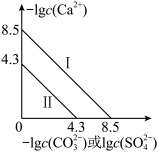
已知: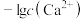 与
与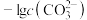 或
或 的关系如图所示,且
的关系如图所示,且 。
。
 ,可先用
,可先用 溶液处理,使
溶液处理,使 转化为疏松、易溶于酸的
转化为疏松、易溶于酸的 ,下列说法正确的是
,下列说法正确的是已知:
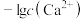 与
与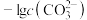 或
或 的关系如图所示,且
的关系如图所示,且 。
。
A. 中 中 的杂化轨道类型是 的杂化轨道类型是 |
B.反应 的平衡常数 的平衡常数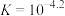 |
C. 中存在的化学键为 中存在的化学键为 键、 键、 键和范德华力 键和范德华力 |
D. 的 的 溶液中,一定存在 溶液中,一定存在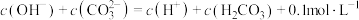 |
您最近一年使用:0次
解题方法
2 . 氧化钪( )在合金、电光源、催化剂和陶瓷等领域有广泛应用,以链锰矿石(含
)在合金、电光源、催化剂和陶瓷等领域有广泛应用,以链锰矿石(含 )为原料制备氧化钪的一种工艺流程如图所示。
)为原料制备氧化钪的一种工艺流程如图所示。 ;③草酸可与多种金属离子形成可溶性络合物。
;③草酸可与多种金属离子形成可溶性络合物。
回答下列问题:
(1)为了提高“浸取”效果,可采取的措施有___________ (写出一种)。
(2)“浸取”时铁屑被 氧化为
氧化为 ,该反应的离子方程式是
,该反应的离子方程式是___________ 。
(3)“萃取除铁”时铁和钪的萃取率与O/A(有机相与水相的体积比)的关系如图所示。该工艺中最佳O/A为___________ 。___________ 。
(5)常温下,“沉淀分离”时加入NaOH溶液调节pH至6,滤液中 的浓度为
的浓度为___________ 。
(6)已知 ,
,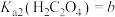 ,
,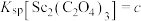 。“沉钪”时,发生反应
。“沉钪”时,发生反应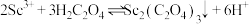 ,此反应的平衡常数
,此反应的平衡常数
___________ (用含a、b、c的代数式表示)。反应过程中,草酸用量过多时,航的沉淀率下降,原因可能是___________ 。
(7)草酸钪晶体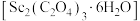 在空气中加热,
在空气中加热, 随温度的变化情况如图所示。550-850 ℃发生反应的化学方程式为
随温度的变化情况如图所示。550-850 ℃发生反应的化学方程式为___________ 。
 )在合金、电光源、催化剂和陶瓷等领域有广泛应用,以链锰矿石(含
)在合金、电光源、催化剂和陶瓷等领域有广泛应用,以链锰矿石(含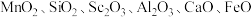 )为原料制备氧化钪的一种工艺流程如图所示。
)为原料制备氧化钪的一种工艺流程如图所示。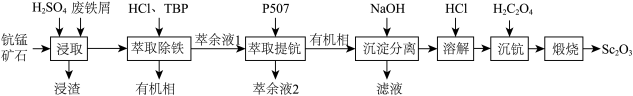
 ;③草酸可与多种金属离子形成可溶性络合物。
;③草酸可与多种金属离子形成可溶性络合物。回答下列问题:
(1)为了提高“浸取”效果,可采取的措施有
(2)“浸取”时铁屑被
 氧化为
氧化为 ,该反应的离子方程式是
,该反应的离子方程式是(3)“萃取除铁”时铁和钪的萃取率与O/A(有机相与水相的体积比)的关系如图所示。该工艺中最佳O/A为

(5)常温下,“沉淀分离”时加入NaOH溶液调节pH至6,滤液中
 的浓度为
的浓度为(6)已知
 ,
,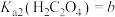 ,
,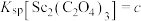 。“沉钪”时,发生反应
。“沉钪”时,发生反应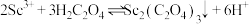 ,此反应的平衡常数
,此反应的平衡常数
(7)草酸钪晶体
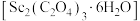 在空气中加热,
在空气中加热, 随温度的变化情况如图所示。550-850 ℃发生反应的化学方程式为
随温度的变化情况如图所示。550-850 ℃发生反应的化学方程式为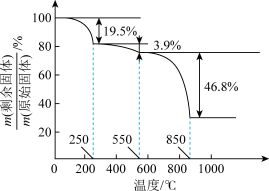
您最近一年使用:0次
名校
解题方法
3 . 某工厂采用如下工艺处理镍钴矿硫酸浸取液(含 和
和 ),实现镍、钴、镁元素的回收。
),实现镍、钴、镁元素的回收。

回答下列问题:
(1)工业上用一定浓度的硫酸浸取己粉碎的镍钴矿,提高浸取速率的方法为___________ (答出一条即可)。
(2)“氧化”时,混合气在金属离子的催化作用下产生具有强氧化性的过一硫酸(H2SO5),其中S元素的化合价为___________ 。
(3)已知: 的电离方程式为
的电离方程式为 、
、
①氧化时,先通入足量混合气,溶液中的正二价铁元素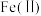 被
被 氧化为
氧化为 ,该反应的离子方程式为
,该反应的离子方程式为___________ ;再加入石灰乳,所得滤渣中主要成分是 、
、___________ 。
②通入混合气中 的体积分数与
的体积分数与 氧化率随时间的变化关系如图所示,若混合气中不添加
氧化率随时间的变化关系如图所示,若混合气中不添加 ,相同时间内
,相同时间内 氧化率较低的原因是
氧化率较低的原因是___________ ; 的体积分数高于9.0%时,相同时间内
的体积分数高于9.0%时,相同时间内 氧化率开始降低的原因是
氧化率开始降低的原因是___________ 。

(4)①将“钴镍渣”酸溶后,先加入 溶液进行“钴镍分离”,写出“钴镍分离”反应生成
溶液进行“钴镍分离”,写出“钴镍分离”反应生成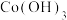 沉淀的离子方程式:
沉淀的离子方程式:___________ 。
②若“镍钴分离”后溶液中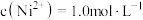 ,加入
,加入 溶液“沉镍”后的滤液中
溶液“沉镍”后的滤液中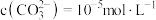 ,则沉镍率=
,则沉镍率=___________ 。[已知: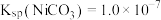 ,沉镍率
,沉镍率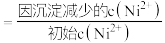 ]
]
 和
和 ),实现镍、钴、镁元素的回收。
),实现镍、钴、镁元素的回收。
回答下列问题:
(1)工业上用一定浓度的硫酸浸取己粉碎的镍钴矿,提高浸取速率的方法为
(2)“氧化”时,混合气在金属离子的催化作用下产生具有强氧化性的过一硫酸(H2SO5),其中S元素的化合价为
(3)已知:
 的电离方程式为
的电离方程式为 、
、
①氧化时,先通入足量混合气,溶液中的正二价铁元素
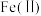 被
被 氧化为
氧化为 ,该反应的离子方程式为
,该反应的离子方程式为 、
、②通入混合气中
 的体积分数与
的体积分数与 氧化率随时间的变化关系如图所示,若混合气中不添加
氧化率随时间的变化关系如图所示,若混合气中不添加 ,相同时间内
,相同时间内 氧化率较低的原因是
氧化率较低的原因是 的体积分数高于9.0%时,相同时间内
的体积分数高于9.0%时,相同时间内 氧化率开始降低的原因是
氧化率开始降低的原因是
(4)①将“钴镍渣”酸溶后,先加入
 溶液进行“钴镍分离”,写出“钴镍分离”反应生成
溶液进行“钴镍分离”,写出“钴镍分离”反应生成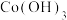 沉淀的离子方程式:
沉淀的离子方程式:②若“镍钴分离”后溶液中
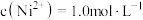 ,加入
,加入 溶液“沉镍”后的滤液中
溶液“沉镍”后的滤液中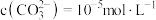 ,则沉镍率=
,则沉镍率=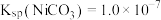 ,沉镍率
,沉镍率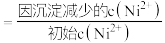 ]
]
您最近一年使用:0次
名校
解题方法
4 . 从宏观现象探究微观本质是重要的化学学科素养。为研究FeCl3溶液的性质,某小组同学进行了如下探究实验。
Ⅰ.配制FeCl3溶液
(1)先将FeCl3固体溶于浓盐酸,再稀释至指定浓度。浓盐酸的作用是______ 。
Ⅱ.FeCl3溶液与Na2CO3溶液反应
(2)向2mL1mol/L的Na2CO3溶液中加入2mL1mol/LFeCl3溶液,产生了红褐色沉淀和无色气体。反应的离子方程式为______ 。
Ⅲ.FeCl3溶液与Na2S溶液反应
(3)甲同学认为Fe3+和S2-的水解平衡相互促进并完全水解,实验中会观察到红褐色沉淀并闻到臭鸡蛋气味;乙同学认为会发生氧化还原反应,并预测还原产物为______ (填化学式)。两位同学实验如下:
(4)两位同学猜测实验a中的黑色沉淀可能是Fe2S3。继续实验:
根据实验b说明黑色沉淀是Fe2S3,写出实验b中Fe2S3与盐酸反应的化学方程式:______ 。
(5)①实验a中生成黑色沉淀Fe2S3的离子方程式为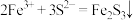 。该反应类型从四种基本反应类型看属于
。该反应类型从四种基本反应类型看属于______ 。
②实验a中Fe2S3溶解时生成的黄色固体为______ ,乙同学推测是因为随着FeCl3溶液滴加至一定量, 浓度增大,其氧化性增强,将Fe2S3氧化所致。
浓度增大,其氧化性增强,将Fe2S3氧化所致。
(6)已知: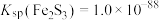 ,
,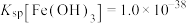 。针对实验a过程中未观察到红褐色沉淀,甲同学认为可能是产生的量比较少,被黑色所遮盖。乙同学根据
。针对实验a过程中未观察到红褐色沉淀,甲同学认为可能是产生的量比较少,被黑色所遮盖。乙同学根据 数据计算认为就算产生红褐色沉淀,也会转化为黑色沉淀,写出该转化过程的离子方程式:
数据计算认为就算产生红褐色沉淀,也会转化为黑色沉淀,写出该转化过程的离子方程式:______ 。
Ⅰ.配制FeCl3溶液
(1)先将FeCl3固体溶于浓盐酸,再稀释至指定浓度。浓盐酸的作用是
Ⅱ.FeCl3溶液与Na2CO3溶液反应
(2)向2mL1mol/L的Na2CO3溶液中加入2mL1mol/LFeCl3溶液,产生了红褐色沉淀和无色气体。反应的离子方程式为
Ⅲ.FeCl3溶液与Na2S溶液反应
(3)甲同学认为Fe3+和S2-的水解平衡相互促进并完全水解,实验中会观察到红褐色沉淀并闻到臭鸡蛋气味;乙同学认为会发生氧化还原反应,并预测还原产物为
| 实验a | 向稀Na2S溶液中逐滴加入FeCl3稀溶液,直至过量 |
| 实验现象 | 立即产生黑色沉淀并逐渐增加,无臭鸡蛋气味;FeCl3溶液过量后,黑色沉淀部分溶解,出现黄色沉淀 |
| 实验b | 将实验a中黑色沉淀过滤,并用CS2处理后洗净。向沉淀中加入6mol/L的盐酸,振荡试管 |
| 实验现象 | 加入盐酸后黑色沉淀溶解,转为乳黄色沉淀,并伴有臭鸡蛋气味 |
(5)①实验a中生成黑色沉淀Fe2S3的离子方程式为
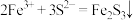 。该反应类型从四种基本反应类型看属于
。该反应类型从四种基本反应类型看属于②实验a中Fe2S3溶解时生成的黄色固体为
 浓度增大,其氧化性增强,将Fe2S3氧化所致。
浓度增大,其氧化性增强,将Fe2S3氧化所致。(6)已知:
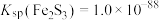 ,
,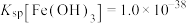 。针对实验a过程中未观察到红褐色沉淀,甲同学认为可能是产生的量比较少,被黑色所遮盖。乙同学根据
。针对实验a过程中未观察到红褐色沉淀,甲同学认为可能是产生的量比较少,被黑色所遮盖。乙同学根据 数据计算认为就算产生红褐色沉淀,也会转化为黑色沉淀,写出该转化过程的离子方程式:
数据计算认为就算产生红褐色沉淀,也会转化为黑色沉淀,写出该转化过程的离子方程式:
您最近一年使用:0次
5 . 某“变废为宝”学生探究小组设计如下工艺流程,对废锌(含铁和铜的氧化物杂质)和除氯后的卤水(含碘离子)联合应用,最终制得胆矾、 、碘等。
、碘等。
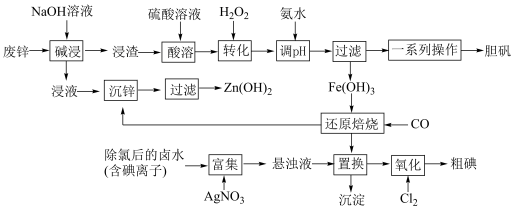
已知:①锌元素与铝元素的性质类似,例如氧化锌也能溶于强碱{生成 }。
}。
②本工艺条件下,相关金属离子形成氢氧化物沉淀的pH范围如下:
③还原性: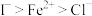
回答下列问题:
(1)“碱浸”中发生反应的化学方程式为____________________ 。
(2)“转化”中,加入足量H2O2的目的是____________________ 。
(3)“调pH”时需控制该溶液的pH范围为______ 之间。“调pH”之后,需要加热煮沸10 min,冷却后再“过滤”。煮沸10 min的作用是____________________ 。
(4)“还原焙烧”的气体产物可循环利用到“沉锌”中。若该气体不足,“沉锌”中发生反应的离子方程式为____________________ 。
(5)“氧化”过程中若反应物用量比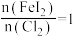 时,氧化产物为
时,氧化产物为______ (填化学式)
 、碘等。
、碘等。
已知:①锌元素与铝元素的性质类似,例如氧化锌也能溶于强碱{生成
 }。
}。②本工艺条件下,相关金属离子形成氢氧化物沉淀的pH范围如下:
金属离子 |
|
|
|
|
开始沉淀的pH | 6.2 | 6.3 | 1.5 | 4.7 |
沉淀完全的pH | 8.2 | 8.3 | 2.8 | 6.8 |
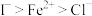
回答下列问题:
(1)“碱浸”中发生反应的化学方程式为
(2)“转化”中,加入足量H2O2的目的是
(3)“调pH”时需控制该溶液的pH范围为
(4)“还原焙烧”的气体产物可循环利用到“沉锌”中。若该气体不足,“沉锌”中发生反应的离子方程式为
(5)“氧化”过程中若反应物用量比
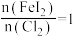 时,氧化产物为
时,氧化产物为
您最近一年使用:0次
名校
解题方法
6 . 能正确表示下列反应的离子方程式为
A.用碳酸钠溶液处理水垢中的硫酸钙: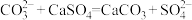 |
B. 溶液中能入少量的 溶液中能入少量的 : :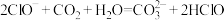 |
C.明矾净水原理: |
D.氯化铜溶液中通入硫化氢: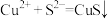 |
您最近一年使用:0次
7 . 由下列实验操作及现象能得出相应结论的是
| 实验操作 | 现象 | 结论 | |
| A | 用相同浓度的NaOH溶液分别滴定等体积等pH的HA和HB溶液 | HA溶液消耗NaOH溶液体积多 | HA酸性强于HB |
| B | 向盛有少量水的试管中滴加2滴K3[Fe(CN)6]溶液,然后滴加2滴KSCN溶液 | 溶液未变红 | CN-的配位能力强于SCN- |
| C | 向浓度均为0.1mol•L-1的NaCl和NaI的混合溶液中滴加少量AgNO3溶液 | 产生黄色沉淀 | Ksp(AgCl)<Ksp(AgI) |
| D | 常温下,向0.1mol•L﹣1NaHCO3溶液中滴加酚酞 | 溶液变红 |  >Ka2 >Ka2 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
2024-03-13更新
|
50次组卷
|
2卷引用:湖南省岳阳市岳阳县第一中学2023-2024学年高二下学期开学化学试题
名校
8 . 锌及锌合金(如黄铜)广泛应用于生产、生活。某小组拟以锌矿(主要成分是ZnS,含少量FeS等杂质)为原料采用多种方法冶炼锌,流程如图。回答下列问题:

已知:① 是两性氢氧化物,易溶于NaOH溶液,也溶于氨水,能发生反应:
是两性氢氧化物,易溶于NaOH溶液,也溶于氨水,能发生反应: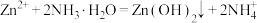 、
、
②常温下,几种金属离子转化成氢氧化物沉淀的pH如表:
(1)已知 中
中 采用
采用 杂化,则
杂化,则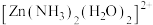 有
有___________ 种结构。
(2)明代宋应星著的《天工开物》中有关“升炼倭铅”的记载:“每炉甘石十斤,装载入一泥罐内,封裹泥固,……然后,逐层用煤炭饼垫盛,其底铺薪,发火煅红……冷定,毁罐取出。……即倭铅也。”(炉甘石主要成分是 ,倭铅即指Zn)古代炼锌方法类似于上述三种方法中的
,倭铅即指Zn)古代炼锌方法类似于上述三种方法中的___________ (填标号,下同)。从环保的角度来看,这三种方法中,最佳方法是___________ 。
a.半湿法 b.火法 c.全湿法
(3)“氧压酸浸”是在稀硫酸中加入锌矿粉,并在加压下通入 ,除生成
,除生成 外,还能回收非金属单质。ZnS参与反应的离子方程式为
外,还能回收非金属单质。ZnS参与反应的离子方程式为___________ 。
(4)“氧化,调pH”时试剂A不宜选择NaOH溶液,也不宜选择氨水,原因是___________ 。
(5)“电解沉积”(以惰性材料为电极)时阳极的电极反应式为___________ 。航母外壳常镶嵌一些锌块,这种保护航母的方法叫___________ 。
(6)通常认为离子浓度 时表示该离子已完全除尽。根据表格数据计算
时表示该离子已完全除尽。根据表格数据计算
___________ 。

已知:①
 是两性氢氧化物,易溶于NaOH溶液,也溶于氨水,能发生反应:
是两性氢氧化物,易溶于NaOH溶液,也溶于氨水,能发生反应: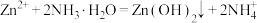 、
、
②常温下,几种金属离子转化成氢氧化物沉淀的pH如表:
| 金属离子 | 开始沉淀的pH | 完全沉淀的pH |
 | 6.5 | 9.7 |
 | 5.4 | 8.0 |
 | 2.3 | 4.1 |
 中
中 采用
采用 杂化,则
杂化,则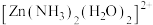 有
有(2)明代宋应星著的《天工开物》中有关“升炼倭铅”的记载:“每炉甘石十斤,装载入一泥罐内,封裹泥固,……然后,逐层用煤炭饼垫盛,其底铺薪,发火煅红……冷定,毁罐取出。……即倭铅也。”(炉甘石主要成分是
 ,倭铅即指Zn)古代炼锌方法类似于上述三种方法中的
,倭铅即指Zn)古代炼锌方法类似于上述三种方法中的a.半湿法 b.火法 c.全湿法
(3)“氧压酸浸”是在稀硫酸中加入锌矿粉,并在加压下通入
 ,除生成
,除生成 外,还能回收非金属单质。ZnS参与反应的离子方程式为
外,还能回收非金属单质。ZnS参与反应的离子方程式为(4)“氧化,调pH”时试剂A不宜选择NaOH溶液,也不宜选择氨水,原因是
(5)“电解沉积”(以惰性材料为电极)时阳极的电极反应式为
(6)通常认为离子浓度
 时表示该离子已完全除尽。根据表格数据计算
时表示该离子已完全除尽。根据表格数据计算
您最近一年使用:0次
名校
9 . 碳酸锶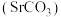 主要用于制造磁性材料、电子元件等。利用锶渣(主要成分
主要用于制造磁性材料、电子元件等。利用锶渣(主要成分 ,含少量
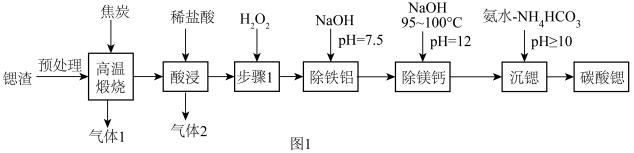
,含少量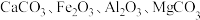 杂质),工业上制备超细碳酸锶的工艺如图1所示:
杂质),工业上制备超细碳酸锶的工艺如图1所示:
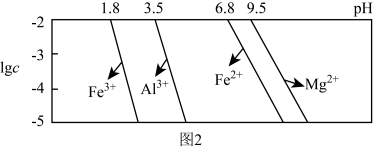
已知:①室温下,溶液中金属离子物质的量浓度 与溶液pH的关系如图2所示:
与溶液pH的关系如图2所示:
② 在不同温度下的溶解度如下表:
在不同温度下的溶解度如下表:
回答下列问题:
(1)“高温煅烧”得到的主要产物为锶的硫化物和一种可燃性气体。则“高温煅烧”的主要反应化学方程式为____________ 。
(2)“步骤1”的目的是____________ 。
(3)“除铁铝”后溶液温度降至室温,溶液中 为
为______  。
。
(4)“除镁钙”过程温度控制在95~100℃的目的是_____________________________________________ 。
(5)“沉锶”的离子反应方程式为_________________________ 。
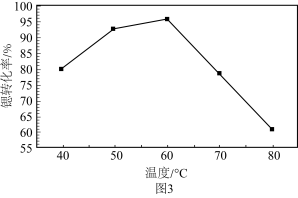
(6)“沉锶”过程中反应温度对锶转化率的影响如图3所示,温度高于60℃时,锶转化率降低的原因为_____________________________________
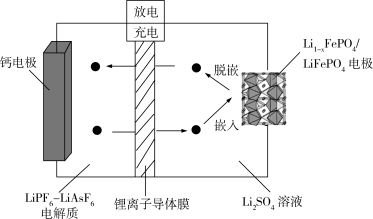
(7)如图为 可充放电电池的工作原理示意图,锂离子导体膜只允许
可充放电电池的工作原理示意图,锂离子导体膜只允许 通过,充电时,钙电极为
通过,充电时,钙电极为______ (“阳极”或“阴极”),放电时,正极上发生 的嵌入的电极反应是
的嵌入的电极反应是______ 。
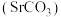 主要用于制造磁性材料、电子元件等。利用锶渣(主要成分
主要用于制造磁性材料、电子元件等。利用锶渣(主要成分 ,含少量
,含少量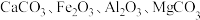 杂质),工业上制备超细碳酸锶的工艺如图1所示:
杂质),工业上制备超细碳酸锶的工艺如图1所示:
已知:①室温下,溶液中金属离子物质的量浓度
 与溶液pH的关系如图2所示:
与溶液pH的关系如图2所示:
②
 在不同温度下的溶解度如下表:
在不同温度下的溶解度如下表:| 温度/℃ | 0 | 20 | 40 | 60 | 80 | 90 | 100 |
 | 0.19 | 0.17 | 0.14 | 0.12 | 0.09 | 0.08 | 0.07 |
 | 0.91 | 1.77 | 3.95 | 8.42 | 20.20 | 44.50 | 91.20 |
(1)“高温煅烧”得到的主要产物为锶的硫化物和一种可燃性气体。则“高温煅烧”的主要反应化学方程式为
(2)“步骤1”的目的是
(3)“除铁铝”后溶液温度降至室温,溶液中
 为
为 。
。(4)“除镁钙”过程温度控制在95~100℃的目的是
(5)“沉锶”的离子反应方程式为
(6)“沉锶”过程中反应温度对锶转化率的影响如图3所示,温度高于60℃时,锶转化率降低的原因为

(7)如图为
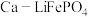 可充放电电池的工作原理示意图,锂离子导体膜只允许
可充放电电池的工作原理示意图,锂离子导体膜只允许 通过,充电时,钙电极为
通过,充电时,钙电极为 的嵌入的电极反应是
的嵌入的电极反应是
您最近一年使用:0次
名校
解题方法
10 . 根据下列实验操作和现象能得出相应实验结论的是
| 选项 | 实验操作和现象 | 实验结论 |
| A | 往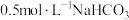 溶液中加入盐酸,将产生的气体通入 溶液中加入盐酸,将产生的气体通入 溶液中, 溶液中, 溶液中有沉淀生成 溶液中有沉淀生成 | 非金属性: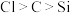 |
| B | 向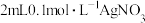 溶液中先滴加4滴 溶液中先滴加4滴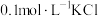 溶液,再滴加4滴 溶液,再滴加4滴 溶液,先产生白色沉淀,再产生黄色沉淀 溶液,先产生白色沉淀,再产生黄色沉淀 |  |
| C | 以 为电极,以酸化的 为电极,以酸化的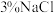 溶液作电解质溶液,用导线连接形成闭合回路。一段时间后,取 溶液作电解质溶液,用导线连接形成闭合回路。一段时间后,取 电极区域少量溶液于试管中,滴入2滴 电极区域少量溶液于试管中,滴入2滴 溶液,未出现蓝色沉淀 溶液,未出现蓝色沉淀 | 牺牲阳极法保护金属 |
| D | 用 试纸分别测定饱和的 试纸分别测定饱和的 溶液和 溶液和 溶液, 溶液, 依次为9和8 依次为9和8 |  电离出 电离出 的能力比 的能力比 的强 的强 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次




