名校
解题方法
1 . 电位滴定法是靠电极电位的突跃来指示滴定终点。在滴定过程中,计算机对数据自动采集、处理,并利用滴定反应化学计量点前后电位突变的特性,自动寻找滴定终点。室温时,用 的
的 标准溶液滴定同浓度的
标准溶液滴定同浓度的 溶液,计算机呈现的滴定曲线如图所示(稀溶液中不考虑氨水的分解导致氨的逸出)。下列说法错误的是
溶液,计算机呈现的滴定曲线如图所示(稀溶液中不考虑氨水的分解导致氨的逸出)。下列说法错误的是

 的
的 标准溶液滴定同浓度的
标准溶液滴定同浓度的 溶液,计算机呈现的滴定曲线如图所示(稀溶液中不考虑氨水的分解导致氨的逸出)。下列说法错误的是
溶液,计算机呈现的滴定曲线如图所示(稀溶液中不考虑氨水的分解导致氨的逸出)。下列说法错误的是
A.滴定过程中,溶液中 逐渐减小 逐渐减小 |
B.a点溶液中: |
C.b点溶液中: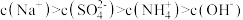 |
| D.a、b点水的电离程度:a>b |
您最近一年使用:0次
2023-02-01更新
|
784次组卷
|
4卷引用:江西省抚州市乐安县第二中学2023届高三一模化学试题
名校
解题方法
2 . 一定温度下,水溶液中 和
和 的浓度变化曲线如下图所示,下列说法不正确的是
的浓度变化曲线如下图所示,下列说法不正确的是
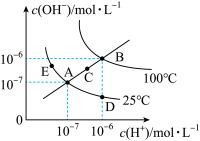
 和
和 的浓度变化曲线如下图所示,下列说法不正确的是
的浓度变化曲线如下图所示,下列说法不正确的是
A.图中五点对应的 间的关系: 间的关系: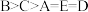 |
B.从A点到E点,可采用在水中加入少量NaOH或 的方法 的方法 |
C.从A点到D点,所得D点溶液中水电离产生的 浓度不可能为 浓度不可能为 |
D.在B点温度下,将 的硫酸溶液与 的硫酸溶液与 的KOH溶液混合(忽略混合后溶液体积的变化)后溶液 的KOH溶液混合(忽略混合后溶液体积的变化)后溶液 ,则硫酸溶液与KOH溶液的体积比为9:11 ,则硫酸溶液与KOH溶液的体积比为9:11 |
您最近一年使用:0次
2023-01-14更新
|
715次组卷
|
3卷引用:江西省宜春市宜丰中学2023-2024学年高二上学期11月期中考试化学试题
江西省宜春市宜丰中学2023-2024学年高二上学期11月期中考试化学试题山东省济南市章丘区第四中学2022-2023学年高二上学期期末考试(线上)化学试题 (已下线)专题06 电离平衡 水的电离和溶液的pH-【好题汇编】备战2023-2024学年高二化学上学期期末真题分类汇编(人教版2019)
名校
3 . 已知常温时HClO的Ka=3.0×10-8,HF的Ka=3.5×10-4,现将pH和体积都相同的次氯酸和氢氟酸溶液分别加蒸馏水稀释,pH随溶液体积的变化如图所示,下列叙述正确的是
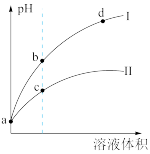

| A.曲线Ⅱ为氢氟酸稀释时pH变化曲线 |
| B.取a点的两种酸溶液,中和相同体积、相同浓度的NaOH溶液,消耗氢氟酸的体积较小 |
| C.b点溶液中水的电离程度比c点溶液中水的电离程度小 |
D.从b点到d点,溶液中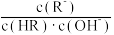 保持不变(HR代表HClO或HF) 保持不变(HR代表HClO或HF) |
您最近一年使用:0次
2022-09-28更新
|
1288次组卷
|
8卷引用:江西省赣州市十校协作2022-2023学年高二上学期期中联考化学试题
江西省赣州市十校协作2022-2023学年高二上学期期中联考化学试题江西省永修县第一中学2023-2024学年高二上学期10月月考化学试题江西省南昌市第一中学2023-2024学年高二上学期10月月考化学试题(已下线)第21讲 电离平衡(练)-2023年高考化学一轮复习讲练测(新教材新高考)(已下线)专项特训5 弱电解质电离常数计算与图像分析江苏省常熟市王淦昌高级中学2022-2023学年高二3月月考化学试题第1讲 弱电解质的电离平衡四川省宜宾市叙州区第二中学校2023-2024学年高二上学期12月月考化学试题
名校
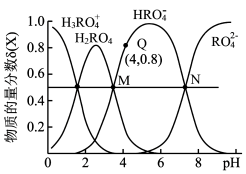
4 . K2RO4是一种优良的水处理剂。25℃,其水溶液中加酸或者加碱改变溶液的pH时,含R粒子的物质的量分数δ(X)[δ(X)=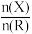 ]随pH的变化如图所示。下列说法正确的是
]随pH的变化如图所示。下列说法正确的是
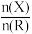 ]随pH的变化如图所示。下列说法正确的是
]随pH的变化如图所示。下列说法正确的是
A.RO 中R为+6价,pH<6时溶液中不存在RO 中R为+6价,pH<6时溶液中不存在RO |
| B.H2RO4的第一步电离平衡常数Ka1=4.0×10-4 |
C.溶液中存在:c(H+)+c(H2RO )=c(OH-)+c(HRO )=c(OH-)+c(HRO )+2c(RO )+2c(RO ) ) |
| D.水的电离程度:M>N |
您最近一年使用:0次
名校
5 . 室温下,用0.1mol/L的NaOH溶液滴定20.00mL0.10mol/LHR溶液(滴定曲线如图所示),下列说法错误的是(已知:电离度 )
)

 )
)
A. |
| B.室温下,HR的电离度为1% |
C.d点溶液中,部分粒子之间的关系为 |
D.a、b、c、d四点溶液中,水的电离度由大到小的顺序为 |
您最近一年使用:0次
2022-05-29更新
|
170次组卷
|
4卷引用:江西省宜春市宜春一中、万载中学、宜丰中学联考2022-2023学年高二下学期7月期末化学试题
解题方法
6 . 25℃时,在体积均为100 mL、浓度均为0.1 mol·L-1的两种一元酸HA和HB的溶液中,分别加入NaOH固体(温度恢复至室温,溶液体积变化忽略不计), 随加入NaOH固体的物质的量的变化如图所示。下列有关说法不正确的是
随加入NaOH固体的物质的量的变化如图所示。下列有关说法不正确的是

 随加入NaOH固体的物质的量的变化如图所示。下列有关说法不正确的是
随加入NaOH固体的物质的量的变化如图所示。下列有关说法不正确的是
| A.酸性:HA> HB,且HA是强酸,HB是弱酸 |
| B.由水电离出的c(H+ )的顺序:a<b<c<d |
| C.c点溶液中:c(H+)=c(B-)-c(HB) +c(OH-) |
| D.d点溶液中:c(B-)=c(Na+)>c(H+)=c(OH-) |
您最近一年使用:0次
7 . 常温下,分别向20.00mL浓度均为0.1000mol·L-1的HX和HY溶液滴入0.1000mol·L-1NaOH标准溶液,滴定曲线如图所示(已知:酸性HX>HY,1g5=0.7)。下列说法正确的是


| A.曲线Ⅱ对应的酸为HY,HX是强酸 |
| B.在B1和B2点对应的溶液中存在关系:c(HY)-c(HX)=c(X-)-c(Y-) |
| C.pH=7时,两溶液中由水电离出的c(H+)大小关系为:c(H+)I>c(H+)II |
| D.C1点纵坐标数值为8.7 |
您最近一年使用:0次
2022-04-24更新
|
915次组卷
|
4卷引用:江西省新余市分宜中学2023届高三一模考试化学试题
江西省新余市分宜中学2023届高三一模考试化学试题广西壮族自治区南宁市2022届高三第二次适应性测试理综化学试题湖南省株洲市醴陵市第一中学2021-2022学年高三下学期期中考试化学试题(已下线)第一部分 二轮专题突破 题型专攻4 电解质溶液各类图像的分析
8 . 常温下,向500mL一定物质的量浓度KAl(SO4)2溶液中逐滴加入0.1mol·L-1Ba(OH)2溶液,加入Ba(OH)2溶液的体积和所得沉淀的质量关系如图,(忽略混合时溶液体积的变化),已知:Ksp(BaSO4)=1.1×10-10。下列说法正确的是


A.ab段发生离子反应有:SO +Ba2+=BaSO4↓、Al3++3OH-=Al(OH)3↓ +Ba2+=BaSO4↓、Al3++3OH-=Al(OH)3↓ |
| B.a点、b点、c点三点所对应的溶液的水的电离程度:a>b>c |
C.若V2=1;V3=1.5时,c点溶液中c(SO )=4.4×10-9mol·L-1 )=4.4×10-9mol·L-1 |
| D.若V2=1时,m2=27.2 |
您最近一年使用:0次
9 . 常温下,向20mL1mol·L-1CuCl2溶液中滴加2mol·L-1Na2S溶液的滴定曲线如图所示。已知:pCu=-lgc(Cu2+),lg2.5=0.4,常温下Ksp(FeS)=6.3×10-18;Kal(H2S)=1.2×10-7,Ka2(H2S)=7.1×10-15。下列说法中正确的是
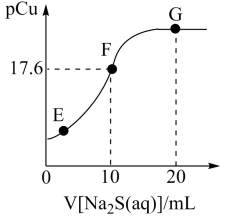

| A.常温下,S2-的水解常数Kh(S2-)约为8.3×10-8 |
| B.E→F→G的过程中,水的电离度一直在减小 |
| C.向1mol·L-1FeSO4(aq)中加入足量CuS固体,产生FeS沉淀 |
| D.25℃时,Cu2++H2S=CuS↓+2H+的K约为1.36×1014 |
您最近一年使用:0次
名校
解题方法
10 . 常温下,向1L1.0mol·L-1的NaClO溶液中缓慢通入SO2气体,使其充分吸收,溶液pH与通入SO2的物质的量关系如图所示(忽略溶液体积的变化和NaClO、HClO的分解)。下列说法错误的是
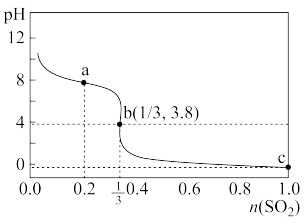

| A.常温下,HClO电离平衡常数的数量级为10—8 |
| B.水的电离程度:a>b>c |
C.b点溶液中:c(Cl—)+c(SO )=c(ClO—)+c(HClO) )=c(ClO—)+c(HClO) |
D.c点溶液中:c(Cl—)+c(ClO—)+2c(SO )+c(OH—)=c(H+)+c(Na+) )+c(OH—)=c(H+)+c(Na+) |
您最近一年使用:0次
2022-01-23更新
|
449次组卷
|
4卷引用:江西省新余市第一中学2023-2024学年高三上学期开学考试化学试题
江西省新余市第一中学2023-2024学年高三上学期开学考试化学试题(已下线)广东省华师附中、实验中学、深圳中学、广雅中学四校2021-2022学年高三上学期期末联考化学试题广东省深圳市第七高级中学2021-2022学年高三第七次月考化学试题湖南省株洲市第四中学2022-2023学年高三上学期第四次月考化学试题



