解题方法
1 . 富马酸亚铁[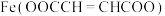 ,
,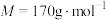 ]是一种治疗贫血的药物。实验制备富马酸亚铁并测定其纯度。
]是一种治疗贫血的药物。实验制备富马酸亚铁并测定其纯度。
Ⅰ.制备富马酸亚铁
步骤1:将4.64g富马酸(HOOCCH=CHCOOH)固体置于100mL烧杯中,加水20mL,在加热搅拌下加入 溶液10mL,使其pH为6.5~6.7,
溶液10mL,使其pH为6.5~6.7,
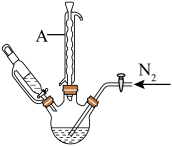
步骤2:将上述溶液转移至如图所示装置中(省略加热、搅拌和夹持装置),通 并加热一段时间后,缓慢滴加40mL
并加热一段时间后,缓慢滴加40mL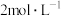 的
的 溶液,维持温度100℃,搅拌充分反应1.5h;
溶液,维持温度100℃,搅拌充分反应1.5h;
步骤3:将反应混合液冷却后,通过一系列操作,得到粗产品3.06g。
Ⅱ.纯度分析
取mg样品配制成100mL溶液,取25mL置于250mL锥形瓶中,加入煮沸过的 硫酸溶液15.00mL,待样品完全溶解后,加入煮沸过的蒸馏水50.00mL和2滴邻二氮菲指示剂(邻二氮菲遇
硫酸溶液15.00mL,待样品完全溶解后,加入煮沸过的蒸馏水50.00mL和2滴邻二氮菲指示剂(邻二氮菲遇 呈红色,遇
呈红色,遇 呈无色);立即用
呈无色);立即用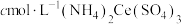 标准溶液滴定至终点(反应的离子方程式为
标准溶液滴定至终点(反应的离子方程式为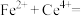
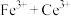 )。平行测定三次,消耗标准溶液的平均体积为VmL。
)。平行测定三次,消耗标准溶液的平均体积为VmL。
(1)仪器A的名称是______ 。
(2)“步骤1”中发生反应的方程式为______ ,pH调节不能过高,其原因是______ 。
(3)“步骤2”中持续通入 的目的是
的目的是______ 。
(4)“步骤3”一系列操作是指减压过滤,______ ,干燥等过程。证明富马酸亚铁产品已洗涤干净的实验操作及现象是______ 。
(5)纯度分析实验中判断达到滴定终点的现象是______ 。
(6)测得产品的纯度为______ 。(用含m、c、V的代数式表示)
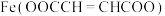 ,
,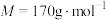 ]是一种治疗贫血的药物。实验制备富马酸亚铁并测定其纯度。
]是一种治疗贫血的药物。实验制备富马酸亚铁并测定其纯度。Ⅰ.制备富马酸亚铁
步骤1:将4.64g富马酸(HOOCCH=CHCOOH)固体置于100mL烧杯中,加水20mL,在加热搅拌下加入
 溶液10mL,使其pH为6.5~6.7,
溶液10mL,使其pH为6.5~6.7,步骤2:将上述溶液转移至如图所示装置中(省略加热、搅拌和夹持装置),通
 并加热一段时间后,缓慢滴加40mL
并加热一段时间后,缓慢滴加40mL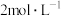 的
的 溶液,维持温度100℃,搅拌充分反应1.5h;
溶液,维持温度100℃,搅拌充分反应1.5h;
步骤3:将反应混合液冷却后,通过一系列操作,得到粗产品3.06g。
Ⅱ.纯度分析
取mg样品配制成100mL溶液,取25mL置于250mL锥形瓶中,加入煮沸过的
 硫酸溶液15.00mL,待样品完全溶解后,加入煮沸过的蒸馏水50.00mL和2滴邻二氮菲指示剂(邻二氮菲遇
硫酸溶液15.00mL,待样品完全溶解后,加入煮沸过的蒸馏水50.00mL和2滴邻二氮菲指示剂(邻二氮菲遇 呈红色,遇
呈红色,遇 呈无色);立即用
呈无色);立即用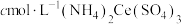 标准溶液滴定至终点(反应的离子方程式为
标准溶液滴定至终点(反应的离子方程式为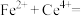
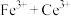 )。平行测定三次,消耗标准溶液的平均体积为VmL。
)。平行测定三次,消耗标准溶液的平均体积为VmL。(1)仪器A的名称是
(2)“步骤1”中发生反应的方程式为
(3)“步骤2”中持续通入
 的目的是
的目的是(4)“步骤3”一系列操作是指减压过滤,
(5)纯度分析实验中判断达到滴定终点的现象是
(6)测得产品的纯度为
您最近一年使用:0次
2 . 铅的单质、氧化物、盐在现代T业中有着重要用途。
I.(1)铅能形成多种氧化物,如碱性氧化物PbO、酸性氧化物PbO2、还有组成类似Fe3O4的PbO2。请将Pb3O4改写成简单氧化物的形式:___ 。
Ⅱ.以废旧铅酸电池中的含铅废料铅膏(Pb、PbO、PbO2、PbSO4等)为原料,制备超细PbO,实现铅的再生利用。其工作流程如下:

(2)步骤①的目的是“脱硫”,即将PbSO4转化为PbCO3,反应的离子方程式为____ 。 “脱硫过程”可在如图所示的装置中进行。实验条件为:转化温度为35℃,液固比为5:1,转化时间为2h。

①仪器a的名称是____ ;转化温度为35℃,采用的合适加热方式是____ 。
②步骤②中H2O2的作用是____ (用化学方程式表示)。
(3)草酸铅受热分解生成PbO时,还有CO和CO2生成,为检验这两种气体,用下图所示的装置(可重复选用)进行实验。实验装置中,依次连接的合理顺序为A___ (填装置字母代号),证明产物中有CO气体的实验现象是____ 。

(4)测定草酸铅样品纯度:称取2.5 g样品,酸溶后配制成250 mL溶液,然后量取25. 00 mL该溶液,用0. 050 00 mol/L的EDTA( Na2H2Y)标准溶液滴定其中的Pb2+(反应方程式为____ ,杂质不反应),平行滴定三次,平均消耗EDTA标准溶液14. 52 mL。
①若滴定管未用EDTA标准液润洗,测定结果将___ (填“偏高”“偏低”或“不变”)。
②草酸铅的纯度为___ (保留四位有效数字)。
I.(1)铅能形成多种氧化物,如碱性氧化物PbO、酸性氧化物PbO2、还有组成类似Fe3O4的PbO2。请将Pb3O4改写成简单氧化物的形式:
Ⅱ.以废旧铅酸电池中的含铅废料铅膏(Pb、PbO、PbO2、PbSO4等)为原料,制备超细PbO,实现铅的再生利用。其工作流程如下:

(2)步骤①的目的是“脱硫”,即将PbSO4转化为PbCO3,反应的离子方程式为

①仪器a的名称是
②步骤②中H2O2的作用是
(3)草酸铅受热分解生成PbO时,还有CO和CO2生成,为检验这两种气体,用下图所示的装置(可重复选用)进行实验。实验装置中,依次连接的合理顺序为A

(4)测定草酸铅样品纯度:称取2.5 g样品,酸溶后配制成250 mL溶液,然后量取25. 00 mL该溶液,用0. 050 00 mol/L的EDTA( Na2H2Y)标准溶液滴定其中的Pb2+(反应方程式为
①若滴定管未用EDTA标准液润洗,测定结果将
②草酸铅的纯度为
您最近一年使用:0次
3 . 常温下,用0.2 mol·L-1NaOH溶液滴定20.00mL一定浓度的一元酸HR溶液时,混合溶液的pH变化情况如图所示,图中a点为滴定终点。下列有关说法正确的是


| A.图中x=7 |
| B.常温下,HR的电离常数Ka=5.0×10-5 |
| C.a点溶液中: c(R-)+ c(OH-)- c(H+)=0.1 mol·L-1 |
| D.b点溶液中: c(Na+)> c(R-)> c(OH-)> c(H+) |
您最近一年使用:0次
4 . 常温下,用浓度为 的
的 标准溶液滴定浓度均为
标准溶液滴定浓度均为 的
的 和
和 的混合溶液,滴定过程中溶液的
的混合溶液,滴定过程中溶液的 随
随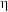 (
( )的变化曲线如图所示。下列说法错误的是
)的变化曲线如图所示。下列说法错误的是
 的
的 标准溶液滴定浓度均为
标准溶液滴定浓度均为 的
的 和
和 的混合溶液,滴定过程中溶液的
的混合溶液,滴定过程中溶液的 随
随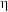 (
( )的变化曲线如图所示。下列说法错误的是
)的变化曲线如图所示。下列说法错误的是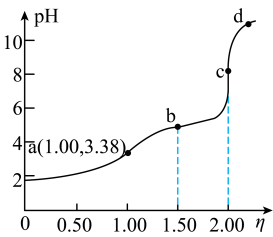
A.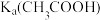 约为 约为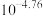 |
B.点a: |
C.点b: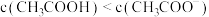 |
D.水的电离程度: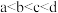 |
您最近一年使用:0次
2023-06-16更新
|
11751次组卷
|
30卷引用:广西壮族自治区南宁三中、柳州高中2023-2024学年高三上学期第一次适应性考试化学试题
广西壮族自治区南宁三中、柳州高中2023-2024学年高三上学期第一次适应性考试化学试题2023年高考湖南卷化学真题(已下线)专题16 水溶液中的离子平衡(已下线)专题16 水溶液中的离子平衡(已下线)专题16 水溶液中的离子平衡(已下线)第15练 水溶液中的离子平衡图像分析 -2023年【暑假分层作业】高二化学(2024届一轮复习通用)(已下线)2023年湖南卷高考真题变式题(选择题11-14)(已下线)专题09 水溶液中的离子平衡-2023年高考化学真题题源解密(新高考专用)安徽省六安第一中学2022-2023学年高二下学期期末考试化学试题(已下线)专题12 水溶液中的离子反应与平衡-2023年高考化学真题题源解密(全国通用)(已下线)考点27 水的电离与溶液的pH(核心考点精讲精练)-备战2024年高考化学一轮复习考点帮(全国通用)(已下线)实验04 强酸和强碱的中和滴定-【同步实验课】2023-2024学年高二化学教材实验大盘点(人教版2019选择性必修1)天津市耀华中学2023-2024学年高三上学期第一次月考化学试题(已下线)第30讲水的电离和溶液的酸碱性(已下线)考点2 水的电离与溶液的pH (核心考点精讲精练)-备战2024年高考化学一轮复习考点帮(新高考专用)(已下线)考点3 盐类水解(核心考点精讲精练)-备战2024年高考化学一轮复习考点帮(新高考专用)浙江省杭州第十四中学2023-2024学年高二上学期 期中考试化学试卷湖北省恩施一中、建始一中、咸丰一中三校2023-2024学年高二上学期9月联考化学试题浙江省台州市山海协作体2023-2024学年高二上学期期中联考化学试题福建省厦门第一中学2023-2024学年高二上学期12月月考化学试卷(已下线)题型03 电解质溶液图像分析-2024年高考化学答题技巧与模板构建天津市和平区2023-2024学年高二上学期期末考试化学试卷(已下线)题型14 电解质溶液-2024年高考化学二轮热点题型归纳与变式演练(新高考通用)10-2023新东方高二上期中考化学江苏省淮安市高中校协作体2023-2024学年高三上学期期中联考化学试题浙江省浙南名校2023-2024学年高二上学期开学化学试题浙江省杭州市浙江大学附属中学2023-2024学年高二上学期期末考试化学试题陕西省宝鸡实验高级中学2023-2024学年高三上学期12月联考理科综合试题(已下线)FHgkyldyjhx10广东省江门市新会第一中学2023-2024学年高三下学期热身考试化学试题
名校
解题方法
5 . 滴定分析法是一种精度很高的定量分析法。以酚酞为指示剂,用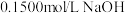 标准溶液滴定某未知浓度的盐酸溶液,下列说法错误的是
标准溶液滴定某未知浓度的盐酸溶液,下列说法错误的是
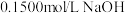 标准溶液滴定某未知浓度的盐酸溶液,下列说法错误的是
标准溶液滴定某未知浓度的盐酸溶液,下列说法错误的是| A.用酸式滴定管盛装待测液 |
| B.装液之前需润洗碱式滴定管 |
| C.指示剂多加不影响测定结果 |
| D.滴定终点时,溶液颜色由无色变为粉红色 |
您最近一年使用:0次
2022-01-14更新
|
1034次组卷
|
4卷引用:广西南宁市宾阳县宾阳中学2021-2022学年高二上学期期末考试化学试题
名校
6 . 乙二胺(H2NCH2CH2NH2),无色液体,电离类似于氨:NH3+H2O⇌NH4++OH-,25℃时,kb1=10-4.07,kb2=10-7.15;乙二胺溶液中含氮微粒的物质的量浓度分数随溶液pH的变化如图。下列说法不正确的是( )


| A.曲线Ⅱ代表的微粒符号为H2NCH2CH2NH3+ |
| B.曲线Ⅰ与曲线II相交点对应pH=6.85 |
| C.乙二胺在水溶液中第二步电离的方程式H2NCH2CH2NH3++H2O⇌[H3NCH2CH2NH3]2++OH- |
| D.0.1 mol/LH2NCH2CH2NH3Cl溶液中各离子浓度大小关系为:c(Cl-)>c(H2NCH2CH2NH3+)>c(H+)>c(OH-) |
您最近一年使用:0次



