名校
解题方法
1 . 草酸是植物(特别是草本植物)常具有的成分,有广泛的用途。草酸晶体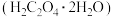 无色,熔点为101℃,易溶于水。常温下草酸的电离常数
无色,熔点为101℃,易溶于水。常温下草酸的电离常数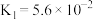 ,
,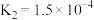 。
。
(1)写出草酸第一步电离方程式:_______ 。
(2)草酸具有很强的还原性,与氧化剂作用易被氧化成二氧化碳和水,可以使酸性高锰酸钾( )溶液褪色,写出发生反应的离子方程式:
)溶液褪色,写出发生反应的离子方程式:_______ 。为了探究浓度对化学反应速率的影响,相同温度条件下,分别用2支试管设计了如下实验:
此实验中,加入 溶液的体积应为
溶液的体积应为_______ mL。
(3)结合题干所给的电离平衡常数,判断 溶液的酸碱性,应显
溶液的酸碱性,应显_______ 性(填“酸”或“碱”)。
(4)设计实验证明草酸为弱酸的方案及其现象均正确的有_______(填序号)。
(5)为测定某 溶液的浓度,取
溶液的浓度,取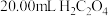 溶液于锥形瓶中,滴入2~3滴指示剂,用0.1000moL/L的NaOH溶液进行滴定,并进行3次平行实验,所用NaOH溶液体积分别为19.98mL、20.02mL和22.02mL。
溶液于锥形瓶中,滴入2~3滴指示剂,用0.1000moL/L的NaOH溶液进行滴定,并进行3次平行实验,所用NaOH溶液体积分别为19.98mL、20.02mL和22.02mL。
①所用指示剂为_______ ;滴定终点时的现象为_______ ;
② 溶液物质的量浓度为
溶液物质的量浓度为_______ mol/L;
③下列操作会引起测定结果偏高的是_______ (填序号)。
A.滴定管在盛装NaOH溶液前未润洗
B.滴定过程中,锥形瓶震荡的太剧烈,以致部分液体溅出
C.锥形瓶水洗后未干燥
D.滴定前读数正确,滴定终点时仰视读数
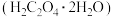 无色,熔点为101℃,易溶于水。常温下草酸的电离常数
无色,熔点为101℃,易溶于水。常温下草酸的电离常数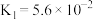 ,
,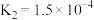 。
。(1)写出草酸第一步电离方程式:
(2)草酸具有很强的还原性,与氧化剂作用易被氧化成二氧化碳和水,可以使酸性高锰酸钾(
 )溶液褪色,写出发生反应的离子方程式:
)溶液褪色,写出发生反应的离子方程式:| 试管 | A | B |
| 加入试剂 |  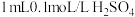 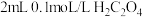 | _______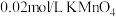 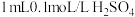 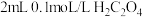 |
 溶液的体积应为
溶液的体积应为(3)结合题干所给的电离平衡常数,判断
 溶液的酸碱性,应显
溶液的酸碱性,应显(4)设计实验证明草酸为弱酸的方案及其现象均正确的有_______(填序号)。
A.室温下,取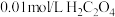 溶液,测其 溶液,测其 ; ; |
B.室温下,取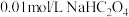 溶液,测其 溶液,测其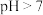 ; ; |
C.室温下,取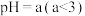 的 的 溶液稀释100倍后,测其 溶液稀释100倍后,测其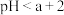 ; ; |
D.标况下,取0.1moL/L的 溶液100mL与足量锌粉反应,收集到 溶液100mL与足量锌粉反应,收集到 体积为224mL; 体积为224mL; |
 溶液的浓度,取
溶液的浓度,取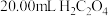 溶液于锥形瓶中,滴入2~3滴指示剂,用0.1000moL/L的NaOH溶液进行滴定,并进行3次平行实验,所用NaOH溶液体积分别为19.98mL、20.02mL和22.02mL。
溶液于锥形瓶中,滴入2~3滴指示剂,用0.1000moL/L的NaOH溶液进行滴定,并进行3次平行实验,所用NaOH溶液体积分别为19.98mL、20.02mL和22.02mL。①所用指示剂为
②
 溶液物质的量浓度为
溶液物质的量浓度为③下列操作会引起测定结果偏高的是
A.滴定管在盛装NaOH溶液前未润洗
B.滴定过程中,锥形瓶震荡的太剧烈,以致部分液体溅出
C.锥形瓶水洗后未干燥
D.滴定前读数正确,滴定终点时仰视读数
您最近一年使用:0次
名校
解题方法
2 . 常温下,向 溶液中逐滴加入
溶液中逐滴加入 的
的 溶液,溶液的
溶液,溶液的 随
随 溶液体积的变化如图所示。下列说法正确的是
溶液体积的变化如图所示。下列说法正确的是
 溶液中逐滴加入
溶液中逐滴加入 的
的 溶液,溶液的
溶液,溶液的 随
随 溶液体积的变化如图所示。下列说法正确的是
溶液体积的变化如图所示。下列说法正确的是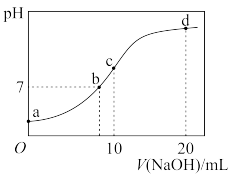
A.点 所示溶液中: 所示溶液中: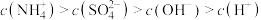 |
B.点 所示溶液中: 所示溶液中: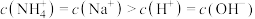 |
C.点 所示溶液中: 所示溶液中: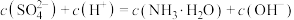 |
D.点 以后的溶液中可能出现: 以后的溶液中可能出现: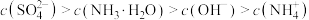 |
您最近一年使用:0次
2021-12-29更新
|
1188次组卷
|
23卷引用:天津市海河中学2020届高三第二学期化学测试(二)试卷
天津市海河中学2020届高三第二学期化学测试(二)试卷(已下线)2013届江苏省扬州市高三下学期5月考前适应性考试化学试卷2017届江苏省南通市高三高考全真模拟(四)化学 试卷2016-2017学年浙江省温州市“十五校联合体”高二下学期期中联考化学试卷河北省定州中学2017届高三(高补班)下学期第二次月考(4月)化学试题黑龙江省双鸭山市第一中学2017届高三全真模拟(第四次)考试理科综合化学试题浙江省2018版考前特训(2017年10月):选考仿真测试卷(四)江苏省前黄高级中学、如东高级中学、姜堰中学等五校2018届高三上学期第一次学情监测化学试题新疆2018届高三第一次适应性检测(一模)理科综合化学试题【区级联考】山东省临沂市罗庄区2018-2019学年高二上学期期末考试化学试题安徽省长丰县双墩中学2018-2019学年高二上学期期末调研化学试题河北省武邑中学2019-2020学年高二下学期3月线上考试化学试题辽宁省朝阳市凌源市实验中学2019-2020学年高二下学期4月份月考化学试题黑龙江省安达市第七中学2019-2020学年高二下学期第一次网络检测化学试题人教版(2019)高二选择性必修第一册 第三章 水溶液中的离子反应与平衡 章末综合检测卷上海交通大学附属中学2021届高三下学期3月月考化学试题天津市耀华中学2021届高三年级第二次模拟考试化学试题吉林油田高级中学2021-2022学年高二上学期期中考试化学试题辽宁省朝阳市建平县实验中学2021-2022学年高二上学期期末考试化学试题江西省九江市第一中学2021-2022学年高二上学期期末化学试题江苏省秦淮中学、宇通实验学校等六校2022-2023学年高三上学期10月学情调研化学试题(已下线)【知识图鉴】单元讲练测选择性必修1第3单元03巩固练黑龙江省海伦市第一中学2022-2023学年高二上学期11月期中考试化学试题
名校
解题方法
3 . 常温下,向20 mL0.1 mol/L的某一元酸(HA)溶液中加入几滴酚酞溶液,再逐滴滴加0.1 mol/LNaOH溶液,测得滴定曲线如图。下列说法不正确 的是
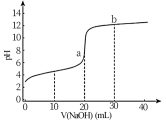

| A.V=10 mL时,c(HA)>c(A-) |
| B.pH=7时,V(NaOH)<20 mL |
| C.滴定终点时,溶液由无色变为浅红色 |
| D.a点的水的电离程度大于b点的水的电离程度 |
您最近一年使用:0次
2021-01-22更新
|
801次组卷
|
6卷引用:天津市河西区2022-2023学年高三下学期总复习质量调查(三) 化学试题
天津市河西区2022-2023学年高三下学期总复习质量调查(三) 化学试题北京市海淀区2021届高三上学期期末考试化学试题天津市杨村第一中学2020-2021学年高三下学期开学开学考试化学试题北京师范大学附属中学2021-2022学年高三上学期期中考试化学试题天津市武清区杨村第一中学2022-2023学年高三下学期开学摸底测试化学试题(已下线)考点2 水的电离与溶液的pH (核心考点精讲精练)-备战2024年高考化学一轮复习考点帮(新高考专用)
4 . 25℃,用0.100mol·L-1的NaOH溶液分别滴定20.00mL0.100mol·L-1的盐酸和0.100mol·L-1的醋酸,得到如图所示滴定曲线:
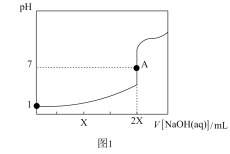
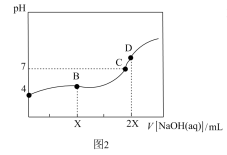
下列说法不正确 的是( )


下列说法
| A.图1表示的是滴定盐酸的曲线 |
| B.图2滴定应选用甲基橙做指示剂 |
| C.图中A、D点水的电离程度:A<D |
| D.图2中B点:c(CH3COO-)>c(Na+)>c(H+)>c(OH-) |
您最近一年使用:0次
5 . NaOH溶液滴定邻苯二甲酸氢钾(邻苯二甲酸H2A的Ka1=1.1×10−3 ,Ka2=3.9×10−6)溶液,混合溶液的相对导电能力变化曲线如图所示,其中b点为反应终点。下列叙述错误的是
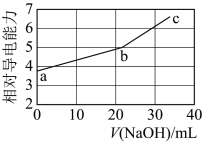

| A.混合溶液的导电能力与离子浓度和种类有关 |
| B.Na+与A2−的导电能力之和大于HA−的 |
| C.b点的混合溶液pH=7 |
| D.c点的混合溶液中,c(Na+)>c(K+)>c(OH−) |
您最近一年使用:0次
2019-06-09更新
|
20961次组卷
|
67卷引用:天津市海河中学2020届高三第二学期化学测试(二)试卷
天津市海河中学2020届高三第二学期化学测试(二)试卷2019年全国统一考试化学试题(新课标Ⅰ)(已下线)专题10 水溶液中的离子平衡——2019年高考真题和模拟题化学分项汇编安徽省阜阳市颍上二中等三校2020届高三上学期入学考试化学试题(已下线)专题8.1 弱电解质的电离平衡(讲)-《2020年高考一轮复习讲练测》2020届高考化学小题狂练(全国通用版)专练15 弱电解质的电离平衡和溶液酸碱性云南师范大学附属中学2019-2020学年高二上学期期中考试化学试题湖南省株洲市茶陵二中2020届高三上学期第二次月考化学试题江苏省海安高级中学2019-2020学年高二12月月考化学试题福建省莆田第二十五中学2020届高三上学期期末考试化学试题专题2.3 水溶液中的离子平衡(疑难突破)——巅峰冲刺2020年高考化学二轮专项提升湖南省长沙市天心区雅礼中学2018-2019学年高二下学期期末考试化学试题湖南省长沙市雅礼中学2019-2020学年高二上学期期末考试化学试题(已下线)专题十二 水溶液中的离子平衡(真题汇编)-2020年高考二轮模块化复习之《化学基本原理》名师讲案与提分特训辽宁省本溪市2019-2020学年高二下学期寒假验收考试化学试题江苏省南通市2020届高三第二次模拟考试(5月) 化学 试题黑龙江省大庆市第四中学2020届高三下学期4月月考理综化学试题北京市海淀区育英学校2020届高三三模化学试题天津市第一中学2020届高三下学期第五次月考化学试题鲁科版(2019)选择性必修1第3章 物质在水溶液中的行为 第3章 综合检测高中必刷题高二选择性必修1第三章 水溶液中的离子反应与平衡 第三章素养检测(已下线)3.3.2+影响盐类水解的主要因素和盐类水解的应用-2020-2021学年高二化学同步课堂帮帮帮(人教版选修4)人教版(2019)高二选择性必修第一册 第三章 水溶液中的离子反应与平衡 第二节 水的电离和溶液的pH 高考帮(已下线)第03章 水溶液中的离子反应与平衡(B卷能力提高篇)-2020-2021学年高二化学选择性必修1同步单元AB卷(新教材人教版)鲁科版(2019)高二选择性必修第一册第3章 物质在水溶液中的行为 过高考 3年真题强化闯关第25讲 弱电解质的电离平衡(精讲)-2021年高考化学一轮复习讲练测(已下线)【浙江新东方】【2020】【高三上】【一模】【HD-LP416】【化学】(已下线)【浙江新东方】112(已下线)小题必刷31 酸碱中和滴定及拓展应用——2021年高考化学一轮复习小题必刷(通用版本)(已下线)小题必刷30 水的电离与溶液的酸碱性——2021年高考化学一轮复习小题必刷(通用版本)(已下线)小题必刷29 弱电解质的电离平衡——2021年高考化学一轮复习小题必刷(通用版本)(已下线)小题必刷33 粒子浓度大小比较——2021年高考化学一轮复习小题必刷(通用版本)福建省连城县第一中学2021届高三上学期第二次月考化学试题(已下线)专题12 水溶液中离子平衡(攻克各种图像问题)-2021年高考化学必做热点专题重庆市育才中学2021届高三下学期入学考试化学试题(已下线)解密10 水溶液中离子反应(讲义)-【高频考点解密】2021年高考化学二轮复习讲义+分层训练(已下线)专题07 电解质溶液——备战2021年高考化学纠错笔记(已下线)解密10 水溶液中离子反应(讲义)-【高频考点解密】2021年高考化学二轮复习讲义+分层训练(浙江专版)天津市南开中学2021届高三上学期第五次月考化学试卷(已下线)押全国卷理综第12题 水溶液中的离子平衡-备战2021年高考化学临考题号押题(课标全国卷)选择性必修1(SJ)专题3专题培优专练(已下线)考点23 弱电解质的电离-备战2022年高考化学一轮复习考点帮(全国通用)(已下线)课时39 弱电解质的电离平衡-2022年高考化学一轮复习小题多维练(全国通用)(已下线)第21讲 电离平衡(讲)-2022年高考化学一轮复习讲练测(新教材新高考)(已下线)第6讲 离子平衡坐标图像-【微专题·大素养】备战2022年高考化学核心突破(水溶液中的离子反应与平衡)重庆育才中学2021-2022学年高二上学期第四次定时练习化学试题山西省太原市第五中学2021-2022学年高二上学期12月月考化学试题(已下线)专题07 电解质溶液—2022年高考化学二轮复习讲练测(全国版)-练习湖北省沙市中学2021-2022学年高二上学期期末考试化学试题鲁科版(2019)选择性必修1 第3章 物质在水溶液中的行为 第4节 离子反应(已下线)押全国卷理综第12题 水溶液中的离子平衡-备战2022年高考化学临考题号押题(全国卷)(已下线)回归教材重难点07 图像数据和结果的分析-【查漏补缺】2022年高考化学三轮冲刺过关(全国通用)(已下线)回归教材重难点04 水溶液中的离子平衡-【查漏补缺】2022年高考化学三轮冲刺过关(全国通用)浙江省绍兴市柯桥区2022届高考及选考科目5月适应性考试化学试题(已下线)专题10水溶液中的离子平衡-五年(2018~2022)高考真题汇编(全国卷)河北省秦皇岛市第一中学2021-2022学年高二下学期期末考试化学试题天津市咸水沽第一中学2023届高三上学期第一次模拟考试化学试题(已下线)第21讲 电离平衡(讲)-2023年高考化学一轮复习讲练测(新教材新高考)湖南省永州市宁远县第一中学2022-2023学年高二上学期期中考试化学试题(已下线)专题06 水溶液中的离子平衡(练)-2023年高考化学二轮复习讲练测(新高考专用)(已下线)第八章 水溶液中的离子反应与平衡 第46讲 弱电解质的电离平衡(已下线)题型134 导电能力与酸碱中和滴定图像广东省汕头市金山中学2022-2023学年高二下学期期中考试化学试题(已下线)专题16 水溶液中的离子平衡(已下线)T11-电解质溶液(已下线)第31讲盐类的水解2018-2019学年度耀华实验学校第二学期高二实验化学期末试卷
名校
6 . 常温下,分别取未知浓度的MOH和HA溶液,加水稀释至原体积的n倍。稀释过程中,两溶液pH的变化如下图所示。下列叙述正确的是
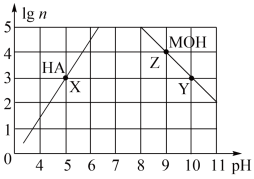

| A.MOH为弱碱,HA为强酸 |
| B.水的电离程度:X=Z>Y |
| C.若升高温度,Y、Z点对应溶液的pH均不变 |
| D.将X点溶液与Z点溶液等体积混合,所得溶液呈碱性 |
您最近一年使用:0次
2018-04-14更新
|
1508次组卷
|
15卷引用:天津市海河中学2020届高三第二学期化学测试(二)试卷
天津市海河中学2020届高三第二学期化学测试(二)试卷宁夏银川市2018届高三4月高中教学质量检测理科综合化学试题【百强校】天津市静海区第一中学2020届高三下学期第七周周末训练化学试题(已下线)专题12 水溶液中离子平衡(攻克各种图像问题)-2021年高考化学必做热点专题广东省佛山市第一中学2021-2022学年高二上学期期中考试化学(选考) 试题湖南省怀化市沅陵县第一中学2021-2022学年高三下学期期中考试化学试题新疆乌鲁木齐市第八中学2021-2022学年高二上学期第三次月考化学试题(已下线)押新高考卷13题 水溶液中的离子平衡-备战2022年高考化学临考题号押题(新高考通版)宁夏回族自治区银川一中2022-2023学年高二上学期期中考试化学试题(已下线)【2022】【高二上】【期中考】【高中化学】59(已下线)专题21 电解质溶液图像分析-2023年高考化学毕业班二轮热点题型归纳与变式演练(新高考专用)(已下线)专题11 水溶液中的离子平衡图像(选择题)-2023年高考化学毕业班二轮热点题型归纳与变式演练(已下线)专题四 电解质溶液图象(讲)广东省广州市第二中学2023-2024学年高二上学期期中考试化学试题云南省腾冲市第八中学2022-2023学年高二下学期第三次月考化学试题
名校
7 . 常温下,将1.0mol/L 盐酸滴入20mL 10mol/L氨水中,溶液pH随加入盐酸体积变化的曲线如右图所示。下列有关说法正确的是
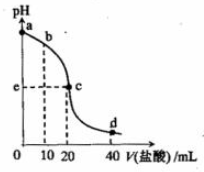

| A.a点,c(NH4+)=c(OH-) |
| B.b点,c(NH4+)>c(Cl-)>c(NH3·H2O) |
| C.c点,pH=7 |
| D.d点,c(NH4+)+c(NH3·H2O)=c(Cl-) |
您最近一年使用:0次
2018-01-20更新
|
244次组卷
|
2卷引用:天津市河西区2017-2018学年上学期期末高三化学试题
解题方法
8 . 锡及其化合物在生产、生活中有着重要的用途。已知:Sn的熔点为231 ℃;Sn2+易水解、易被氧化;SnCl4极易水解、熔点为-33 ℃、沸点为114 ℃。请按要求回答下列相关问题:
(1)元素锡比同主族碳的周期数大3,锡的原子序数为________ 。
(2)用于微电子器件生产的锡粉纯度测定:
①取1.19 g试样溶于稀硫酸中(杂质不参与反应),使Sn完全转化为Sn2+;
②加入过量的Fe2(SO4)3;
③用0.1 000 mol/L K2Cr2O7溶液滴定(产物中Cr呈+3价),消耗20.00 mL。步骤②中加入Fe2(SO4)3的作用是__________________ ;此锡粉样品中锡的质量分数:____________ 。
(3)用于镀锡工业的硫酸亚锡(SnSO4)的制备路线如下:
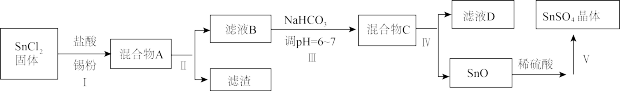
①步骤Ⅰ加入Sn粉的作用:____________________ 及调节溶液pH。
②步骤Ⅱ用到的玻璃仪器有烧杯、________________________ 。
③步骤Ⅲ生成SnO的离子方程式:__________________________ 。
④步骤Ⅳ中检验SnO是否洗涤干净的操作是___________________ ,证明已洗净。
⑤步骤Ⅴ操作依次为___________________ 、过滤、洗涤、低温干燥。
(4)SnCl4蒸气遇氨及水汽呈浓烟状,因而可制作烟幕弹,其反应的化学方程式为:_____________ 。实验室欲用下图装置制备少量SnCl4(夹持装置略),该装置存在明显缺陷,改进方法是_______________
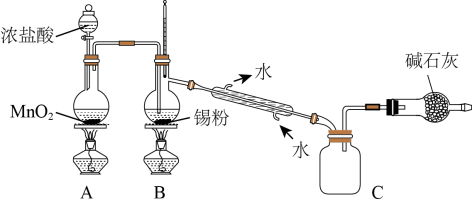
(5)利用改进后的装置进行实验,当开始装置C中收集到有SnCl4时即可熄灭B处酒精灯,反应仍可持续进行的理由是______________________ 。
(1)元素锡比同主族碳的周期数大3,锡的原子序数为
(2)用于微电子器件生产的锡粉纯度测定:
①取1.19 g试样溶于稀硫酸中(杂质不参与反应),使Sn完全转化为Sn2+;
②加入过量的Fe2(SO4)3;
③用0.1 000 mol/L K2Cr2O7溶液滴定(产物中Cr呈+3价),消耗20.00 mL。步骤②中加入Fe2(SO4)3的作用是
(3)用于镀锡工业的硫酸亚锡(SnSO4)的制备路线如下:
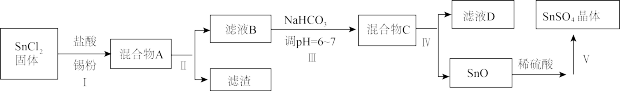
①步骤Ⅰ加入Sn粉的作用:
②步骤Ⅱ用到的玻璃仪器有烧杯、
③步骤Ⅲ生成SnO的离子方程式:
④步骤Ⅳ中检验SnO是否洗涤干净的操作是
⑤步骤Ⅴ操作依次为
(4)SnCl4蒸气遇氨及水汽呈浓烟状,因而可制作烟幕弹,其反应的化学方程式为:

(5)利用改进后的装置进行实验,当开始装置C中收集到有SnCl4时即可熄灭B处酒精灯,反应仍可持续进行的理由是
您最近一年使用:0次
2016-12-09更新
|
255次组卷
|
4卷引用:2015届天津市河西区高三下学期总复习质量调查(二)化学试卷



