1 . 次硫酸氢钠甲醛(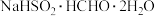 ,其相对分子质量为154)俗称吊白块,在空气中易被氧化,120℃时会分解,在印染、医药及原子能工业中应用广泛。某实验小组以浓
,其相对分子质量为154)俗称吊白块,在空气中易被氧化,120℃时会分解,在印染、医药及原子能工业中应用广泛。某实验小组以浓 、
、 、HCHO和Zn为原料制备次硫酸氢钠甲醛。回答下列问题:
、HCHO和Zn为原料制备次硫酸氢钠甲醛。回答下列问题:
(1)制备 :实验室常用
:实验室常用 与浓
与浓 反应制取
反应制取 。
。
① 分子的空间结构为
分子的空间结构为___________ 。
②工业生产中常用氨水处理废气中 ,写出足量氨水吸收
,写出足量氨水吸收 的离子方程式:
的离子方程式:___________ 。
(2)制备 溶液:在三颈烧瓶中加入一定量
溶液:在三颈烧瓶中加入一定量 固体和
固体和 ,搅拌溶解,再缓慢通入
,搅拌溶解,再缓慢通入 ,实验装置如图所示(夹持仪器已省略)。
,实验装置如图所示(夹持仪器已省略)。 溶液吸收
溶液吸收 的过程中,
的过程中,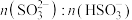 及
及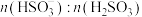 等于1时,溶液的pH分别为7.2、2。
等于1时,溶液的pH分别为7.2、2。
①装置E的作用是___________ ,装置X的名称为___________ 。
②常温下,当溶液中 时,溶液的pH为
时,溶液的pH为___________ 。
(3)制备次硫酸氢钠甲醛:(2)中充分反应后,将装置D中导气管换成橡皮塞,向三颈烧瓶中加入稍过量的锌粉和一定量甲醛溶液,在80~90℃下,反应约3h,冷却至室温,抽滤。
①生成 [副产物为
[副产物为 ]时发生反应的化学方程式为
]时发生反应的化学方程式为___________ 。
②将上述抽滤所得的滤液经___________ 步骤,过滤得到产品。
(4)测定产品的纯度:准确称取8.0 g产品,完全溶于水配成100 mL溶液,取20.00 mL所配溶液,加入过量碘完全反应后(已知 不能氧化甲醛,S元素转化为
不能氧化甲醛,S元素转化为 ,杂质不反应),加入
,杂质不反应),加入 溶液至沉淀完全,过滤、洗涤、干燥至恒重得到白色固体2.33 g。产品的纯度为
溶液至沉淀完全,过滤、洗涤、干燥至恒重得到白色固体2.33 g。产品的纯度为___________ 。
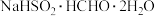 ,其相对分子质量为154)俗称吊白块,在空气中易被氧化,120℃时会分解,在印染、医药及原子能工业中应用广泛。某实验小组以浓
,其相对分子质量为154)俗称吊白块,在空气中易被氧化,120℃时会分解,在印染、医药及原子能工业中应用广泛。某实验小组以浓 、
、 、HCHO和Zn为原料制备次硫酸氢钠甲醛。回答下列问题:
、HCHO和Zn为原料制备次硫酸氢钠甲醛。回答下列问题:(1)制备
 :实验室常用
:实验室常用 与浓
与浓 反应制取
反应制取 。
。①
 分子的空间结构为
分子的空间结构为②工业生产中常用氨水处理废气中
 ,写出足量氨水吸收
,写出足量氨水吸收 的离子方程式:
的离子方程式:(2)制备
 溶液:在三颈烧瓶中加入一定量
溶液:在三颈烧瓶中加入一定量 固体和
固体和 ,搅拌溶解,再缓慢通入
,搅拌溶解,再缓慢通入 ,实验装置如图所示(夹持仪器已省略)。
,实验装置如图所示(夹持仪器已省略)。
 溶液吸收
溶液吸收 的过程中,
的过程中,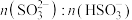 及
及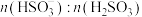 等于1时,溶液的pH分别为7.2、2。
等于1时,溶液的pH分别为7.2、2。①装置E的作用是
②常温下,当溶液中
 时,溶液的pH为
时,溶液的pH为(3)制备次硫酸氢钠甲醛:(2)中充分反应后,将装置D中导气管换成橡皮塞,向三颈烧瓶中加入稍过量的锌粉和一定量甲醛溶液,在80~90℃下,反应约3h,冷却至室温,抽滤。
①生成
 [副产物为
[副产物为 ]时发生反应的化学方程式为
]时发生反应的化学方程式为②将上述抽滤所得的滤液经
(4)测定产品的纯度:准确称取8.0 g产品,完全溶于水配成100 mL溶液,取20.00 mL所配溶液,加入过量碘完全反应后(已知
 不能氧化甲醛,S元素转化为
不能氧化甲醛,S元素转化为 ,杂质不反应),加入
,杂质不反应),加入 溶液至沉淀完全,过滤、洗涤、干燥至恒重得到白色固体2.33 g。产品的纯度为
溶液至沉淀完全,过滤、洗涤、干燥至恒重得到白色固体2.33 g。产品的纯度为
您最近一年使用:0次
名校
2 . 某兴趣小组在实验室使用多孔硫颗粒作催化剂,将一氯乙酸( )转化为应用更广泛的三氯乙酸(
)转化为应用更广泛的三氯乙酸(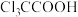 )。主要反应方程式:
)。主要反应方程式: 。制备装置如图所示(部分夹持装置和加热装置已省略)。
。制备装置如图所示(部分夹持装置和加热装置已省略)。
(1)仪器X的名称为______ ,冷凝水的进水口为______ (填“a”或“b”)。
(2)检查虚线框内装置的气密性方法为______ 。
(3)装置甲中制取 的离子方程式为
的离子方程式为______ ,装置戊的作用是______ 。
(4)制备三氯乙酸时,需要控制温度在140℃左右持续加热,则丁的加热方法是______ (填“水浴加热”或“油浴加热”),该过程中不需要另加沸石,原因是______ 。
(5)已知 ,常温下
,常温下 、
、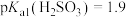 、
、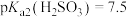 ,则在
,则在 溶液中加入足量的
溶液中加入足量的 ,发生反应的离子方程式为
,发生反应的离子方程式为______ 。
 )转化为应用更广泛的三氯乙酸(
)转化为应用更广泛的三氯乙酸(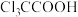 )。主要反应方程式:
)。主要反应方程式: 。制备装置如图所示(部分夹持装置和加热装置已省略)。
。制备装置如图所示(部分夹持装置和加热装置已省略)。
(1)仪器X的名称为
(2)检查虚线框内装置的气密性方法为
(3)装置甲中制取
 的离子方程式为
的离子方程式为(4)制备三氯乙酸时,需要控制温度在140℃左右持续加热,则丁的加热方法是
(5)已知
 ,常温下
,常温下 、
、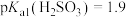 、
、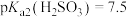 ,则在
,则在 溶液中加入足量的
溶液中加入足量的 ,发生反应的离子方程式为
,发生反应的离子方程式为
您最近一年使用:0次
2024-06-04更新
|
158次组卷
|
3卷引用:2024届河北省部分高中高三下学期二模化学试题
解题方法
3 .  用途广泛。某实验小组同学围绕
用途广泛。某实验小组同学围绕 开展如下实验活动。
开展如下实验活动。
 .配制溶液
.配制溶液
(1)配制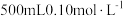 的
的 溶液,需要称量
溶液,需要称量 固体的质量为
固体的质量为___________  。
。
(2)上述配制溶液的过程中,用到的玻璃仪器除玻璃棒、量筒、胶头滴管外,还有___________ (填标号)。 .实验探究
.实验探究
探究温度对 溶液
溶液 的影响,进行如下实验(不考虑水的挥发)。
的影响,进行如下实验(不考虑水的挥发)。
(3) 溶液显碱性的原因是
溶液显碱性的原因是___________ (用离子方程式表示)。
(4)实验1中测得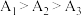 ,可知当
,可知当 时,
时, 溶液的
溶液的 随温度升高而减小,这主要是
随温度升高而减小,这主要是 改变与水解平衡移动共同作用的结果,其中
改变与水解平衡移动共同作用的结果,其中___________ 发挥主导作用。实验1中测得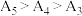 ,且当
,且当 时,实验过程中观察到有气泡产生。
时,实验过程中观察到有气泡产生。
(5)针对(4)中实验现象,小组同学继续开展探究。
查阅资料: 溶液中存在平衡:
溶液中存在平衡: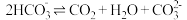 。
。
提出猜想:对于 溶液,当
溶液,当 时,该反应进行程度很小;当
时,该反应进行程度很小;当 时,该反应进行程度明显增大。
时,该反应进行程度明显增大。
实验验证:该小组同学设计如下方案进行实验,进一步验证猜想。补充表格内容。
实验结论:②根据实验1~3的结果,小组同学认为猜想成立,其判断依据是___________ 。
拓展总结:③ 溶液中存在
溶液中存在 的自偶电离平衡:
的自偶电离平衡: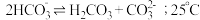 时,
时, 自偶电离的平衡常数为
自偶电离的平衡常数为___________ [保留两位有效数字;已知: 时,
时,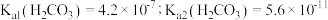 ]。当温度升高时,
]。当温度升高时, 更易分解,
更易分解, 从体系逸出,促进了
从体系逸出,促进了 在溶液中的分解。
在溶液中的分解。
(6)写出 在生产或生活中的一种应用
在生产或生活中的一种应用___________ 。
 用途广泛。某实验小组同学围绕
用途广泛。某实验小组同学围绕 开展如下实验活动。
开展如下实验活动。 .配制溶液
.配制溶液(1)配制
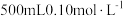 的
的 溶液,需要称量
溶液,需要称量 固体的质量为
固体的质量为 。
。(2)上述配制溶液的过程中,用到的玻璃仪器除玻璃棒、量筒、胶头滴管外,还有
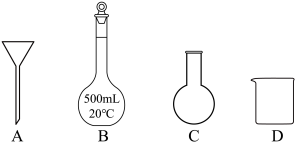
 .实验探究
.实验探究探究温度对
 溶液
溶液 的影响,进行如下实验(不考虑水的挥发)。
的影响,进行如下实验(不考虑水的挥发)。| 实验序号 | 操作 | 测试温度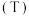 |  |
| 1 | 采用水浴加热,将 溶液从 溶液从 持续升温至 持续升温至 ,每隔 ,每隔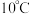 测量并记录溶液 测量并记录溶液 |  |  |
 |  | ||
 |  | ||
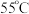 |  | ||
 | 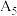 |
(3)
 溶液显碱性的原因是
溶液显碱性的原因是(4)实验1中测得
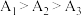 ,可知当
,可知当 时,
时, 溶液的
溶液的 随温度升高而减小,这主要是
随温度升高而减小,这主要是 改变与水解平衡移动共同作用的结果,其中
改变与水解平衡移动共同作用的结果,其中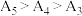 ,且当
,且当 时,实验过程中观察到有气泡产生。
时,实验过程中观察到有气泡产生。(5)针对(4)中实验现象,小组同学继续开展探究。
查阅资料:
 溶液中存在平衡:
溶液中存在平衡: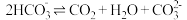 。
。提出猜想:对于
 溶液,当
溶液,当 时,该反应进行程度很小;当
时,该反应进行程度很小;当 时,该反应进行程度明显增大。
时,该反应进行程度明显增大。实验验证:该小组同学设计如下方案进行实验,进一步验证猜想。补充表格内容。
| 实验序号 | 操作 | 测试温度 |  |
| 2 | 采用水浴加热,① ,并记录溶液 ,并记录溶液 |  |  |
| 3 | 采用水浴加热,将 溶液从 溶液从 升温至 升温至 ,然后冷却至 ,然后冷却至 ,并记录溶液 ,并记录溶液 |  |  |
拓展总结:③
 溶液中存在
溶液中存在 的自偶电离平衡:
的自偶电离平衡: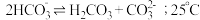 时,
时, 自偶电离的平衡常数为
自偶电离的平衡常数为 时,
时,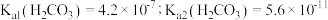 ]。当温度升高时,
]。当温度升高时, 更易分解,
更易分解, 从体系逸出,促进了
从体系逸出,促进了 在溶液中的分解。
在溶液中的分解。(6)写出
 在生产或生活中的一种应用
在生产或生活中的一种应用
您最近一年使用:0次
2024-05-29更新
|
657次组卷
|
2卷引用:广东省深圳市2024届高三二模考试化学试题
解题方法
4 . 二氧化硫是一种使人们爱恨交加的物质,爱其作为一种化工原料,为人类提供物质基础,恨其有毒,对人类即环境的危害。联系工业生产中用碱液吸收含 制的尾气,某同学对实验室中
制的尾气,某同学对实验室中 制备与性质实验的尾气采用
制备与性质实验的尾气采用 溶液吸收,装置如下:
溶液吸收,装置如下: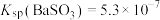 。
。
(1)利用85%的浓硫酸和 ,固体反应制备
,固体反应制备 ,下述“
,下述“ 制备装置”合理的是________。
制备装置”合理的是________。
(2) 溶液吸收
溶液吸收 后生成物与反应物的量有关,能生成
后生成物与反应物的量有关,能生成 或
或 。
。
某同学查阅资料:常温时, ,
,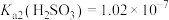 。
。
某次实验结束后,该同学通过数字实验,用pH传感器测得吸收液的 (常温),则该混合液中含硫物种物质的量浓度最大的是
(常温),则该混合液中含硫物种物质的量浓度最大的是________ (填微粒化学式)。
(3)“性质实验装置”中将 通入到
通入到 的
的 溶液中,生成白色沉淀,通过化学平衡常数计算,确定该沉淀不是
溶液中,生成白色沉淀,通过化学平衡常数计算,确定该沉淀不是 沉淀:
沉淀:________________ ;有同学结合“性质实验”反应物的组成及性质推断该沉淀为 ,若忽略空气中
,若忽略空气中 的影响,则该性质实验中生成
的影响,则该性质实验中生成 的离子方程式是
的离子方程式是________________ 。请你设计实验探究该反应的生成物是 ,而不是
,而不是 :
:________________ 。
(4)在“性质实验装置”中制备少量硫代硫酸钠( ),该装置中装有
),该装置中装有 、
、 混合液,发生的反应为
混合液,发生的反应为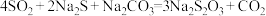 ,通入
,通入 的过程中,数字传感器测得溶液中
的过程中,数字传感器测得溶液中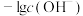 、
、 的质量变化关系如下图:
的质量变化关系如下图: 的生成量曲线为
的生成量曲线为________ (填“甲”或“乙”),曲线乙Q点后出现急剧下降的原因是________ 。
(5)化学反应速率不仅影响生产,还影响人们的生活质量,写出生活中减缓化学反应速率的一种应用________ 。
 制的尾气,某同学对实验室中
制的尾气,某同学对实验室中 制备与性质实验的尾气采用
制备与性质实验的尾气采用 溶液吸收,装置如下:
溶液吸收,装置如下: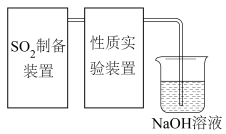
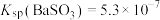 。
。(1)利用85%的浓硫酸和
 ,固体反应制备
,固体反应制备 ,下述“
,下述“ 制备装置”合理的是________。
制备装置”合理的是________。A. | B. | C.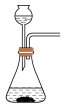 | D.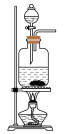 |
(2)
 溶液吸收
溶液吸收 后生成物与反应物的量有关,能生成
后生成物与反应物的量有关,能生成 或
或 。
。某同学查阅资料:常温时,
 ,
,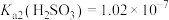 。
。某次实验结束后,该同学通过数字实验,用pH传感器测得吸收液的
 (常温),则该混合液中含硫物种物质的量浓度最大的是
(常温),则该混合液中含硫物种物质的量浓度最大的是(3)“性质实验装置”中将
 通入到
通入到 的
的 溶液中,生成白色沉淀,通过化学平衡常数计算,确定该沉淀不是
溶液中,生成白色沉淀,通过化学平衡常数计算,确定该沉淀不是 沉淀:
沉淀: ,若忽略空气中
,若忽略空气中 的影响,则该性质实验中生成
的影响,则该性质实验中生成 的离子方程式是
的离子方程式是 ,而不是
,而不是 :
:(4)在“性质实验装置”中制备少量硫代硫酸钠(
 ),该装置中装有
),该装置中装有 、
、 混合液,发生的反应为
混合液,发生的反应为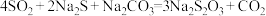 ,通入
,通入 的过程中,数字传感器测得溶液中
的过程中,数字传感器测得溶液中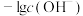 、
、 的质量变化关系如下图:
的质量变化关系如下图:
 的生成量曲线为
的生成量曲线为(5)化学反应速率不仅影响生产,还影响人们的生活质量,写出生活中减缓化学反应速率的一种应用
您最近一年使用:0次
解题方法
5 . 过氧化氢是淡蓝色的黏稠液体,可。与水以任意比例混溶,是一种强氧化剂。其一般以30%~60%的水溶液形式存放,水溶液俗称双氧水,适用于医用伤口消毒,环境消毒和食品消毒等。回答下列问题:
(1)实验室中利用反应2H2O2 2H2O+O2↑制取O2,可选用的发生装置是
2H2O+O2↑制取O2,可选用的发生装置是___________ (填字母,下同),收集O2可选用的装置是___________ (填字母)。___________ mL(保留三位有效数字)。
(3)过氧化氢是一种二元弱酸,写出H2O2的第一步电离方程式:___________
(4)某课外兴趣小组欲探究温度对H2O2电离平衡的影响,进行如下实验:
①实验任务:利用灵敏pH计测量溶液的pH,并探究电离过程是否吸热。
②查阅资料:20℃时,Ka1(H2O2)=2.4×10-12,lg6≈0.778。
③提出猜想:反应物浓度相同时;温度越高,酸性越强,pH越小。
④设计实验、验证猜想。取试样进行表正实验1~3,记录数据。
⑤数据分析、交流讨论。
实验结果:X2<X1<X3且X1=___________ ,测得pH数据中能证明上述猜想的是___________ (用X1、X2、X3的大小关系表示);pH出现X1<X3的原因是___________ 。
⑥优化实验。在20℃下进行下列实验:
若实验中测得△T1___________ △T2(填“>”或“<”),则说明H2O2电离过程吸热。
(1)实验室中利用反应2H2O2
 2H2O+O2↑制取O2,可选用的发生装置是
2H2O+O2↑制取O2,可选用的发生装置是
(3)过氧化氢是一种二元弱酸,写出H2O2的第一步电离方程式:
(4)某课外兴趣小组欲探究温度对H2O2电离平衡的影响,进行如下实验:
①实验任务:利用灵敏pH计测量溶液的pH,并探究电离过程是否吸热。
②查阅资料:20℃时,Ka1(H2O2)=2.4×10-12,lg6≈0.778。
③提出猜想:反应物浓度相同时;温度越高,酸性越强,pH越小。
④设计实验、验证猜想。取试样进行表正实验1~3,记录数据。
| 试祥 | 温度/℃ | pH | |
| 1 | 10mL1.5mol/L的双氧水 | 20 | X1 |
| 2 | 10mL1.5mol/L的双氧水 | 30 | X2 |
| 3 | 10mL1.5mol/L的双氧水 | 50 | X3 |
实验结果:X2<X1<X3且X1=
⑥优化实验。在20℃下进行下列实验:
| 试样 | 反应前后温度变化/℃ | |
| 4 | 10mL1.5mol/L的双氧水、10mL1.5mol/L的NaOH溶液 | △T1 |
| 5 | 10mL1.5mol/L的H2SO4溶液10mL1.5mol/L的NaOH溶液 | △T2 |
您最近一年使用:0次
名校
解题方法
6 . 三氯氧磷( )可用作半导体掺杂剂。工业上采用直接氧化法由
)可用作半导体掺杂剂。工业上采用直接氧化法由 制备
制备 ,反应原理为:
,反应原理为: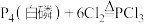 ,
, 。
。
已知: 、
、 的部分性质如下:
的部分性质如下:
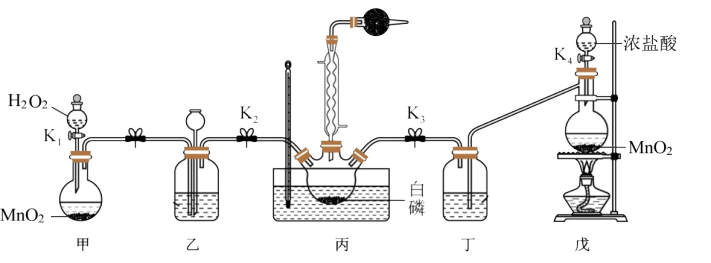
某实验小组模拟该工艺设计实验装置如图(部分加热和夹持装置已略去):___________ 。
(2)装置乙的主要作用为:①干燥气体,②___________ ,③___________ 。
(3)装置丙的温度需控制在60-65°℃的原因是___________ 。
(4)提纯 (含少量杂质
(含少量杂质 ),可采用的方法是
),可采用的方法是___________ 。
(5) 遇水生成弱电解质亚磷酸
遇水生成弱电解质亚磷酸 ,已知
,已知 与过量NaOH反应生成
与过量NaOH反应生成 。
。
①写出 的电离方程式:
的电离方程式:___________ 。
② 溶液中,各离子浓度由大到小的顺序为
溶液中,各离子浓度由大到小的顺序为___________ 。
(6)通过测定三氯氧磷产品中Cl元素含量,可进一步计算产品的纯度,实验步骤如下:
I.取mg产品于锥形瓶中,加入足量NaOH溶液,待水解完全后滴加稀硝酸至酸性;
Ⅱ.向锥形瓶中加入 溶液至
溶液至 完全沉淀;
完全沉淀;
Ⅲ.向其中加入少量硝基苯,用力摇动,使沉淀表面被有机物覆盖;
Ⅳ.加入指示剂,用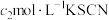 溶液进行滴定,至终点时消耗KSCN溶液
溶液进行滴定,至终点时消耗KSCN溶液 。
。
(已知: 溶于酸,AgSCN是白色沉淀;
溶于酸,AgSCN是白色沉淀;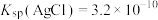 ,
,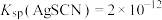 )
)
①步骤Ⅳ中选用的指示剂为___________ 。
A. B.
B. C.淀粉 D.甲基橙
C.淀粉 D.甲基橙
②产品中氯元素的百分含量表达式为:___________ 。
③下列操作会使测得的氯元素含量偏小的是___________ 。
A.配制 标准溶液时仰视容量瓶刻度线
标准溶液时仰视容量瓶刻度线
B.实验过程中未加入硝基苯
C.滴定前滴定管尖嘴处有气泡,滴定后无气泡
D.滴定时锥形瓶未干燥
 )可用作半导体掺杂剂。工业上采用直接氧化法由
)可用作半导体掺杂剂。工业上采用直接氧化法由 制备
制备 ,反应原理为:
,反应原理为: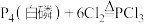 ,
, 。
。已知:
 、
、 的部分性质如下:
的部分性质如下:| 熔点/℃ | 沸点/℃ | 其它 | |
 | -112 | 75.5 |  和 和 互溶,均为无色液体,遇水均剧烈水解 互溶,均为无色液体,遇水均剧烈水解 |
 | 2 | 105.3 |
(2)装置乙的主要作用为:①干燥气体,②
(3)装置丙的温度需控制在60-65°℃的原因是
(4)提纯
 (含少量杂质
(含少量杂质 ),可采用的方法是
),可采用的方法是(5)
 遇水生成弱电解质亚磷酸
遇水生成弱电解质亚磷酸 ,已知
,已知 与过量NaOH反应生成
与过量NaOH反应生成 。
。①写出
 的电离方程式:
的电离方程式:②
 溶液中,各离子浓度由大到小的顺序为
溶液中,各离子浓度由大到小的顺序为(6)通过测定三氯氧磷产品中Cl元素含量,可进一步计算产品的纯度,实验步骤如下:
I.取mg产品于锥形瓶中,加入足量NaOH溶液,待水解完全后滴加稀硝酸至酸性;
Ⅱ.向锥形瓶中加入
 溶液至
溶液至 完全沉淀;
完全沉淀;Ⅲ.向其中加入少量硝基苯,用力摇动,使沉淀表面被有机物覆盖;
Ⅳ.加入指示剂,用
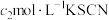 溶液进行滴定,至终点时消耗KSCN溶液
溶液进行滴定,至终点时消耗KSCN溶液 。
。(已知:
 溶于酸,AgSCN是白色沉淀;
溶于酸,AgSCN是白色沉淀;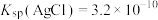 ,
,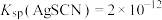 )
)①步骤Ⅳ中选用的指示剂为
A.
 B.
B. C.淀粉 D.甲基橙
C.淀粉 D.甲基橙②产品中氯元素的百分含量表达式为:
③下列操作会使测得的氯元素含量偏小的是
A.配制
 标准溶液时仰视容量瓶刻度线
标准溶液时仰视容量瓶刻度线B.实验过程中未加入硝基苯
C.滴定前滴定管尖嘴处有气泡,滴定后无气泡
D.滴定时锥形瓶未干燥
您最近一年使用:0次
解题方法
7 . CuCl是见光容易分解的白色固体,难溶于水和乙醇,在潮湿的环境中易被氧化和水解。实验室制备CuCl的实验装置如下图所示,制取步骤如下:
①组装好整套实验装置,称取 的
的 晶体,加适量煮沸后冷却的蒸馏水,使固体全部溶解,将其置于A装置中;
晶体,加适量煮沸后冷却的蒸馏水,使固体全部溶解,将其置于A装置中;
②在 左右向A装置中通入
左右向A装置中通入 气体,搅拌;
气体,搅拌;
③当A中溶液全部褪色,停止通 气体;
气体;
④实验结束后,先向A装置中加入适量蒸馏水,减压过滤(需避光),可得到CuCl粗产品;
⑤用乙醇洗涤CuCl粗产品,将产品在双层干燥器(分别装有浓硫酸和碱石灰)中干燥34h,再经氢气流干燥,最后进行真空干燥,得到产品质量为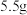 。
。
已知CuCl在溶液中存在如下平衡: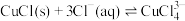 (aq,无色)。
(aq,无色)。
(1)基态S原子核外电子一共有________ 种不同的空间运动状态;液态 能发生自偶电离
能发生自偶电离 ,与
,与 互为等电子体的分子有
互为等电子体的分子有________ (写化学式,任写一种即可)。
(2)装置A的名称是________ ,多孔玻璃泡的作用是________________________ 。
(3)步骤②涉及的离子方程式为___________________________________ 。
(4)步骤④中,加入适量蒸馏水的目的是________________________________ 。
(5)步骤⑤用乙醇洗涤CuCl粗产品的原因是_______________________ 。
(6)本实验的产率是________ (保留3位有效数字)。
(7)假设在 下:
下:
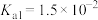 ,
, ,
, 且
且 ,测得反应后烧杯中的溶液
,测得反应后烧杯中的溶液 ,则烧杯中所发生的离子方程式为
,则烧杯中所发生的离子方程式为________________________ 。
①组装好整套实验装置,称取
 的
的 晶体,加适量煮沸后冷却的蒸馏水,使固体全部溶解,将其置于A装置中;
晶体,加适量煮沸后冷却的蒸馏水,使固体全部溶解,将其置于A装置中;②在
 左右向A装置中通入
左右向A装置中通入 气体,搅拌;
气体,搅拌;③当A中溶液全部褪色,停止通
 气体;
气体;④实验结束后,先向A装置中加入适量蒸馏水,减压过滤(需避光),可得到CuCl粗产品;
⑤用乙醇洗涤CuCl粗产品,将产品在双层干燥器(分别装有浓硫酸和碱石灰)中干燥34h,再经氢气流干燥,最后进行真空干燥,得到产品质量为
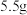 。
。已知CuCl在溶液中存在如下平衡:
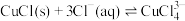 (aq,无色)。
(aq,无色)。
(1)基态S原子核外电子一共有
 能发生自偶电离
能发生自偶电离 ,与
,与 互为等电子体的分子有
互为等电子体的分子有(2)装置A的名称是
(3)步骤②涉及的离子方程式为
(4)步骤④中,加入适量蒸馏水的目的是
(5)步骤⑤用乙醇洗涤CuCl粗产品的原因是
(6)本实验的产率是
(7)假设在
 下:
下:
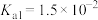 ,
, ,
, 且
且 ,测得反应后烧杯中的溶液
,测得反应后烧杯中的溶液 ,则烧杯中所发生的离子方程式为
,则烧杯中所发生的离子方程式为
您最近一年使用:0次
8 . 碳酸亚铁( )是生产补血剂的重要原料,制取
)是生产补血剂的重要原料,制取 过程中涉及以下实验。
过程中涉及以下实验。
实验一:为探究某固体化合物X(仅含有三种元素)的组成和性质,设计并完成如下实验

已知:气体甲、气体乙均为短周期元素的单质。
请回答:
(1)化合物X含有的元素为___________ (写元素符号),化合物A的化学式为___________ 。写出A溶于足量稀硝酸的化学反应方程式为___________ 。
实验二:如图装置利用实验一所得溶液B制取 (白色固体,难溶于水):
(白色固体,难溶于水):

装置丙中,先将导管移出液面通入一段时间气体,再向 溶液(
溶液( )通入一段时间
)通入一段时间 至其pH为7,滴加一定量B溶液产生白色沉淀和无色气体,过滤、洗涤、干燥,得到
至其pH为7,滴加一定量B溶液产生白色沉淀和无色气体,过滤、洗涤、干燥,得到 固体。请回答:
固体。请回答:
(2)丙装置的反应仪器名称是___________ 。试剂a是___________ 。
(3)向 溶液通入
溶液通入 的目的是
的目的是___________ 。
(4)常温下,向 溶液(
溶液( )通入一段时间
)通入一段时间 至
至 时溶液中
时溶液中
___________ (已知 的
的 ,
, )。
)。
(5)丙装置中制取 的离子方程式为
的离子方程式为___________ 。
(6)检验溶液B中的金属阳离子可选用下列哪些试剂___________。
(7)100mL0.8mol/LB溶液完全反应,最终得到8.2克 固体,则产率为
固体,则产率为___________ (结果保留2位小数)。
 )是生产补血剂的重要原料,制取
)是生产补血剂的重要原料,制取 过程中涉及以下实验。
过程中涉及以下实验。实验一:为探究某固体化合物X(仅含有三种元素)的组成和性质,设计并完成如下实验

已知:气体甲、气体乙均为短周期元素的单质。
请回答:
(1)化合物X含有的元素为
实验二:如图装置利用实验一所得溶液B制取
 (白色固体,难溶于水):
(白色固体,难溶于水):
装置丙中,先将导管移出液面通入一段时间气体,再向
 溶液(
溶液( )通入一段时间
)通入一段时间 至其pH为7,滴加一定量B溶液产生白色沉淀和无色气体,过滤、洗涤、干燥,得到
至其pH为7,滴加一定量B溶液产生白色沉淀和无色气体,过滤、洗涤、干燥,得到 固体。请回答:
固体。请回答:(2)丙装置的反应仪器名称是
(3)向
 溶液通入
溶液通入 的目的是
的目的是(4)常温下,向
 溶液(
溶液( )通入一段时间
)通入一段时间 至
至 时溶液中
时溶液中
 的
的 ,
, )。
)。(5)丙装置中制取
 的离子方程式为
的离子方程式为(6)检验溶液B中的金属阳离子可选用下列哪些试剂___________。
| A.酸性高锰酸钾溶液 | B.NaOH |
C. | D.KSCN |
 固体,则产率为
固体,则产率为
您最近一年使用:0次
9 . 回答下列问题:
(1)已知 时,水的离子积常数
时,水的离子积常数 ,该温度下测得
,该温度下测得 溶液的
溶液的 。则
。则
___________ 25℃(填“>”、“<”或“=”)。 在水溶液中的电离方程式为
在水溶液中的电离方程式为___________ 。
(2)已知氢氟酸、次氯酸、碳酸在室温下的电离常数分别为:
根据上述数据,回答下列问题:
①比较同浓度的 、
、 溶液的
溶液的 值大小:
值大小:
___________  。(填“>”、“<”或“=”)
。(填“>”、“<”或“=”)
②少量的 通入
通入 溶液中,写出反应的离子方程式
溶液中,写出反应的离子方程式___________ 。
(3)用氧化还原滴定方法测定粗品中Na2S2O3•5H2O的质量分数(Na2S2O3•5H2O的式量为248)。
实验步骤:称取6g粗品配制250mL的溶液待用。用酸式滴定管取25.00mL0.01mol•L-1K2Cr2O7溶液于锥形瓶中,然后加入过量的KI溶液并酸化,加几滴淀粉溶液,立即用配制的Na2S2O3溶液滴定至终点(反应为I2+2S2O =2I-+S4O
=2I-+S4O ),消耗Na2S2O3溶液25.00mL。
),消耗Na2S2O3溶液25.00mL。
回答下列问题:
①向K2Cr2O7溶液中加入过量的KI溶液并酸化,Cr2O 被还原成Cr3+,写出该反应的离子方程式:
被还原成Cr3+,写出该反应的离子方程式:___________ 。
②用Na2S2O3溶液滴定至终点的现象为___________ 。
③粗品中Na2S2O3•5H2O的质量分数为___________ 。
④若在取K2Cr2O7溶液时有部分溶液滴到了锥形瓶外。则测定结果______ (填“偏高”“偏低”或“不变”)。
(1)已知
 时,水的离子积常数
时,水的离子积常数 ,该温度下测得
,该温度下测得 溶液的
溶液的 。则
。则
 在水溶液中的电离方程式为
在水溶液中的电离方程式为(2)已知氢氟酸、次氯酸、碳酸在室温下的电离常数分别为:
 | 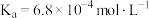 |
 |  |
 |   |
①比较同浓度的
 、
、 溶液的
溶液的 值大小:
值大小:
 。(填“>”、“<”或“=”)
。(填“>”、“<”或“=”)②少量的
 通入
通入 溶液中,写出反应的离子方程式
溶液中,写出反应的离子方程式(3)用氧化还原滴定方法测定粗品中Na2S2O3•5H2O的质量分数(Na2S2O3•5H2O的式量为248)。
实验步骤:称取6g粗品配制250mL的溶液待用。用酸式滴定管取25.00mL0.01mol•L-1K2Cr2O7溶液于锥形瓶中,然后加入过量的KI溶液并酸化,加几滴淀粉溶液,立即用配制的Na2S2O3溶液滴定至终点(反应为I2+2S2O
 =2I-+S4O
=2I-+S4O ),消耗Na2S2O3溶液25.00mL。
),消耗Na2S2O3溶液25.00mL。回答下列问题:
①向K2Cr2O7溶液中加入过量的KI溶液并酸化,Cr2O
 被还原成Cr3+,写出该反应的离子方程式:
被还原成Cr3+,写出该反应的离子方程式:②用Na2S2O3溶液滴定至终点的现象为
③粗品中Na2S2O3•5H2O的质量分数为
④若在取K2Cr2O7溶液时有部分溶液滴到了锥形瓶外。则测定结果
您最近一年使用:0次
名校
10 . NaClO溶液具有漂白能力,已知25℃时, ,向含有NaOH的NaClO溶液中逐滴滴入
,向含有NaOH的NaClO溶液中逐滴滴入 溶液,滴加过程中溶液的pH随
溶液,滴加过程中溶液的pH随 溶液的体积的变化曲线及实验现象见下表。
溶液的体积的变化曲线及实验现象见下表。
(1)NaClO的电子式是_____ ,次氯酸钠溶液中离子浓度大小顺序是:_____ 。
(2)下列关于NaClO溶液说法正确的是_____(双选)。
(3)25℃, 的NaClO和HClO的混合溶液中,[HClO]
的NaClO和HClO的混合溶液中,[HClO]_____ 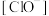 (填<,>或=)。
(填<,>或=)。
(4)A→B,C→D过程溶液的pH值下降的原因可用下面的方程式来解释,请推测方框里的物质并在横线上写出完整的方程式并配平:
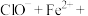


 。
。
①_____ 。
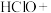


 +
+ 。
。
②_____ 。
(5)已知
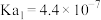 ,
,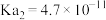 ,少量
,少量 通入NaClO溶液中发生的离子反应方程式为:
通入NaClO溶液中发生的离子反应方程式为:_____ 。
 ,向含有NaOH的NaClO溶液中逐滴滴入
,向含有NaOH的NaClO溶液中逐滴滴入 溶液,滴加过程中溶液的pH随
溶液,滴加过程中溶液的pH随 溶液的体积的变化曲线及实验现象见下表。
溶液的体积的变化曲线及实验现象见下表。| 变化曲线 | 实验现象 |
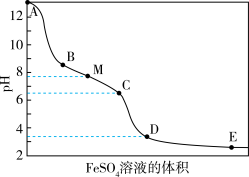 | ⅰ.A→B产生红褐色沉淀 ⅱ.B→C红褐色沉淀的量增多 ⅲ.C→D红褐色沉淀的量增多 ⅳ.D点附近产生有刺激性气味的气体 ⅴ.D→E红褐色沉淀的量略有增多 |
(2)下列关于NaClO溶液说法正确的是_____(双选)。
A.0.01mol/L溶液中, |
B.长期露置在空气中,释放 ,漂白能力减弱 ,漂白能力减弱 |
C.通入过量 ,反应的离子方程式为 ,反应的离子方程式为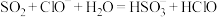 |
D.25℃, 的NaClO和HClO的混合溶液中, 的NaClO和HClO的混合溶液中, |
 的NaClO和HClO的混合溶液中,[HClO]
的NaClO和HClO的混合溶液中,[HClO]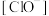 (填<,>或=)。
(填<,>或=)。(4)A→B,C→D过程溶液的pH值下降的原因可用下面的方程式来解释,请推测方框里的物质并在横线上写出完整的方程式并配平:
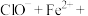


 。
。①
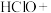


 +
+ 。
。②
(5)已知

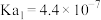 ,
,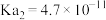 ,少量
,少量 通入NaClO溶液中发生的离子反应方程式为:
通入NaClO溶液中发生的离子反应方程式为:
您最近一年使用:0次



