1 . 高氯酸三碳酰肼合镍 是一种新型的起爆药,回答下列问题:
是一种新型的起爆药,回答下列问题:
(1)基态Ni原子的电子排布式为_______ 。
(2)基态碳原子核外电子有_______ 种不同运动状态。
(3) 的中心原子的价层电子对数为
的中心原子的价层电子对数为_______ , 的VSEPR模型是
的VSEPR模型是_______ 。
(4)化学式中的CHZ为碳酰肼,其结构为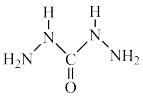 ,是一种新型的环保锅炉水除氧剂:
,是一种新型的环保锅炉水除氧剂:
①CHZ中氮原子的杂化轨道类型为_______ 。
②1molCHZ中含有的σ键数目为_______ NA。
③键角:
_______ (填“>”“<”或“=”) 。
。
(5)常温下, 的HClO溶液的pH约为
的HClO溶液的pH约为_______ [已知: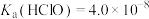 ,
, ]。
]。
 是一种新型的起爆药,回答下列问题:
是一种新型的起爆药,回答下列问题:(1)基态Ni原子的电子排布式为
(2)基态碳原子核外电子有
(3)
 的中心原子的价层电子对数为
的中心原子的价层电子对数为 的VSEPR模型是
的VSEPR模型是(4)化学式中的CHZ为碳酰肼,其结构为
 ,是一种新型的环保锅炉水除氧剂:
,是一种新型的环保锅炉水除氧剂:①CHZ中氮原子的杂化轨道类型为
②1molCHZ中含有的σ键数目为
③键角:

 。
。(5)常温下,
 的HClO溶液的pH约为
的HClO溶液的pH约为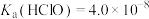 ,
, ]。
]。
您最近一年使用:0次
名校
解题方法
2 . 回答下列问题:
(1)已知PH3与NH3结构相似,PH3的电子式___________ ,键角PH3___________ NH3(填“大于”“小于”“等于”,下同),热稳定性:PH3___________ NH3。
(2)Fe、Ni元素性质非常相似,属于铁系元素,得到广泛应用。
①Fe元素位于元素周期表的___________ 区(填分区)。
②基态Ni3+核外电子排布式为___________ 。
(3)鉴定Ni2+的特征反应是将丁二酮肟加入Ni2+盐溶液中,生成鲜红色的螯合物M,M结构如下图所示:

①组成M的五种元素中,除H元素外,另外四种元素第一电离能由大到小的顺序为___________ (填元素符号),
②图中各微粒间不存在的作用力有___________ (填标号)。
a. 配位键 b.极性键 c.非极性键 d.π键 e.离子键 f.氢键
(4)如图为H3BO3晶体的片层结构,其中B的杂化方式为___________ 。
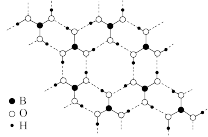
(5)硼酸(H3BO3)为一元弱酸,电离方程式H3BO3+H2O⇌H++B(OH) 。已知:H3BO3的电离常数Ka=5.8×10﹣10,H2CO3的电离常数Ka1=4.4×10﹣7、Ka2=4.7×10﹣11,向饱和硼酸溶液中滴加少量Na2CO3溶液,写出发生反应的离子方程式
。已知:H3BO3的电离常数Ka=5.8×10﹣10,H2CO3的电离常数Ka1=4.4×10﹣7、Ka2=4.7×10﹣11,向饱和硼酸溶液中滴加少量Na2CO3溶液,写出发生反应的离子方程式___________ 。
(1)已知PH3与NH3结构相似,PH3的电子式
(2)Fe、Ni元素性质非常相似,属于铁系元素,得到广泛应用。
①Fe元素位于元素周期表的
②基态Ni3+核外电子排布式为
(3)鉴定Ni2+的特征反应是将丁二酮肟加入Ni2+盐溶液中,生成鲜红色的螯合物M,M结构如下图所示:

①组成M的五种元素中,除H元素外,另外四种元素第一电离能由大到小的顺序为
②图中各微粒间不存在的作用力有
a. 配位键 b.极性键 c.非极性键 d.π键 e.离子键 f.氢键
(4)如图为H3BO3晶体的片层结构,其中B的杂化方式为

(5)硼酸(H3BO3)为一元弱酸,电离方程式H3BO3+H2O⇌H++B(OH)
 。已知:H3BO3的电离常数Ka=5.8×10﹣10,H2CO3的电离常数Ka1=4.4×10﹣7、Ka2=4.7×10﹣11,向饱和硼酸溶液中滴加少量Na2CO3溶液,写出发生反应的离子方程式
。已知:H3BO3的电离常数Ka=5.8×10﹣10,H2CO3的电离常数Ka1=4.4×10﹣7、Ka2=4.7×10﹣11,向饱和硼酸溶液中滴加少量Na2CO3溶液,写出发生反应的离子方程式
您最近一年使用:0次
3 . Ⅰ.磷化铝(AlP)和磷化氢( )都是粮食储备常用的高效熏蒸杀虫剂。回答下列问题:
)都是粮食储备常用的高效熏蒸杀虫剂。回答下列问题:
(1)上述两种物质中所涉及的三种元素的第一电离能由大到小的顺序为___________ (填元素符号)。
(2)磷化氢( )在常温下是一种无色有大蒜臭味的有毒气体。以下关于
)在常温下是一种无色有大蒜臭味的有毒气体。以下关于 的说法正确的是___________(填序号)。
的说法正确的是___________(填序号)。
(3)工业制备 的流程如图所示:
的流程如图所示:

①黄磷和烧碱溶液反应的离子方程式为___________ ,次磷酸属于___________ (填“一”“二”或“三”)元酸。
②若开始时有 参加反应,则整个工业流程中转移的电子数为
参加反应,则整个工业流程中转移的电子数为___________ 。
(4) 的键角
的键角___________  (填“大于”或“小于”),原因为
(填“大于”或“小于”),原因为___________ 。
(5)已知亚磷酸( )为二元弱酸,其溶液中含磷粒子的物质的量分数与pH的关系如图所示。
)为二元弱酸,其溶液中含磷粒子的物质的量分数与pH的关系如图所示。

下列说法正确的是___________(填字母序号)。
 )都是粮食储备常用的高效熏蒸杀虫剂。回答下列问题:
)都是粮食储备常用的高效熏蒸杀虫剂。回答下列问题:(1)上述两种物质中所涉及的三种元素的第一电离能由大到小的顺序为
(2)磷化氢(
 )在常温下是一种无色有大蒜臭味的有毒气体。以下关于
)在常温下是一种无色有大蒜臭味的有毒气体。以下关于 的说法正确的是___________(填序号)。
的说法正确的是___________(填序号)。A. 是由极性键组成的非极性分子 是由极性键组成的非极性分子 |
B. 的相对分子质量大于 的相对分子质量大于 ,所以沸点高于的 ,所以沸点高于的 |
| C.中心原子的VSEPR构型是四面体形 |
D. 的稳定性大于 的稳定性大于 是因为分子间存在氢键 是因为分子间存在氢键 |
 的流程如图所示:
的流程如图所示:
①黄磷和烧碱溶液反应的离子方程式为
②若开始时有
 参加反应,则整个工业流程中转移的电子数为
参加反应,则整个工业流程中转移的电子数为(4)
 的键角
的键角 (填“大于”或“小于”),原因为
(填“大于”或“小于”),原因为(5)已知亚磷酸(
 )为二元弱酸,其溶液中含磷粒子的物质的量分数与pH的关系如图所示。
)为二元弱酸,其溶液中含磷粒子的物质的量分数与pH的关系如图所示。
下列说法正确的是___________(填字母序号)。
A. 的电离方程式为 的电离方程式为 |
B. 是正盐 是正盐 |
C. 溶液显碱性 溶液显碱性 |
D. 的平衡常数为 的平衡常数为 |
您最近一年使用:0次
4 . 按要求完成下列问题。
(1)某温度(t℃)时水的图象如图所示,a点离子积K=_______ ,在该温度下, 的溶液显
的溶液显_______ 性(填“酸”“碱”或“中”);在该温度下,将 的苛性钠溶液V1L与
的苛性钠溶液V1L与 的稀硫酸V2L混合(设混合后溶液的体积为原两溶液体积之和),所得混合溶液的
的稀硫酸V2L混合(设混合后溶液的体积为原两溶液体积之和),所得混合溶液的 ,则
,则
_______ 。

(2)25℃时,向 氨水中加入少量
氨水中加入少量 固体,当固体溶解后,测得溶液pH会
固体,当固体溶解后,测得溶液pH会_______ 。(填“增大”“减小”或“不变”)
(3)25℃时,等浓度的 溶液和
溶液和 溶液等体积混合,
溶液等体积混合, ,则混合溶液中各种离子浓度大小关系为
,则混合溶液中各种离子浓度大小关系为_______ 。
(4)已知:HClO的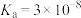 ,
, 的
的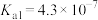 ,
, ,写出往NaClO溶液中通入少量
,写出往NaClO溶液中通入少量 的离子方程式:
的离子方程式:_______ 。
(1)某温度(t℃)时水的图象如图所示,a点离子积K=
 的溶液显
的溶液显 的苛性钠溶液V1L与
的苛性钠溶液V1L与 的稀硫酸V2L混合(设混合后溶液的体积为原两溶液体积之和),所得混合溶液的
的稀硫酸V2L混合(设混合后溶液的体积为原两溶液体积之和),所得混合溶液的 ,则
,则

(2)25℃时,向
 氨水中加入少量
氨水中加入少量 固体,当固体溶解后,测得溶液pH会
固体,当固体溶解后,测得溶液pH会(3)25℃时,等浓度的
 溶液和
溶液和 溶液等体积混合,
溶液等体积混合, ,则混合溶液中各种离子浓度大小关系为
,则混合溶液中各种离子浓度大小关系为(4)已知:HClO的
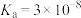 ,
, 的
的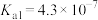 ,
, ,写出往NaClO溶液中通入少量
,写出往NaClO溶液中通入少量 的离子方程式:
的离子方程式:
您最近一年使用:0次
2022-06-23更新
|
104次组卷
|
2卷引用:云南省弥勒市第一中学2021-2022学年高二下学期第一次月考化学试题
5 . 硫的化合物在工业中用途广泛。 是一种重要的溶剂。工业上可以利用硫黄(
是一种重要的溶剂。工业上可以利用硫黄( )与
)与 为原料制备
为原料制备 ,
, 时
时 受热分解成气态
受热分解成气态 ,发生反应
,发生反应 。
。
完成下列填空:
(1) 和
和 互称为
互称为___________ ;硫原子最外层未成对电子中运动状态不相同的方面是___________ 。
(2)反应所涉及的各物质中,属于极性分子的电子式为___________ 。列举一个能比较硫元素与碳元素非金属性相对强弱的实验事实:___________ 。常温下,用 的
的 溶液处理工业尾气中的
溶液处理工业尾气中的 ,吸收过程中
,吸收过程中 的使用率(
的使用率( )与溶液
)与溶液 的关系如图所示(溶液体积与温度均保持不变)。
的关系如图所示(溶液体积与温度均保持不变)。

(3)a点时,溶液中
___________  。已知到b点时吸收了标准状况下
。已知到b点时吸收了标准状况下 尾气,则尾气中
尾气,则尾气中 的体积分数为
的体积分数为___________ (尾气中其他成分不反应)。
(4)当 的使用率达到
的使用率达到 时,溶液
时,溶液 为4.4,分析原因:
为4.4,分析原因:___________ 。
(5)用硫酸酸化的 ,溶液处理
,溶液处理 气体,会析出铬钾矾
气体,会析出铬钾矾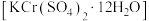 晶体。写出相关反应的化学方程式。
晶体。写出相关反应的化学方程式。___________
 是一种重要的溶剂。工业上可以利用硫黄(
是一种重要的溶剂。工业上可以利用硫黄( )与
)与 为原料制备
为原料制备 ,
, 时
时 受热分解成气态
受热分解成气态 ,发生反应
,发生反应 。
。完成下列填空:
(1)
 和
和 互称为
互称为(2)反应所涉及的各物质中,属于极性分子的电子式为
 的
的 溶液处理工业尾气中的
溶液处理工业尾气中的 ,吸收过程中
,吸收过程中 的使用率(
的使用率( )与溶液
)与溶液 的关系如图所示(溶液体积与温度均保持不变)。
的关系如图所示(溶液体积与温度均保持不变)。
(3)a点时,溶液中

 。已知到b点时吸收了标准状况下
。已知到b点时吸收了标准状况下 尾气,则尾气中
尾气,则尾气中 的体积分数为
的体积分数为(4)当
 的使用率达到
的使用率达到 时,溶液
时,溶液 为4.4,分析原因:
为4.4,分析原因:(5)用硫酸酸化的
 ,溶液处理
,溶液处理 气体,会析出铬钾矾
气体,会析出铬钾矾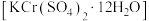 晶体。写出相关反应的化学方程式。
晶体。写出相关反应的化学方程式。
您最近一年使用:0次
2022-06-12更新
|
210次组卷
|
2卷引用:上海市虹口区2021-2022学年高三下学期学习能力诊断测试化学试题
6 . I.次磷酸( )是一种精细化工产品。
)是一种精细化工产品。
(1) 溶液中的含磷微粒只有
溶液中的含磷微粒只有 和
和 ,则该溶液呈
,则该溶液呈_______ 性(填“酸”“碱”或“中”)。
(2)25℃时, 溶液和盐酸的物质的量浓度相同。加水稀释至相同的pH,此时加入
溶液和盐酸的物质的量浓度相同。加水稀释至相同的pH,此时加入 溶液中水的体积
溶液中水的体积_______ (填“大于”“小于”或“等于”)加入盐酸中水的体积。
II.
(3)硅元素可形成多种晶体。
①硅与氯、溴结合能形成 、
、 ,沸点较高的是
,沸点较高的是_______ 。
②晶体Si和晶体SiC结构相似,熔点较低的是_______ 。
(4)某化合物具有超导性,其晶胞结构如图所示,则该化合物的化学式为_______ ,1个Mg与_______ 个Ni等距离且最近。

III.为了达到碳中和,研发二氧化碳、烃类等物质的利用技术已成为科研热点。
(5)



则

_______ (用 、
、 表示)。
表示)。
(6)已知反应:
 。将1molCO和2mol
。将1molCO和2mol 充入1L恒容密闭容器中,在一定条件下合成甲醇,相同时间(2min)内测得CO的转化率与温度的对应关系如图所示:
充入1L恒容密闭容器中,在一定条件下合成甲醇,相同时间(2min)内测得CO的转化率与温度的对应关系如图所示:
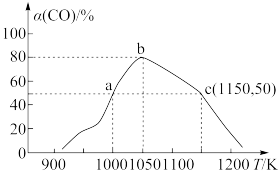
①试求温度为1000K条件下,反应开始至2min时,
_______ 。
②已知c点时容器内的压强为p,则在1150K温度下该反应的压强平衡常数 为
为_______ ( 是用各气体物质的分压替代浓度来计算的平衡常数)。
是用各气体物质的分压替代浓度来计算的平衡常数)。
 )是一种精细化工产品。
)是一种精细化工产品。(1)
 溶液中的含磷微粒只有
溶液中的含磷微粒只有 和
和 ,则该溶液呈
,则该溶液呈(2)25℃时,
 溶液和盐酸的物质的量浓度相同。加水稀释至相同的pH,此时加入
溶液和盐酸的物质的量浓度相同。加水稀释至相同的pH,此时加入 溶液中水的体积
溶液中水的体积II.
(3)硅元素可形成多种晶体。
①硅与氯、溴结合能形成
 、
、 ,沸点较高的是
,沸点较高的是②晶体Si和晶体SiC结构相似,熔点较低的是
(4)某化合物具有超导性,其晶胞结构如图所示,则该化合物的化学式为

III.为了达到碳中和,研发二氧化碳、烃类等物质的利用技术已成为科研热点。
(5)




则


 、
、 表示)。
表示)。(6)已知反应:

 。将1molCO和2mol
。将1molCO和2mol 充入1L恒容密闭容器中,在一定条件下合成甲醇,相同时间(2min)内测得CO的转化率与温度的对应关系如图所示:
充入1L恒容密闭容器中,在一定条件下合成甲醇,相同时间(2min)内测得CO的转化率与温度的对应关系如图所示:
①试求温度为1000K条件下,反应开始至2min时,

②已知c点时容器内的压强为p,则在1150K温度下该反应的压强平衡常数
 为
为 是用各气体物质的分压替代浓度来计算的平衡常数)。
是用各气体物质的分压替代浓度来计算的平衡常数)。
您最近一年使用:0次
7 . 过二硫酸钠(Na2S2O8)具有强氧化性,常用于处理水体中的有机污染物。
(1) 的结构如图1所示,用“□”标识出
的结构如图1所示,用“□”标识出 中体现强氧化性的基团:
中体现强氧化性的基团:___ 。

(2)Fe2+可活化 ,活化后产生
,活化后产生 。
。 氧化性更强,降解废水中有机污染物的能力更强。Fe2+活化
氧化性更强,降解废水中有机污染物的能力更强。Fe2+活化 过程中存在下列反应(k是衡量反应快慢的物理量,k越大,反应越快):
过程中存在下列反应(k是衡量反应快慢的物理量,k越大,反应越快):
Ⅰ: =2
=2 k=2.5×10-9
k=2.5×10-9
Ⅱ: +H2O=
+H2O=  +•OH-+H+ k=2×103
+•OH-+H+ k=2×103
Ⅲ: +Fe2+=Fe3++
+Fe2+=Fe3++ +
+ k=20
k=20
Ⅳ:Fe2++ =Fe3++
=Fe3++ k=4.6×109
k=4.6×109
向含有有机污染物的废水中投放一定量Na2S2O8,再分批加入一定量FeSO4。
①若将FeSO4一次性加入废水中,不利于有机污染物降解。原因是___ 。
②其他条件相同,溶液初始pH对有机物降解率的影响如图2所示。当pH>3时,有机物的降解率随初始pH升高而降低的可能原因是___ 。

(3)CuxFeyOz是一种复合催化剂,可催化活化过二硫酸盐( )产生
)产生 。
。
①该复合催化剂晶胞结构如图3所示(A、B分别为晶胞的 的结构),其化学式为
的结构),其化学式为___ 。

②该复合催化剂活化过二硫酸盐的过程如图4所示。请描述该催化剂参与反应并再生的过程:____ 。

(1)
 的结构如图1所示,用“□”标识出
的结构如图1所示,用“□”标识出 中体现强氧化性的基团:
中体现强氧化性的基团:
(2)Fe2+可活化
 ,活化后产生
,活化后产生 。
。 氧化性更强,降解废水中有机污染物的能力更强。Fe2+活化
氧化性更强,降解废水中有机污染物的能力更强。Fe2+活化 过程中存在下列反应(k是衡量反应快慢的物理量,k越大,反应越快):
过程中存在下列反应(k是衡量反应快慢的物理量,k越大,反应越快):Ⅰ:
 =2
=2 k=2.5×10-9
k=2.5×10-9Ⅱ:
 +H2O=
+H2O=  +•OH-+H+ k=2×103
+•OH-+H+ k=2×103Ⅲ:
 +Fe2+=Fe3++
+Fe2+=Fe3++ +
+ k=20
k=20Ⅳ:Fe2++
 =Fe3++
=Fe3++ k=4.6×109
k=4.6×109向含有有机污染物的废水中投放一定量Na2S2O8,再分批加入一定量FeSO4。
①若将FeSO4一次性加入废水中,不利于有机污染物降解。原因是
②其他条件相同,溶液初始pH对有机物降解率的影响如图2所示。当pH>3时,有机物的降解率随初始pH升高而降低的可能原因是

(3)CuxFeyOz是一种复合催化剂,可催化活化过二硫酸盐(
 )产生
)产生 。
。①该复合催化剂晶胞结构如图3所示(A、B分别为晶胞的
 的结构),其化学式为
的结构),其化学式为
②该复合催化剂活化过二硫酸盐的过程如图4所示。请描述该催化剂参与反应并再生的过程:

您最近一年使用:0次
名校
解题方法
8 . 氮、磷、砷及其化合物在工农业生产等方面有着重要应用。请按要求回答下列问题。
(1)基态砷原子价电子排布图不能写为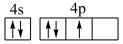 ,是因为该排布方式违背了
,是因为该排布方式违背了___________ 这一原理。
(2)元素第一电离能N___________ P(填“ ”或“
”或“ ”或“
”或“ ”,下同),电负性P
”,下同),电负性P___________ As。
(3)腓( )可用作火箭燃料等,它的沸点远高于乙烯的原因是
)可用作火箭燃料等,它的沸点远高于乙烯的原因是___________ 。
(4)尿素(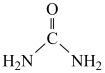 )和
)和 在酸性环境下生成
在酸性环境下生成 、
、 和
和 ,该反应的离子方程式为
,该反应的离子方程式为___________ ; 离子的立体构型(即空间构型)为
离子的立体构型(即空间构型)为___________ 。
(5)GaAs的熔点为1238℃可作半导体材料;而 的熔点为77.9℃。
的熔点为77.9℃。
①预测 的晶体类型为
的晶体类型为___________ 。
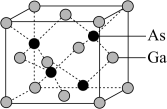
②GaAs晶胞结构如图所示,晶胞边长为a pm。则晶胞中每个Ga原子周围有____ 个紧邻等距的As原子;该晶体的密度为___________  (列出计算式)。
(列出计算式)。
(6)亚砷酸( )可以用于治疗白血病。其在溶液中存在多种微粒形态,将KOH溶液滴入亚砷酸溶液,各种微粒物质的量分数与溶液的pH关系如图所示。
)可以用于治疗白血病。其在溶液中存在多种微粒形态,将KOH溶液滴入亚砷酸溶液,各种微粒物质的量分数与溶液的pH关系如图所示。
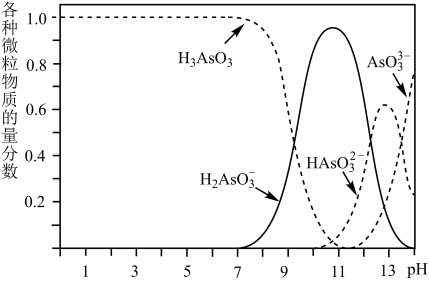
①人体血液的pH在7.35-7.45之间,患者用药后人体中含As元素的主要微粒是___________ 。
② 的第一电离常数
的第一电离常数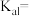
___________ 。
(1)基态砷原子价电子排布图不能写为
 ,是因为该排布方式违背了
,是因为该排布方式违背了(2)元素第一电离能N
 ”或“
”或“ ”或“
”或“ ”,下同),电负性P
”,下同),电负性P(3)腓(
 )可用作火箭燃料等,它的沸点远高于乙烯的原因是
)可用作火箭燃料等,它的沸点远高于乙烯的原因是(4)尿素(
 )和
)和 在酸性环境下生成
在酸性环境下生成 、
、 和
和 ,该反应的离子方程式为
,该反应的离子方程式为 离子的立体构型(即空间构型)为
离子的立体构型(即空间构型)为(5)GaAs的熔点为1238℃可作半导体材料;而
 的熔点为77.9℃。
的熔点为77.9℃。①预测
 的晶体类型为
的晶体类型为②GaAs晶胞结构如图所示,晶胞边长为a pm。则晶胞中每个Ga原子周围有
 (列出计算式)。
(列出计算式)。
(6)亚砷酸(
 )可以用于治疗白血病。其在溶液中存在多种微粒形态,将KOH溶液滴入亚砷酸溶液,各种微粒物质的量分数与溶液的pH关系如图所示。
)可以用于治疗白血病。其在溶液中存在多种微粒形态,将KOH溶液滴入亚砷酸溶液,各种微粒物质的量分数与溶液的pH关系如图所示。
①人体血液的pH在7.35-7.45之间,患者用药后人体中含As元素的主要微粒是
②
 的第一电离常数
的第一电离常数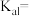
您最近一年使用:0次
2021-04-29更新
|
419次组卷
|
3卷引用:天津市河西区2021届高三下学期总复习质量调查(二)化学试题
名校
解题方法
9 . 一项科学研究成果表明,铜锰氧化物(CuMn2O4)能在常温下催化氧化空气中的一氧化碳和甲醛(HCHO)
(1)向一定物质的量浓度的Cu(NO3)2 和Mn(NO3)2 溶液中加入Na2CO3 溶液,所得沉淀经高温灼烧,可制得CuMn2O4,NO3﹣的空间构型是______________________ (用文字描述).
(2)在铜锰氧化物的催化下,CO 被氧化为CO2,HCHO 被氧化为CO2 和H2O.
①根据等电子体原理,CO 分子的结构式为____________ .
②H2O 分子中O 原子轨道的杂化类型为____________ .
③1mol CO2 中含有的σ键数目为__________________ .
(3)H2SeO3的K1和K2分别为2.7×10﹣3和2.5×10﹣8,H2SeO4第一步几乎完全电离,K2为1.2×10﹣2,请根据结构与性质的关系解释:H2SeO3和H2SeO4第一步电离程度大于第二步电离的原因:_______________________________________ ;
(1)向一定物质的量浓度的Cu(NO3)2 和Mn(NO3)2 溶液中加入Na2CO3 溶液,所得沉淀经高温灼烧,可制得CuMn2O4,NO3﹣的空间构型是
(2)在铜锰氧化物的催化下,CO 被氧化为CO2,HCHO 被氧化为CO2 和H2O.
①根据等电子体原理,CO 分子的结构式为
②H2O 分子中O 原子轨道的杂化类型为
③1mol CO2 中含有的σ键数目为
(3)H2SeO3的K1和K2分别为2.7×10﹣3和2.5×10﹣8,H2SeO4第一步几乎完全电离,K2为1.2×10﹣2,请根据结构与性质的关系解释:H2SeO3和H2SeO4第一步电离程度大于第二步电离的原因:
您最近一年使用:0次
10 . 【化学-物质结构与性质】许多过渡元素(如锰、钒、铬、铁、铜等)的化合物对化学反应具有良好的催化性。回答下列问题:
(1)基态铬原子的价层电子排布式为_________ ;Mn2+的稳定性强于Mn3+,其原因是_______ 。
(2)已知常温下,H2CrO4的K1=4.1、K2=1×10-5,从结构的角度上看,K2<<K1的原因是_________ 。已知Cr2(SO4)3的熔点为100℃、沸点为330℃,则Cr2(SO4)3晶体中微粒间的相互作用力是__________ 。
(3)SO2与氧气在V2O5催化作用下反应可转化为SO3,则转化过程中_____ (填字母)没有发生变化。
a.中心原子轨道杂化类型 b.键角 c.分子的极性
(4)+5价钒能形成多种含氧酸根盐,其中某种钠盐的酸根离子是一种具有无限链状结构的离子(见下图),则该酸根离子的化学式为__________ 。

(5)CuSO4溶液中Cu2+是以[Cu(H2O)4]2+形式存在的,向CuSO4溶液中加入过量氨水后会得到[Cu(NH3)4]2+,则上述两种配离子中稳定性较强的是_________ ,N、O、S、Cu 四种元素的第一电离能由大到小的顺序为__________ 。
(1)基态铬原子的价层电子排布式为
(2)已知常温下,H2CrO4的K1=4.1、K2=1×10-5,从结构的角度上看,K2<<K1的原因是
(3)SO2与氧气在V2O5催化作用下反应可转化为SO3,则转化过程中
a.中心原子轨道杂化类型 b.键角 c.分子的极性
(4)+5价钒能形成多种含氧酸根盐,其中某种钠盐的酸根离子是一种具有无限链状结构的离子(见下图),则该酸根离子的化学式为

(5)CuSO4溶液中Cu2+是以[Cu(H2O)4]2+形式存在的,向CuSO4溶液中加入过量氨水后会得到[Cu(NH3)4]2+,则上述两种配离子中稳定性较强的是
您最近一年使用:0次



