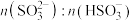(1)室温下在

 的
的 溶液中通入
溶液中通入 ,溶液中含碳物种的浓度
,溶液中含碳物种的浓度
 (不考虑通入
(不考虑通入 所引起的溶液体积变化和
所引起的溶液体积变化和 的挥发)。已知:
的挥发)。已知: 电离常数分别为
电离常数分别为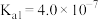 、
、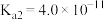 。
。①
 恰好完全转化为
恰好完全转化为 时,溶液中所含离子浓度由小到大的顺序为
时,溶液中所含离子浓度由小到大的顺序为
②若吸收

 ,则溶液中
,则溶液中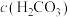
 (填“>”“<”或“=”),原因是
(填“>”“<”或“=”),原因是③常温下,

 溶液的
溶液的 ,则该溶液中
,则该溶液中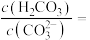
(2)
 时,
时, 催化加氢法合成乙烯反应为:
催化加氢法合成乙烯反应为: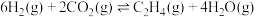
 。向2L的恒容密闭容器中加入
。向2L的恒容密闭容器中加入
 和
和
 ,在催化剂作用下发生反应,测得平衡时体系中各气体的物质的量随温度的变化关系如图所示。
,在催化剂作用下发生反应,测得平衡时体系中各气体的物质的量随温度的变化关系如图所示。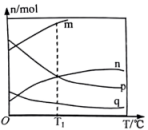
②
 下,自初始状态达到平衡时,放热为
下,自初始状态达到平衡时,放热为
 的平衡转化率为
的平衡转化率为 )常用作还原剂。已知常温下,草酸的电离常数
)常用作还原剂。已知常温下,草酸的电离常数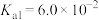 ,
,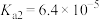 ,碳酸的电离常数
,碳酸的电离常数 ,
, 。回答下列问题:
。回答下列问题:(1)
 发生第一步水解的离子方程式为
发生第一步水解的离子方程式为(2)相同条件下,同浓度的①
 ,②
,② ,③
,③ ,④
,④ 四种溶液的pH由大到小的顺序为
四种溶液的pH由大到小的顺序为(3)将等浓度、等体积的
 溶液与盐酸混合,溶液显酸性。混合后所得溶液中下列关系成立的是
溶液与盐酸混合,溶液显酸性。混合后所得溶液中下列关系成立的是a.
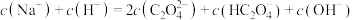
b.

c.

d.

(4)
 溶液常用作氧化还原滴定的标准液。实验室欲配制250 mL 0.10 mol·L-1的
溶液常用作氧化还原滴定的标准液。实验室欲配制250 mL 0.10 mol·L-1的 溶液。
溶液。①需托盘天平称取
 固体
固体②配制溶液时,需要的玻璃仪器除烧杯、玻璃棒、量筒外还应有
(5)用
 标准液测定某高锰酸钾样品的纯度:
标准液测定某高锰酸钾样品的纯度:步骤I:称取2.0g高锰酸钾样品,配成100mL溶液,取20mL溶液于锥形瓶中,并加入少量硫酸酸化。
步骤II:用(4)中配制的
 标准液进行滴定,平行滴定三次,记录消耗
标准液进行滴定,平行滴定三次,记录消耗 溶液的体积如下表:
溶液的体积如下表:| 第1次 | 第2次 | 第3次 | |
消耗 溶液的体积/mL 溶液的体积/mL | 49.80 | 46.75 | 50.20 |
②样品中
 的质量分数为
的质量分数为③若(4)中称取的
 固体已部分吸水潮解,会使测得的样品中
固体已部分吸水潮解,会使测得的样品中 的质量分数
的质量分数 随V(NaOH)的变化关系如图所示。[比如R-的分布系数:
随V(NaOH)的变化关系如图所示。[比如R-的分布系数: ]。下列说法正确的是
]。下列说法正确的是
| A.曲线L2表示δ(R-) |
| B.某c(R-):c(HR)=9:1的缓冲溶液pH≈6 |
| C.Kh(R-)的数量级为11-10 |
D.a点溶液中: |
(1)25℃,不同pH条件下,水溶液中碳元素的存在形态如图所示。
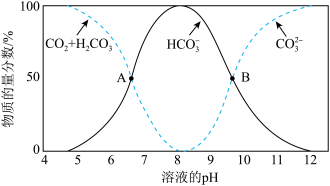
①下列说法正确的是
a.A点,溶液中H2CO3和HCO
 浓度相同
浓度相同b.pH=8时,溶液中含碳元素的微粒主要是HCO

c.当c(HCO
 )=c(CO
)=c(CO )时,c(H+)>c(OH﹣)
)时,c(H+)>c(OH﹣)②上述中性水溶液中,阴离子浓度由大到小的关系是
(2)海水pH稳定在7.9~8.4之间,可用于烟道气中CO2和SO2的吸收剂。
①海水呈弱碱性是因为主要含有
②已知:25℃时,H2CO3电离平衡常数
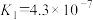 、
、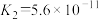 ;H2SO3电离平衡常数
;H2SO3电离平衡常数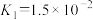 、
、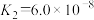 。海水中含有的HCO
。海水中含有的HCO 可用于吸收SO2,该过程的离子方程式是
可用于吸收SO2,该过程的离子方程式是(3)洗涤烟气后的海水呈酸性,需处理后再排放。通入O2可将酸性海水中的硫(Ⅳ)(主要以HSO
 形式存在)氧化,该反应的离子方程式是
形式存在)氧化,该反应的离子方程式是
A.若直线丙表示pH与 的变化关系,应该在甲、乙之间 的变化关系,应该在甲、乙之间 |
B.Ka2(H3PO4)=10-7.21,且NaH2PO4溶液中c(HPO )>c(H3PO4) )>c(H3PO4) |
C.c(HPO )=c(H3PO4)时,pH=4.48 )=c(H3PO4)时,pH=4.48 |
D.Na2HPO4溶液中: |
(1)25℃时,亚碲酸(H2TeO3)的
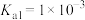 ,
,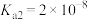 。常温下,NaHTeO3溶液的pH
。常温下,NaHTeO3溶液的pH(2)已知25℃时
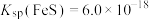 ,要使溶液中
,要使溶液中 沉淀完全[
沉淀完全[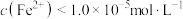 ],则需控制溶液中
],则需控制溶液中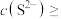
(3)室温下,测得用氨水吸收CO2时,溶液中含碳(氮)各粒子的物质的量分数和pH的关系如图,若所得溶液pH=10,则溶液中
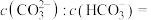
 )。
)。
(4)工业上常用氨水吸收含碳燃料燃烧中产生的温室气体CO2,其产物之一是NH4HCO3。已知常温下碳酸的电离常数
 ,
, ,
, 的电离常数
的电离常数 ,则所得的NH4HCO3溶液中
,则所得的NH4HCO3溶液中
 。
。(5)SOCl2是一种液态化合物,将其滴入水中,可观察到剧烈反应,液面上有白雾形成,并有带刺激性气味气体逸出,该气体可使品红溶液褪色。
①根据实验现象写出SOCl2和H2O反应的化学方程式:
②利用
 制备无水AlCl3时,可用SOCl2和
制备无水AlCl3时,可用SOCl2和 混合共热,试解释原因:
混合共热,试解释原因:7 . 在298 K时,向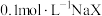 溶液加入
溶液加入 盐酸和向
盐酸和向 溶液加入
溶液加入 溶液,各混合溶液的pH与离子浓度变化关系如下图所示。下列说法正确的是
溶液,各混合溶液的pH与离子浓度变化关系如下图所示。下列说法正确的是

A.曲线 表示 表示 与pH的变化关系 与pH的变化关系 |
B.0.1 mol/L的YX溶液中存在: |
| C.a点时两溶液中水的电离程度相同 |
D. 的水解常数 的水解常数 |
8 . 烟气中的SO2可以用钠碱循环法加以处理,用Na2SO3溶液作为吸收液,当吸收液与SO2反应至pH为6左右时,可将吸收液通入电解槽进行再生,吸收液pH随微粒组成的变化关系见表:
| 91:9 | 1:1 | 9:91 |
pH | 8.2 | 7.2 | 6.2 |
回答下列问题:
(1)吸收液pH由8.2下降至6.2过程中发生反应的离子方程式为
(2)当吸收液呈中性时,溶液中

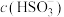 (填“>”“<”或“=”,下同);pH=7.2时,
(填“>”“<”或“=”,下同);pH=7.2时,
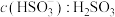 第二步电离平衡常数
第二步电离平衡常数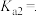
(3)NaHSO3﹣Na2SO3、H2CO3﹣NaHCO3,Na2HPO4﹣NaH2PO4都可组成缓冲溶液,缓冲溶液中lgx[x表示
 或
或 ]与pH的关系如图,当lgx数值在﹣1~1之间时具有可实用价值的缓冲能力,曲线
]与pH的关系如图,当lgx数值在﹣1~1之间时具有可实用价值的缓冲能力,曲线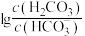 与pH的变化关系,应控制Na2HPO4﹣NaH2PO4缓冲溶液的pH范围为
与pH的变化关系,应控制Na2HPO4﹣NaH2PO4缓冲溶液的pH范围为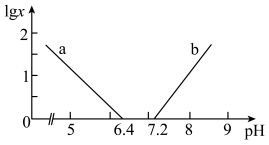
9 . 常温下,二元弱酸 溶液中含磷物种的浓度之和为0.1 mol⋅L
溶液中含磷物种的浓度之和为0.1 mol⋅L ,溶液中各含磷物种的pc-pOH关系如图所示。图中pc表示各含磷物种的浓度负对数(
,溶液中各含磷物种的pc-pOH关系如图所示。图中pc表示各含磷物种的浓度负对数(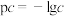 ),pOH表示
),pOH表示 的浓度的负对数
的浓度的负对数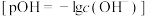 。下列有关说法正确的是
。下列有关说法正确的是
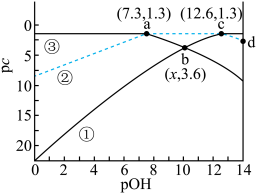
A.b点时,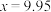 |
B.曲线②表示 随pOH的变化 随pOH的变化 |
C.d点溶液中: |
D. 溶液呈碱性是因为 溶液呈碱性是因为 离子的水解程度大于其电离程度 离子的水解程度大于其电离程度 |
10 . 氧族元素及其化合物在生产、生活中发挥着重要的作用。回答下列问题:
(1)工业上常用硫化物(FeS等)作沉淀剂除去废水中的
 等重金属离子。已知常温下CuS饱和溶液中,
等重金属离子。已知常温下CuS饱和溶液中, 和
和 关系如图所示,
关系如图所示,

(2)硒是人体必需的微量元素。工业上将含硒工业废料处理得到亚硒酸(
 )和硒酸(
)和硒酸( ),进而制备单质硒。亚硒酸(
),进而制备单质硒。亚硒酸( )在溶液中存在多种微粒形态,25℃时各微粒的分布系数δ与溶液pH的关系如图所示。(分布系数即组分的平衡浓度占总浓度的分数)
)在溶液中存在多种微粒形态,25℃时各微粒的分布系数δ与溶液pH的关系如图所示。(分布系数即组分的平衡浓度占总浓度的分数)
①将KOH滴入 溶液中,当pH达到2.0时,发生反应的离子方程式是
溶液中,当pH达到2.0时,发生反应的离子方程式是
②25℃时, 溶液的
溶液的 ,通过计算和必要的文字加以解释:
,通过计算和必要的文字加以解释:
③已知硒酸的电离方程式为: ,
, 。25℃时,下列关于0.1 mol⋅L
。25℃时,下列关于0.1 mol⋅L
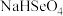 溶液的说法错误的是
溶液的说法错误的是
A.
B.
C. mol⋅L
mol⋅L
D.