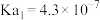名校
1 . 25℃时,部分物质的电离平衡常数如表所示:
(1)物质的量浓度均为 的下列四种溶液:pH由大到小排列的顺序是
的下列四种溶液:pH由大到小排列的顺序是________ (填序号)。① ;②
;② ;③
;③ ;④NaClO
;④NaClO
(2)标准状况下将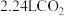 ,通入
,通入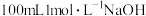 溶液中,所得混合溶液中离子间的元素守恒关系为:
溶液中,所得混合溶液中离子间的元素守恒关系为:________ ;溶液中离子浓度由大到小的顺序:________ 。
(3)5℃时,将 的醋酸溶液与
的醋酸溶液与 的氢氧化钠溶液等体积混合,反应后溶液恰好显中性,表示醋酸的电离平衡常数
的氢氧化钠溶液等体积混合,反应后溶液恰好显中性,表示醋酸的电离平衡常数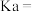
________ (用含a、b的代数式表示)。
(4)水垢中含有 ,难用酸除去,可先用
,难用酸除去,可先用 溶液浸泡处理后转化为疏松、易溶于酸的
溶液浸泡处理后转化为疏松、易溶于酸的 ,再用酸处理。用
,再用酸处理。用 溶液浸泡处理的反应为
溶液浸泡处理的反应为________ (用离子方程式表示)。
(5)某小组同学利用已知浓度的高锰酸钾标准溶液探究测定草酸晶体 中的x值。
中的x值。
第一步:称取1.260g纯草酸晶体,将其制成100.00mL水溶液为待测液。
第二步:取25.00mL待测液放入锥形瓶中,再加入适量的稀 。
。
第三步:用浓度为0.1000mol/L的 标准溶液进行滴定,达到终点时消耗10.00mL。
标准溶液进行滴定,达到终点时消耗10.00mL。
(已知: )
)
①达到滴定终点的判断依据是________ 。
②通过上述数据,求得
________ 。下列操作可能造成测得x值偏小的是________ 。
A.没有润洗锥形瓶
B.滴定过程中加入少量蒸馏水冲洗锥形瓶壁
C.装有 的滴定管滴定前尖嘴处有气泡,滴定后气泡消失
的滴定管滴定前尖嘴处有气泡,滴定后气泡消失
D.滴定终点读数时俯视滴定管
化学式 |
|
| HClO |
电离平衡常数(Ka) |
|
|
|
 的下列四种溶液:pH由大到小排列的顺序是
的下列四种溶液:pH由大到小排列的顺序是 ;②
;② ;③
;③ ;④NaClO
;④NaClO(2)标准状况下将
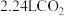 ,通入
,通入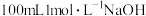 溶液中,所得混合溶液中离子间的元素守恒关系为:
溶液中,所得混合溶液中离子间的元素守恒关系为:(3)5℃时,将
 的醋酸溶液与
的醋酸溶液与 的氢氧化钠溶液等体积混合,反应后溶液恰好显中性,表示醋酸的电离平衡常数
的氢氧化钠溶液等体积混合,反应后溶液恰好显中性,表示醋酸的电离平衡常数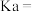
(4)水垢中含有
 ,难用酸除去,可先用
,难用酸除去,可先用 溶液浸泡处理后转化为疏松、易溶于酸的
溶液浸泡处理后转化为疏松、易溶于酸的 ,再用酸处理。用
,再用酸处理。用 溶液浸泡处理的反应为
溶液浸泡处理的反应为(5)某小组同学利用已知浓度的高锰酸钾标准溶液探究测定草酸晶体
 中的x值。
中的x值。第一步:称取1.260g纯草酸晶体,将其制成100.00mL水溶液为待测液。
第二步:取25.00mL待测液放入锥形瓶中,再加入适量的稀
 。
。第三步:用浓度为0.1000mol/L的
 标准溶液进行滴定,达到终点时消耗10.00mL。
标准溶液进行滴定,达到终点时消耗10.00mL。(已知:
 )
)①达到滴定终点的判断依据是
②通过上述数据,求得

A.没有润洗锥形瓶
B.滴定过程中加入少量蒸馏水冲洗锥形瓶壁
C.装有
 的滴定管滴定前尖嘴处有气泡,滴定后气泡消失
的滴定管滴定前尖嘴处有气泡,滴定后气泡消失D.滴定终点读数时俯视滴定管
您最近一年使用:0次
名校
解题方法
2 . 某 Na2CO3溶液体系中满足c( )+c(
)+c( )+ c(H2CO3)=0.1mol·L−1,现利用平衡移动原理,分析常 温下Ni2+在不同 pH 的Na2CO3体系中的可能产物。图1中曲线表示 Na2CO3 体系中各含碳粒子的物质的量分数与 pH 的关系;图2为沉淀溶解平衡曲线。下列说法正确的是
)+ c(H2CO3)=0.1mol·L−1,现利用平衡移动原理,分析常 温下Ni2+在不同 pH 的Na2CO3体系中的可能产物。图1中曲线表示 Na2CO3 体系中各含碳粒子的物质的量分数与 pH 的关系;图2为沉淀溶解平衡曲线。下列说法正确的是

 )+c(
)+c( )+ c(H2CO3)=0.1mol·L−1,现利用平衡移动原理,分析常 温下Ni2+在不同 pH 的Na2CO3体系中的可能产物。图1中曲线表示 Na2CO3 体系中各含碳粒子的物质的量分数与 pH 的关系;图2为沉淀溶解平衡曲线。下列说法正确的是
)+ c(H2CO3)=0.1mol·L−1,现利用平衡移动原理,分析常 温下Ni2+在不同 pH 的Na2CO3体系中的可能产物。图1中曲线表示 Na2CO3 体系中各含碳粒子的物质的量分数与 pH 的关系;图2为沉淀溶解平衡曲线。下列说法正确的是
| A.lgKa1(H2CO3)=6.37 |
B.M 点时,溶液中存在:c( )<c(OH−) )<c(OH−) |
C.某混合液体系中,初始状态为pH=9 、1g[c(Ni2+)]= −5, 当体系达平衡后存在:c( )+c( )+c( )+c(H2CO3)<0.1mol/L )+c(H2CO3)<0.1mol/L |
| D.沉淀 Ni2+制备NiCO3 时,选用0.1mol·L−1NaHCO3 溶液比0.1mol·L−1Na2CO3溶液的效果好 |
您最近一年使用:0次
2024-01-02更新
|
297次组卷
|
4卷引用:吉林省四校期初联考2023-2024学年高二下学期开学考试化学试题
名校
解题方法
3 .  是食品加工中最为快捷的食品添加剂,用于焙烤食品;
是食品加工中最为快捷的食品添加剂,用于焙烤食品; 在分析试剂、医药、电子工业中用途广泛。请回答下列问题:
在分析试剂、医药、电子工业中用途广泛。请回答下列问题:
(1) 可作净水剂,其理由是
可作净水剂,其理由是___________ (用必要的化学用语和相关文字说明)。
(2)常温,① 的
的 ,②
,② 的盐酸,③
的盐酸,③ 的氨水溶液,④
的氨水溶液,④ 的碳酸钠溶液中水电离出氢离子浓度从小到大排列顺序
的碳酸钠溶液中水电离出氢离子浓度从小到大排列顺序___________ (填序号)。
(3) 的二元酸
的二元酸 溶液中
溶液中 、
、 、
、 的物质的量分数
的物质的量分数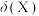 随pH变化如图所示。
随pH变化如图所示。

 分两步发生电离,对应的电离平衡常数分别为
分两步发生电离,对应的电离平衡常数分别为 和
和 :
:
①
___________ ,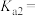
___________ 。
②将 的
的 溶液和
溶液和 盐酸等体积混合,所得溶液中
盐酸等体积混合,所得溶液中
___________ (具体)。
③ 的
的 溶液中,溶液中离子浓度由大到小的顺序为
溶液中,溶液中离子浓度由大到小的顺序为___________ ,写出该溶液的质子守恒___________ 。
 是食品加工中最为快捷的食品添加剂,用于焙烤食品;
是食品加工中最为快捷的食品添加剂,用于焙烤食品; 在分析试剂、医药、电子工业中用途广泛。请回答下列问题:
在分析试剂、医药、电子工业中用途广泛。请回答下列问题:(1)
 可作净水剂,其理由是
可作净水剂,其理由是(2)常温,①
 的
的 ,②
,② 的盐酸,③
的盐酸,③ 的氨水溶液,④
的氨水溶液,④ 的碳酸钠溶液中水电离出氢离子浓度从小到大排列顺序
的碳酸钠溶液中水电离出氢离子浓度从小到大排列顺序(3)
 的二元酸
的二元酸 溶液中
溶液中 、
、 、
、 的物质的量分数
的物质的量分数 随pH变化如图所示。
随pH变化如图所示。
 分两步发生电离,对应的电离平衡常数分别为
分两步发生电离,对应的电离平衡常数分别为 和
和 :
:①

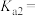
②将
 的
的 溶液和
溶液和 盐酸等体积混合,所得溶液中
盐酸等体积混合,所得溶液中
③
 的
的 溶液中,溶液中离子浓度由大到小的顺序为
溶液中,溶液中离子浓度由大到小的顺序为
您最近一年使用:0次
名校
解题方法
4 . 常温下,向 三元酸
三元酸 溶液中滴加
溶液中滴加 的NaOH溶液,溶液中含A微粒的物质的量分数(
的NaOH溶液,溶液中含A微粒的物质的量分数( )随溶液pH的变化如图所示,下列说法正确的是
)随溶液pH的变化如图所示,下列说法正确的是
 三元酸
三元酸 溶液中滴加
溶液中滴加 的NaOH溶液,溶液中含A微粒的物质的量分数(
的NaOH溶液,溶液中含A微粒的物质的量分数( )随溶液pH的变化如图所示,下列说法正确的是
)随溶液pH的变化如图所示,下列说法正确的是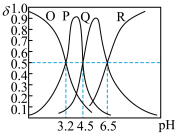
A.P为 的物质的量分数与溶液pH的关系曲线 的物质的量分数与溶液pH的关系曲线 |
| B.该三元酸的第一步电离是完全的 |
C.常温下, 的水解常数 的水解常数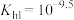 |
| D.当加入100mL NaOH溶液时,溶液显酸性 |
您最近一年使用:0次
2023-12-12更新
|
241次组卷
|
4卷引用:吉林省白山市抚松县第一中学2023-2024学年高二上学期12月月考化学试题
吉林省白山市抚松县第一中学2023-2024学年高二上学期12月月考化学试题河南省创新发展联盟2023-2024学年高二上学期第四次联考化学试题(已下线)寒假作业06 盐类的水解-【寒假分层作业】2024年高二化学寒假培优练(人教版2019)河南省郑州学森实验学校2023-2024学年高二上学期1月月考 化学试题
名校
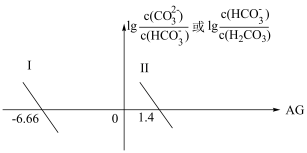
5 . 室温下,向一定浓度的Na2CO3溶液中滴加盐酸,溶液中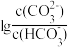 、
、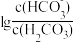 随溶液酸度AG[AG=
随溶液酸度AG[AG= ]的变化如图所示。下列说法正确的是
]的变化如图所示。下列说法正确的是
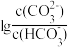 、
、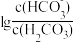 随溶液酸度AG[AG=
随溶液酸度AG[AG= ]的变化如图所示。下列说法正确的是
]的变化如图所示。下列说法正确的是
A.Ⅱ表示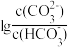 随AG的变化 随AG的变化 |
B.AG=0时,溶液中c(Na+)=2c( )+c( )+c( ) ) |
C.随着AG的增大, 的值保持不变 的值保持不变 |
| D.H2CO3的Ka1=10-10.33 |
您最近一年使用:0次
2023-11-14更新
|
854次组卷
|
5卷引用:吉林省四平市第一高级中学2023-2024学年高二上学期第二次月考化学试卷
吉林省四平市第一高级中学2023-2024学年高二上学期第二次月考化学试卷河北省石家庄精英中学2023-2024学年高三上学期第二次调研(期中)考试化学试题(已下线)选择题21-23(已下线)题型03 电解质溶液图像分析-2024年高考化学答题技巧与模板构建(已下线)选择题11-14
名校
6 . 25℃时,向一定物质的量浓度的有机酸( )中加入
)中加入 溶液改变溶液的pH (忽略过程中溶液的温度变化),溶液中含R微粒的分布分数(平衡时,某种含R微粒的浓度÷各种含R微粒浓度之和×100%)与溶液pH的变化关系如图所示。下列叙述错误的是
溶液改变溶液的pH (忽略过程中溶液的温度变化),溶液中含R微粒的分布分数(平衡时,某种含R微粒的浓度÷各种含R微粒浓度之和×100%)与溶液pH的变化关系如图所示。下列叙述错误的是

 )中加入
)中加入 溶液改变溶液的pH (忽略过程中溶液的温度变化),溶液中含R微粒的分布分数(平衡时,某种含R微粒的浓度÷各种含R微粒浓度之和×100%)与溶液pH的变化关系如图所示。下列叙述错误的是
溶液改变溶液的pH (忽略过程中溶液的温度变化),溶液中含R微粒的分布分数(平衡时,某种含R微粒的浓度÷各种含R微粒浓度之和×100%)与溶液pH的变化关系如图所示。下列叙述错误的是
A.曲线③表示 的分布分数与溶液pH的变化 的分布分数与溶液pH的变化 |
B.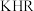 溶液中存在: 溶液中存在: |
C.Y点溶液中存在: |
D.当溶液的pH=7时,存在: |
您最近一年使用:0次
2023-11-04更新
|
806次组卷
|
5卷引用:吉林省松原市前郭县第五高级中学2023~2024学年高二上学期期中考试化学试题
名校
7 . 下列实验中,由实验现象或结果不能得到相关结论的是
| 选项 | 实验操作和现象 | 结论 |
| A | 25℃时,用pH试纸测得 溶液的pH为11 溶液的pH为11 |  为弱电解质 为弱电解质 |
| B | 往滴有酚酞的碳酸钠溶液中加入适量 固体,溶液颜色变浅 固体,溶液颜色变浅 | 碳酸钠溶液中存在水解平衡 |
| C | 25℃时,往 溶液中滴加甲基橙溶液,溶液变红 溶液中滴加甲基橙溶液,溶液变红 | 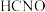 的电离平衡常数大于 的电离平衡常数大于 的电离平衡常数 的电离平衡常数 |
| D | 往等体积、等pH的 溶液和 溶液和 溶液中分别加入足量锌粉,充分反应后, 溶液中分别加入足量锌粉,充分反应后, 溶液产生更多的氢气 溶液产生更多的氢气 | 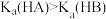 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
2023-11-04更新
|
408次组卷
|
2卷引用:吉林省松原市前郭县第五高级中学2023~2024学年高二上学期期中考试化学试题
名校
解题方法
8 . NaClO溶液具有漂白能力,已知25℃时,Ka(HClO)=4.0×10-8。下列关于NaClO溶液说法正确的是
| A.0.01mol/LNaClO溶液中,c(ClO-)=0.01mol/L |
| B.长期露置在空气中,释放Cl2,漂白能力减弱 |
C.通入过量SO2,反应的离子方程式为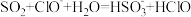 |
| D.25℃,pH=7.0的NaClO和HClO的混合溶液中,c(HClO)>c(ClO-)=c(Na+) |
您最近一年使用:0次
2023-08-28更新
|
258次组卷
|
3卷引用:吉林省长春市朝阳区长春外国语学校2022-2023学年高二上学期11月期中化学试题
名校
解题方法
9 .  ,已知醋酸的电离常数为
,已知醋酸的电离常数为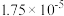 ,将
,将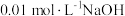 溶液滴入
溶液滴入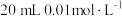
 溶液的过程中,溶液中由水电离出的
溶液的过程中,溶液中由水电离出的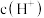 与加入
与加入 溶液体积的关系如图所示。下列说法正确的是
溶液体积的关系如图所示。下列说法正确的是

 ,已知醋酸的电离常数为
,已知醋酸的电离常数为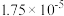 ,将
,将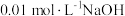 溶液滴入
溶液滴入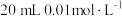
 溶液的过程中,溶液中由水电离出的
溶液的过程中,溶液中由水电离出的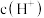 与加入
与加入 溶液体积的关系如图所示。下列说法正确的是
溶液体积的关系如图所示。下列说法正确的是
A.b、d两点溶液的 相同 相同 |
B.b点溶液中离子浓度大小顺序是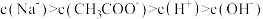 |
C.e点所示溶液中,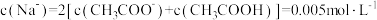 |
D.滴定过程中, 与 与 的比值逐渐减小 的比值逐渐减小 |
您最近一年使用:0次
2023-05-28更新
|
420次组卷
|
2卷引用:吉林省辽源市田家炳高中友好学校七十六届期末联考2023-2024学年高二上学期1月期末化学试题
10 . 电解质水溶液中存在电离平衡、水解平衡、溶解平衡,回答下列问题。
(1)已知部分弱酸的电离常数如下表:
①0.1mol·L-1NaCN溶液和0.1mol·L-1NaHCO3溶液中,c(CN-)___________ c( )(填“>”“<”或“=”)。
)(填“>”“<”或“=”)。
②常温下,pH相同的三种溶液:A.CH3COONa B.NaCN C.Na2CO3,其物质的量浓度由大到小的顺序是___________ (填编号)。
③将少量CO2通入NaCN溶液,反应的离子方程式是___________ 。
④室温下,一定浓度的CH3COONa溶液pH=9,用离子方程式表示溶液呈碱性的原因是___________ ,溶液中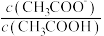 =
=___________ 。
(2)室温下,用0.100mol·L-1盐酸滴定20.00mL0.100mol·L-1的氨水,滴定曲线如图所示。

①d点所示的溶液中离子浓度由大到小的顺序依次为___________ 。
②b点所示的溶液中c( )-c(NH3·H2O)=
)-c(NH3·H2O)=___________ (用溶液中的其他离子浓度表示)。
(1)已知部分弱酸的电离常数如下表:
| 弱酸 | CH3COOH | HCN | H2CO3 |
| 电离常数(25℃) | Ka=1.8×10-5 | Ka=4.3×10-10 | Ka1=5.0×10-7 Ka2=5.6×10-11 |
 )(填“>”“<”或“=”)。
)(填“>”“<”或“=”)。②常温下,pH相同的三种溶液:A.CH3COONa B.NaCN C.Na2CO3,其物质的量浓度由大到小的顺序是
③将少量CO2通入NaCN溶液,反应的离子方程式是
④室温下,一定浓度的CH3COONa溶液pH=9,用离子方程式表示溶液呈碱性的原因是
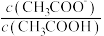 =
=(2)室温下,用0.100mol·L-1盐酸滴定20.00mL0.100mol·L-1的氨水,滴定曲线如图所示。

①d点所示的溶液中离子浓度由大到小的顺序依次为
②b点所示的溶液中c(
 )-c(NH3·H2O)=
)-c(NH3·H2O)=
您最近一年使用:0次